 Si stima che circa il 30% delle pazienti affette da tumore mammario utilizza almeno una terapia complementare oltre quelle convenzionali (chirurgia, terapia ormonale, radioterapia e chemioterapia). Le terapie complementari sono un insieme di Continua a leggere
Si stima che circa il 30% delle pazienti affette da tumore mammario utilizza almeno una terapia complementare oltre quelle convenzionali (chirurgia, terapia ormonale, radioterapia e chemioterapia). Le terapie complementari sono un insieme di Continua a leggere
Archivi tag: terapie
Chemioterapia: durata, in pastiglie, come funziona, fa male, perché farla?
 Con “chemioterapia” in medicina oncologica si descrive una modalità terapeutica che distrugge le cellule neoplastiche attraverso la somministrazione di farmaci particolari, chiamati chemioterapici. La chemioterapia può essere sistemica o loco-regionale (a seconda del campo d’azione del farmaco) e può essere neoadiuvante o adiuvante.
Con “chemioterapia” in medicina oncologica si descrive una modalità terapeutica che distrugge le cellule neoplastiche attraverso la somministrazione di farmaci particolari, chiamati chemioterapici. La chemioterapia può essere sistemica o loco-regionale (a seconda del campo d’azione del farmaco) e può essere neoadiuvante o adiuvante.
I farmaci chemioterapici sono di vari tipologie e possono essere assunti:
- per bocca in forma di compresse;
- iniettati per via endovenosa o intramuscolare;
nella colonna spinale; - in una cavità organica;
- in un organo.
Funzionamento della chemioterapia
La maggior parte dei chemioterapici antitumorali disponibili danneggia e provoca la morte delle cellule tumorali interferendo, con modalità differenti, con la sintesi del DNA e, quindi, con la capacità delle cellule di crescere e moltiplicarsi. Anche la chemioterapia, come la radioterapia, può purtroppo danneggiare cellule normali, in particolare quelle che si dividono più rapidamente, e ciò può determinare effetti collaterali tipici come perdita di capelli, nausea, vomito e anemia. La modalità di attuazione della chemioterapia dipende dal tipo e dallo stadio del tumore ma anche in base alle condizioni generali del paziente. La chemioterapia è spesso usata in associazione a chirurgia e radioterapia per trattare tumori diffusi e recidive o nel caso in cui ci sia forte probabilità di recidiva.
Leggi anche:
- Differenza tra chemioterapia adiuvante e neoadiuvante
- Differenza tra chemioterapia sistemica e loco-regionale
- Chemioterapia: gli effetti collaterali più e meno comuni
- Chemioterapia: durata effetti collaterali ed effetti di lunga durata
Perché è utile sottoporsi a chemioterapia?
La scelta di sottoporre un paziente a chemioterapia può mirare nei diversi casi a obiettivi differenti:
- eliminare definitivamente la malattia, nel caso di tumori molto sensibili a questi trattamenti;
- ridurre il volume della massa tumorale prima di un’operazione chirurgica o della radioterapia (chemioterapia neoadiuvante) così da rendere l’intervento più efficace e meno demolitivo e poter limitare l’irradiazione a zone più ristrette;
- prevenire il ritorno della malattia trattata con un intervento chirurgico o con la radioterapia, eliminando cellule tumorali che possono essersi staccate dal tumore e diffuse in altre parti del corpo, pur non avendo ancora dato luogo a metastasi rilevabili con gli strumenti diagnostici attualmente a disposizione (chemioterapia adiuvante o precauzionale);
- prolungare la sopravvivenza o ritardare la progressione della malattia quando questa non può essere eliminata del tutto, per esempio perché già diffusa nell’organismo;
- migliorare i sintomi provocati dalla massa tumorale quando questa non si può asportare chirurgicamente, per limitare gli effetti legati all’ostruzione di canali (per esempio un bronco o l’intestino) e alla compressione degli organi vicini (per esempio all’interno della scatola cranica);
- preparare l’organismo a un trapianto di midollo osseo o di cellule staminali. In questo caso si utilizzano dosi molto alte di farmaci.
Chemioterapia: durata
La somministrazione dei farmaci chemioterapici avviene in modo variabile in base a vari fattori (adiuvante, neoadiuvante, tipo ed estensione di tumore…). Generalmente vengono somministrati al paziente attraverso cicli di trattamento a cadenza variabile (settimanale, trisettimanale…). La durata di ogni somministrazione può variare (da minuti a ore) a seconda dei farmaci utilizzati; generalmente le sedute sono eseguite in regime ambulatoriale e solo in alcuni casi particolari può essere necessario il ricovero in ospedale.
In genere la chemioterapia si prolunga per un periodo che va da tre a sei mesi, nel corso del quale si effettuano in genere da tre-quattro a sei-otto cicli di trattamento.
Il programma tuttavia può cambiare in relazione al tipo di malattia, al singolo paziente e alla reazione individuale alle cure.Ricordiamo che con “ciclo di trattamento” si intende il periodo in cui si riceve il trattamento e la fase di intervallo prima di quello successivo. Un ciclo di 3 settimane, per esempio, può prevedere la somministrazione dei farmaci solo al primo giorno, e 20 giorni senza trattamenti.
La chemioterapia fa male?
Alcune cellule del nostro corpo condividono con le cellule tumorali una caratteristica: la capacità di crescere molto rapidamente. Per questo i farmaci chemioterapici, che agiscono sulla capacità delle cellule di moltiplicarsi, possono distruggere anche alcune cellule sane che si riproducono attivamente, come già accennato all’inizio dell’articolo. Tra queste ci sono le cellule del sangue, quelle dei follicoli piliferi, che producono peli e capelli, le cellule che rivestono la bocca, lo stomaco e l’intestino, e quelle degli organi riproduttivi. Il danno a queste cellule è la causa dei principali effetti collaterali della chemioterapia, come la perdita di capelli, l’anemia, la stanchezza, la nausea, il vomito, la diarrea, le infezioni, la formazione di lividi o piccole emorragie. Tuttavia i tessuti normali hanno la capacità di rimediare a questi effetti negativi una volta che la terapia è terminata, e per questo la probabilità di effetti collaterali a lungo termine è molto ridotta, gli effetti collaterali stessi tendono a sparire precocemente al termine della terapia. In ogni caso i vantaggi della chemioterapia (adiuvante o neoadiuvante) sono comunque maggiori rispetto ai danni ed agli effetti collaterali: questo va tenuto sempre a mente.
Leggi anche:
- Differenza tra radioterapia e chemioterapia
- E’ più “pesante” la chemioterapia o la radioterapia?
- Quando si fa la radioterapia e quando la chemioterapia?
- La chemioterapia può provocare un secondo tumore?
- La chemioterapia uccide? Il lato oscuro della terapia antitumorale
- Chemioterapia senza caduta capelli: ecco la cuffia per non perderli
- Quando non fare chemioterapia? Le controindicazioni
- Chemioterapia in gravidanza: può far male al bambino?
- Quanti tipi di chemioterapia esistono?
- Chemioterapia: modi di assunzione dei farmaci chemioterapici
- Chemioterapia: schemi e durata dei cicli di trattamento
- Come ci si prepara alla chemioterapia: cosa fare prima?
- Chemioterapia a domicilio o in ospedale: dove farla?
- Chemioterapia: quali effetti collaterali mi devo aspettare?
- Differenza tra remissione parziale, totale e guarigione
- Differenza tra esame istologico, biopsia, agoaspirato ed agobiopsia
- Quando si fa l’esame istologico e perché?
- Differenza tra tumore benigno, maligno, neoplasia, cancro e metastasi
- Differenza tra adenocarcinoma e carcinoma con esempi
- Cos’è un tumore? Perché viene il cancro? Quali sono le cause?
- Differenza tra cancro e carcinoma con esempi
- Stadiazione e classificazione TNM: cancro curabile o terminale?
- Cosa sono le metastasi? Tutti i tumori danno metastasi?
- Gli uomini possono avere il tumore al seno?
- Differenza tra metaplasia, displasia e neoplasia con esempi
- Differenza tra tumore e tessuto normale con esempi
- Cancro al seno: sintomi precoci, diagnosi, terapia e prevenzione
- La visita senologica: come, quando e perchè farla?
- A cosa serve e come si fa l’autopalpazione del seno?
- Riconoscere il cancro al seno: sintomi precoci e tardivi
- Tumore al seno: sintomi e segni visibili
- Tumore al seno: stadiazione, prognosi e sopravvivenza
- Cancro al seno: metastasi e sintomi avanzati del tumore
- Differenza tra ecografia e mammografia nella diagnosi di tumore al seno
- Noduli al seno: quando preoccuparsi ed andare dal medico?
- Differenza tra prevenzione primaria, secondaria e terziaria con esempi
- Capire se si ha un tumore: come viene diagnosticato un cancro
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Come prevenire i tumori ed il cancro? I 10 cambiamenti consigliati
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Ipertrofia muscolare: cosa significa e come si raggiunge
- Differenza tra ipertrofia ed iperplasia con esempi
- Differenza tra iperplasia e neoplasia
- Differenza tra atrofia, distrofia ed aplasia con esempi
- Esofago di Barrett: sintomi iniziali, diagnosi, terapia, dieta e chirurgia
- Tumore del colon retto: diagnosi, metastasi, prognosi e stadiazione
- Tumore del colon retto: sintomi iniziali, tardivi e ritardo nella diagnosi
- Tumore del colon retto: trattamento chirurgico, radioterapia e chemioterapia
- Tumore del colon retto con metastasi: chirurgia, chemioterapia e terapie biologiche
- Tumore del colon retto: terapia personalizzata col test RAS
- Anticorpi monoclonali contro il tumore del colon retto metastatico
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Fibrosi polmonare idiopatica: sintomi, progressione e cure
 Il termine “fibrosi polmonare” comprende una serie di malattie in cui avviene una produzione eccessiva di tessuto cicatriziale che si insinua tra gli alveoli che può indurre una fibrosi. Questa può esser provocata ad esempio dall’inalazione di polveri, gas tossici o vapori, ma anche da infezioni, radiazioni o dall’assunzione di determinati farmaci. Tuttavia, ancora oggi causa di una fibrosi polmonare su due è resta sconosciuta (idiopatica): per questo viene denominata fibrosi polmonare idiopatica (abbreviato IPF, dall’inglese idiopathic pulmonary fibrosis). E’ una malattia particolarmente subdola: può essere ignorata per anni. I sintomi si manifestano solo quando ormai i polmoni sono già molto lesionati: si tratta per lo più di tosse secca e dispnea da sforzo.
Il termine “fibrosi polmonare” comprende una serie di malattie in cui avviene una produzione eccessiva di tessuto cicatriziale che si insinua tra gli alveoli che può indurre una fibrosi. Questa può esser provocata ad esempio dall’inalazione di polveri, gas tossici o vapori, ma anche da infezioni, radiazioni o dall’assunzione di determinati farmaci. Tuttavia, ancora oggi causa di una fibrosi polmonare su due è resta sconosciuta (idiopatica): per questo viene denominata fibrosi polmonare idiopatica (abbreviato IPF, dall’inglese idiopathic pulmonary fibrosis). E’ una malattia particolarmente subdola: può essere ignorata per anni. I sintomi si manifestano solo quando ormai i polmoni sono già molto lesionati: si tratta per lo più di tosse secca e dispnea da sforzo.
Qual è la causa di questa malattia?
La IPF è fondamentalmente una malattia cronica rara, non contagiosa: studi recenti evidenziano una frequenza da 6 a 20 casi ogni 100’000 individui. Generalmente la malattia viene diagnosticata più spesso negli uomini che abbiano superato i 50 anni d’età. L’IPF si manifesta più frequentemente in alcuni gruppi familiari, quindi probabilmente i fattori genetici giocano un ruolo importante. La scienza ritiene comunque che nei pazienti affetti da IPF la rigenerazione del tessuto nei polmoni sia pregiudicata. I processi di riparazione sono compromessi e possono condurre alla cicatrizzazione del tessuto. Si tratta di un processo molto complesso che la ricerca non è ancora in grado di spiegare.
Come viene diagnosticata la IPF?
La IPF per lo più viene ignorata a lungo. I sintomi più frequenti sono tosse secca e dispnea, inizialmente sotto sforzo, in seguito anche allo stato di riposo. Nel momento in cui tali disturbi si manifestano, la malattia è già a uno stadio avanzato. La diagnosi deve essere confermata di regola in collaborazione tra pneumologi, patologi e radiologi: il test di funzionalità polmonare valuta l’efficienza dell’apparato respiratorio. Gli esami clinici e la TAC (tomografia assiale computerizzata) ad alta risoluzione confermano o meno la diagnosi. Gli pneumologi riconoscono l’immagine clinico-radiologica della fibrosi polmonare: la tipica «struttura a nido d’ape» nel tessuto. A seconda dei casi si richiede anche una broncoscopia, un esame endoscopico dei polmoni al fine di prelevare piccoli frammenti di tessuto. Se sono state escluse le altre cause note di fibrosi polmonare, si è in presenza di una IPF.
Come progredisce la IPF?
Il processo fibrotico con ispessimento dell’interstizio, provoca progressivo irrigidimento del polmone e perdita di elasticità. A causa di questo irrigidimento, respirare diventa più faticoso. Con il passare del tempo il tessuto cicatrizzato, privo di funzione, sostituisce il tessuto polmonare sano. Il volume dei polmoni diminuisce e il normale passaggio dell’ossigeno nel sangue diventa sempre più difficile. Le persone colpite soffrono di una dispnea che si aggrava progressivamente e di tosse secca. La IPF può progredire molto rapidamente: la durata media di sopravvivenza dopo la diagnosi è di varia dai 3 ai 5 anni, tuttavia si è a conoscenza di decorsi anche più lunghi.
Quali sono le terapie disponibili?
Le lesioni del tessuto polmonare sono irreversibili. I farmaci o altre misure terapeutiche impiegate attualmente possono rallentare solo in parte il processo di cicatrizzazione. I ricercatori ripongono molte speranze nei farmaci antifibrotici di nuova generazione, che evidentemente possono rallentare o arrestare il processo solo parzialmente. D’altro canto non si conoscono altri risultati dopo tanti anni di ricerca. Riguardo al trattamento si cerca di alleviare i disturbi, le complicazioni possibili ed evitare l’insorgere di malattie connesse. La terapia respiratoria e di movimento, nell’ambito di una riabilitazione polmonare, gli esercizi di rilassamento e la riduzione dello stress possono migliorare la qualità della vita dei pazienti. Nel corso della malattia, sovente è necessario l’apporto straordinario di ossigeno. Eventualmente, nei casi gravi, è necessario ricorrere al trapianto polmonare.
A che punto è la ricerca?
La ricerca è costantemente impegnata a decifrare i processi. Stiamo individuando sempre più tessere del complesso mosaico di questa malattia. Nel frattempo sono stati scoperti segnali e messaggeri chimici che conducono alla cicatrizzazione del polmone. In quest’ottica si cercano nuovi spunti per altre terapie. Sono inoltre in corso una moltitudine di studi che si spera portino a nuove conoscenze e possibilità terapeutiche. È auspicabile una terapia mono farmacologica o combinata che migliori la prospettiva di guarigione di questa malattia per ora ancora fatale.
Leggi anche:
- Si muore di fibrosi polmonare? Qual è l’aspettativa di vita?
- Malattie interstiziali polmonari: cause ed interstiziopatia polmonare da farmaci
- Malattie interstiziali polmonari: anatomia patologica e fisiopatologia
- Malattie interstiziali polmonari: sintomi, segni, diagnosi, esami
- Malattie interstiziali polmonari: terapia, prognosi, mortalità, speranza di vita
- Apparato respiratorio: anatomia in sintesi, struttura e funzioni
- Differenza tra laringe, faringe e trachea
- Spirometria diretta ed indiretta: come si esegue ed a cosa serve
- Pneumotorace spontaneo primario, secondario ed iperteso: cause, sintomi, terapie
- Sangue dal naso (epistassi) in bambini e adulti: cause, rimedi naturali, cosa fare e cosa NON fare
- A che serve l’osso ioide e dove si trova? Cos’è il pomo d’Adamo?
- Apnea ostruttiva del sonno: cause, rischi, trattamenti e prevenzione
- Perché si russa e quali sono i rimedi per smettere di russare? I pericoli dell’apnea ostruttiva del sonno
- Differenze tra respiro normale e patologico
- Respiro patologico: le alterazioni del ritmo respiratorio normale
- Respiro di Biot ed apnee: caratteristiche e cause patologiche e non patologiche
- Respiro di Cheyne-Stokes: caratteristiche e cause patologiche e non patologiche
- Respiro di Kussmaul: caratteristiche e cause
- Respiro di Falstaff: caratteristiche e cause
- Parametri della spirometria: capacità, volumi, rapporti e flussi
- Broncoscopia polmonare con biopsia: a cosa serve, fa male, è pericolosa?
- Asma bronchiale in bambini e adulti: cause, sintomi e cura
- Gabbia toracica: dove si trova, a che serve e da cosa è composta
- Differenza tra costola incrinata e rotta
- Frattura costale multipla, volet costale e pneumotorace
- Cos’è una costa? Differenza tra costole e coste
- Costola rotta (frattura costale): sintomi, diagnosi e terapia
- Costola incrinata: sintomi, terapia e tempi di recupero
- Differenza tra costole e vertebre
Lo Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram o su Pinterest, grazie!
Tumore maligno della prostata (carcinoma prostatico): cause, sintomi e terapie
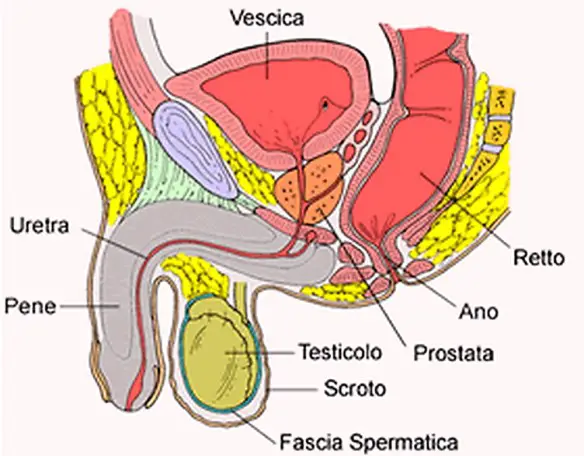 Per carcinoma della prostata si intende una categoria diagnostica che annovera le neoplasie maligne che si originano dalle cellule epiteliali della prostata, una ghiandola dell’apparato genitale maschile. Questa neoplasia può dare luogo a metastasi, con predilezione per le ossa e i linfonodi loco-regionali. Il tumore alla prostata può causare dolore, difficoltà alla minzione, disfunzione erettile e altri sintomi.
Per carcinoma della prostata si intende una categoria diagnostica che annovera le neoplasie maligne che si originano dalle cellule epiteliali della prostata, una ghiandola dell’apparato genitale maschile. Questa neoplasia può dare luogo a metastasi, con predilezione per le ossa e i linfonodi loco-regionali. Il tumore alla prostata può causare dolore, difficoltà alla minzione, disfunzione erettile e altri sintomi.
Eiaculazioni frequenti e cancro alla prostata
Uno studio del 2003 indica che eiaculazioni regolari possono avere un ruolo nella prevenzione del tumore della prostata. Altri studi, tuttavia: non rilevano un’associazione significativa tra i due fattori. Questi risultati hanno comunque contraddetto precedenti studi i quali suggerivano che aver avuto numerosi partner sessuali o comunque un’elevata attività sessuale incrementerebbe il rischio di carcinoma prostatico del 40%. Una differenza chiave può essere che questi precedenti studi definivano l’attività sessuale come il rapporto sessuale, mentre quelli più recenti si sono concentrati più sul numero di eiaculazioni avvenute con o senza rapporti sessuali. Un ulteriore studio risalente al 2004 riporta che: “La maggior parte delle categorie di persone con una elevata frequenza di eiaculazione si sono dimostrate non correlate al rischio di cancro alla prostata. Tuttavia, la frequenza di eiaculazione alta è correlata a diminuzione del rischio totale di cancro alla prostata”. L’abstract della relazione ha concluso che: “I nostri risultati suggeriscono che la frequenza di eiaculazione non è correlata a un aumento del rischio di cancro alla prostata”.
Leggi anche:
- PSA totale e free alto: capire i risultati dell’esame e rischio di tumore alla prostata
- Esplorazione rettale digitale della prostata: fa male? A che serve?
- Prostatite batterica ed abatterica: cause e cure dell’infiammazione della prostata
- Prostata: anatomia, dimensioni, posizione e funzioni in sintesi
- Peperoncino, sesso, testosterone e prostata: qual è il legame?
Cause
Le cause specifiche del cancro alla prostata rimangono ancora sconosciute. I primi fattori di rischio sono comunque l’età e la storia familiare. Il cancro alla prostata è molto raro negli uomini sotto i 45 anni, ma diventa più frequente all’aumentare dell’età. L’età media dei pazienti al momento della diagnosi è di 70 anni. Comunque molti uomini non vengono mai a conoscenza di avere questo tipo di tumore. Gli esami autoptici effettuati su uomini cinesi, tedeschi, israeliani, giamaicani, svedesi e ugandesi, morti per cause differenti, hanno evidenziato la presenza di un cancro alla prostata nel 30% dei casi sotto i 50 anni e nell’80% sopra i 70. Gli uomini che hanno un familiare di primo grado che ha avuto questo tipo di tumore, hanno il doppio del rischio di svilupparlo rispetto agli uomini che non hanno avuto malati in famiglia. Il rischio appare maggiore per gli uomini che hanno un fratello con questo cancro rispetto a quelli che hanno solo il padre.
Sintomi
Un carcinoma della prostata in fase precoce di solito non dà luogo a sintomi. Spesso viene diagnosticato in seguito al riscontro di un livello elevato di PSA durante un controllo di routine. Talvolta, tuttavia, il carcinoma causa dei problemi, spesso simili a quelli che intervengono nella ipertrofia prostatica benigna; essi includono pollachiuria, nicturia, difficoltà a iniziare la minzione e a mantenere un getto costante, ematuria, stranguria. Può anche causare problemi nella funzione sessuale, come difficoltà a raggiungere l’erezione, e eiaculazione dolorosa. In stadio avanzato può causare sintomi addizionali quando si diffonde ad altre parti del corpo. Il sintomo più comune è il dolore osseo, spesso localizzato alle vertebre, alla pelvi o alle costole, e causato da metastasi in queste sedi. La localizzazione vertebrale può indurre compressione al midollo spinale, causando debolezza alle gambe e incontinenza urinaria e fecale.
Screening
Lo screening oncologico è un metodo per scoprire tumori non diagnosticati. I test di screening possono indurre a ricorrere a esami più specifici, come la biopsia. Le scelte diagnostiche di screening nel caso del tumore della prostata comprendono l’esame rettale e il dosaggio del PSA. È controversa la validità degli esami di screening, poiché non è chiaro se i benefici che ne derivano sopravanzino i rischi degli esami diagnostici successivi e della terapia antitumorale. Il tumore della prostata è un tumore a crescita lenta, molto comune fra gli uomini anziani. Infatti in maggioranza i tumori della prostata non crescono abbastanza per dare luogo a sintomi, e i pazienti muoiono per cause diverse. Il dosaggio del PSA può svelare questi piccoli tumori che non avrebbero altrimenti avuto modo di manifestarsi; uno screening del genere può quindi condurre a un numero eccessivo di diagnosi, con la relativa sequela di test ulteriori e di terapie. La biopsia può causare dolore, sanguinamento e infezioni; le terapie possono causare incontinenza urinaria e disfunzioni erettili. Dunque è essenziale che vengano considerati i rischi e i benefici prima di intraprendere uno screening utilizzando il dosaggio del PSA. In genere gli screening iniziano dopo i 50 anni di età, ma possono essere proposti prima negli uomini di colore e in quelli con una forte storia familiare di tumori alla prostata
Esame rettale
L’esame rettale digitale è una procedura in cui l’esaminatore inserisce un dito guantato e lubrificato nel retto del paziente, allo scopo di valutare le dimensioni, la forma e la consistenza della prostata: zone irregolari, dure o bozzolute devono essere sottoposte a ulteriori valutazioni, perché potrebbero essere indicative di tumore. L’esame rettale è in grado di valutare solo la parte posteriore della prostata, ma fortunatamente l’85% dei tumori ha origine proprio in questa parte. In genere dà modo di apprezzare tumori già in stadio avanzato. Non è mai stato dimostrato che, come unico test di screening, l’esame rettale sia in grado di ridurre il tasso di mortalità.
Leggi anche:
- Visita andrologica completa di pene e testicoli [VIDEO]
- Esplorazione rettale digitale della prostata [VIDEO]
- Ecografia prostatica transrettale: come si svolge, è dolorosa, a che serve?
- Mi alzo spesso di notte per urinare: quali sono le cause e le cure?
- Ipertrofia o iperplasia prostatica benigna: cause, sintomi e cure
- Prostata ingrossata ed infiammata: ecco cosa fare per mantenerla in salute
- Uroflussometria: indicazioni, preparazione, come si esegue
Dosaggio del PSA
Il dosaggio del PSA misura il livello ematico di un enzima prodotto dalla prostata. Livelli di PSA sotto 4 ng/mL (nanogrammi per millilitro) sono generalmente considerati normali, mentre livelli sopra i 4 ng/mL sono considerati anormali (sebbene negli uomini oltre i 65 anni livelli fino a 6,5 ng/mL possono essere accettabili, in dipendenza dai parametri di riferimento di ciascun laboratorio). Livelli di PSA tra 4 e 10 ng/mL indicano un rischio di tumore più alto del normale, ma il rischio stesso non sembra direttamente proporzionale al livello. Quando il PSA è sopra i 10 ng/mL, l’associazione col tumore diventa più forte, tuttavia quello del PSA non è un test perfetto.
La valutazione del PSA può essere effettuata anche a casa, usando un test pratico ed affidabile come quello consigliato dal nostro Staff medico: http://amzn.to/2nV1m4h
Alcuni uomini con tumore prostatico in atto non hanno livelli elevati di PSA, e la maggioranza di uomini con un elevato PSA non ha un tumore. Oggi è possibile dosare un ulteriore marcatore per il carcinoma prostatico, il PCA3 (prostate cancer gene 3); l’iperespressione di questo gene (valutabile mediante dosaggio del mRNA nelle urine) è strettamente associata alla trasformazione maligna delle cellule della prostata. Il dosaggio è quindi particolarmente utile nei pazienti già sottoposti a biopsia, per predire l’evoluzione del tumore. Per approfondire leggi anche: PSA totale e free alto: capire i risultati dell’esame e rischio di tumore alla prostata
Cistoscopia e biopsia
Quando si sospetta un carcinoma prostatico, o un esame di screening è indicativo di un rischio aumentato, si prospetta una valutazione più invasiva. L’unico esame in grado di confermare pienamente la diagnosi è la biopsia, ossia l’asportazione di piccoli frammenti di tessuto per l’esame al microscopio. Tuttavia, prima che alla biopsia, si può ricorrere a metodiche meno invasive per raccogliere informazioni riguardo alla prostata e al tratto urinario: la cistoscopia mostra il tratto urinario a partire dall’interno della vescica usando un piccolo endoscopio inserito nell’uretra; l’ecografia transrettale disegna un’immagine della prostata tramite gli ultrasuoni emessi da una sonda inserita nel retto. Se si sospetta un tumore si ricorre alla biopsia. Con essa si ottengono campioni di tessuto dalla prostata tramite il retto: una pistola da biopsia inserisce e quindi rimuove speciali aghi a punta cava (di solito da tre a sei per ogni lato della prostata) in meno di un secondo. I campioni di tessuto vengono quindi esaminati al microscopio per determinare la presenza di tumore, valutarne gli aspetti istomorfologici (grading secondo il Gleason score system). In genere le biopsie prostatiche vengono eseguite ambulatorialmente e di rado richiedono l’ospedalizzazione. Il 55% degli uomini riferisce malessere durante la procedura. Uno studio portato a termine nel 2003 dall’Istituto scientifico universitario San Raffaele ha dimostrato l’efficacia dell’utilizzo della tomografia a emissione di positroni (PET) con il tracciante C-Colina, come esame per individuare recidive del tumore alla prostata. Questo esame è consigliato nei pazienti che hanno già subito un trattamento radicale del tumore e a cui si è rilevato un valore del marcatore PSA tale da far pensare a una ripresa della malattia. Grazie alla PET è possibile, inoltre, differenziare una diagnosi di cancro alla prostata da una iperplasia benigna, da una prostatite cronica e da un tessuto prostatico sano.
Stadiazione
Una parte importante della valutazione diagnostica è la stadiazione, ossia il determinare le strutture e gli organi interessati dal tumore. Determinare lo stadio aiuta a definire la prognosi e a selezionare le terapie. Il sistema più comune è il sistema a quattro stadi TNM (abbreviazione da Tumore/LinfoNodi/Metastasi), che prevede di considerare le dimensioni del tumore, il numero di linfonodi coinvolti e la presenza di metastasi.
La distinzione più importante operata da qualsiasi sistema di stadiazione è se il tumore è o meno confinato alla prostata. Diversi esami sono disponibili per evidenziare una valutazione in questo senso, e includono la TAC per valutare la diffusione nella pelvi, la scintigrafia per le ossa, e la risonanza magnetica per valutare la capsula prostatica e le vescicole seminali.
I risultati possono poi essere classificati grazie alla stadiazione TNM o di Whitmore-Jewett:
| Stadio | Descrizione |
|---|---|
| T1a | tumore in meno del 5% del parenchima (corrisponde allo stadio A1 di WJ). |
| T1b | tumore in più del 5% del parenchima. |
| T1c | come 1b + PSA elevato (questi 2 stadi corrispondono allo stadio A2 di WJ) |
| T2a | coinvolge 1 lobo (comprende gli stadi B1 e B2 di WJ) |
| T2b | coinvolge entrambi i lobi (stadio B3 di WJ) |
| T3a | oltrepassa la capsula prostatica da un solo lobo (stadio C1 di WJ) |
| T3b | oltrepassa la capsula da entrambi i lobi |
| T3c | invade le vescichette seminali (stadio C2 di WJ) |
| T4 | invade organi adiacenti (stadio D di WJ, diviso in ormono-sensibile e insensibile) |
| N1a | metastasi linfonodali non rilevabili |
| N1b | una sola minore o uguale a 2 cm |
| N1c | una sola fra 2 e 5 cm |
| N2a | oltre 5 cm o multiple |
| MX | metastasi a distanza non rilevabili |
| M0 | assenza di metastasi a distanza |
| M1a | linfonodi extraregionali |
| M1b | scheletro |
| M1c | altri siti |
Dopo una biopsia prostatica, un patologo esamina il campione al microscopio. Se è presente un tumore il patologo ne indica il grado; questo indica quanto il tessuto tumorale differisce dal normale tessuto prostatico, e suggerisce quanto velocemente il tumore stia crescendo. Il grado di Gleason assegna un punteggio da 2 a 10, dove 10 indica le anormalità più marcate; il patologo assegna un numero da 1 a 5 alle formazioni maggiormente rappresentate, poi fa lo stesso con le formazioni immediatamente meno comuni; la somma dei due numeri costituisce il punteggio finale. Il tumore è definito ben differenziato se il punteggio è fino 4, mediamente differenziato se 5 o 6, scarsamento differenziato se maggiore di 6.
| Grado | Descrizione |
|---|---|
| Grado 1: | altamente differenziato |
| Grado 2: | ben differenziato: |
| Grado 3: | moderatamente differenziato |
| Grado 4: | scarsamente differenziato |
| Grado 5: | altamente indifferenziato (cellule infiltranti) |
Un’appropriata definizione del grado di malignità del tumore è di importanza fondamentale, in quanto uno dei fattori utilizzati per guidare le scelte terapeutiche.
Terapia
La terapia del carcinoma prostatico può comprendere: l’osservazione in assenza di trattamento, la chirurgia, la radioterapia, gli ultrasuoni focalizzati ad alta intensità HIFU, la chemioterapia, la criochirurgia, la terapia ormonale, o una combinazione di queste. La scelta dell’opzione migliore dipende dallo stadio della malattia, dal punteggio secondo la scala Gleason, e dai livelli di PSA. Altri fattori importanti sono l’età del paziente, il suo stato generale, e il suo pensiero riguardo alla terapia proposta e agli eventuali effetti collaterali. Poiché tutte le terapie possono indurre significativi effetti collaterali, come le disfunzione erettile e l’incontinenza urinaria, discutere col paziente circa la possibile terapia spesso aiuta a bilanciare gli obiettivi terapeutici coi rischi di alterazione dello stile di vita.
Se il tumore si è diffuso esternamente alla prostata, le opzioni terapeutiche cambiano. La terapia ormonale e la chemioterapia sono spesso riservate ai casi in cui la malattia si è estesa esternamente alla prostata; tuttavia esistono delle eccezioni: la radioterapia può essere impiegata per alcuni tumori in fase avanzata, e la terapia ormonale per alcuni in fase precoce. La crioterapia, la terapia ormonale e la chemioterapia possono inoltre essere utilizzate se il trattamento iniziale fallisce e il tumore progredisce.
Integratori alimentari efficaci nel migliorare il benessere della prostata
Qui di seguito trovate una lista di integratori alimentari acquistabili senza ricetta, potenzialmente in grado di diminuire infiammazioni e bruciori e migliorare la salute della prostata. Ogni prodotto viene periodicamente aggiornato ed è caratterizzato dal miglior rapporto qualità prezzo e dalla maggior efficacia possibile, oltre ad essere stato selezionato e testato ripetutamente dal nostro Staff di esperti:
- Serenoa Repens: http://amzn.to/2ykWFRs
- Saw Palmetto: http://amzn.to/2AxY7FT
- Arginina: http://amzn.to/2yc70Pv
- Citrullina: http://amzn.to/2ybVQtR
- Ortica a foglie: http://amzn.to/2iYLcBu
- Equilibra Top Prostata: http://amzn.to/2j0qNfJ
- Carnitina: http://amzn.to/2islmFV
- Zinco: http://amzn.to/2iupUvz
- Taurina: http://amzn.to/2AU6lrp
- Vitamine e sali minerali: http://amzn.to/2iXrBW4
- Acido folico: http://amzn.to/2ycaCRA
Osservazione
L’osservazione, una “sorveglianza attiva”, prevede il regolare monitoraggio della malattia in assenza di un trattamento invasivo. Spesso vi si ricorre quando si riscontra, in pazienti anziani, un tumore in stadio precoce e a crescita lenta. Può essere consigliabile anche quando i rischi connessi alla chirurgia, alla radioterapia, o alla terapia ormonale sopravanzino i possibili benefici. Si possono intraprendere gli altri trattamenti se si manifestano sintomi, o se appaiono indizi di un’accelerazione nella crescita del tumore. La maggioranza degli uomini che optano per l’osservazione di tumori in stadi precoci vanno incontro alla possibilità di manifestare segni di progressione del tumore, ed entro tre anni hanno necessità di intraprendere una terapia. Sebbene tale scelta eviti i rischi connessi alla chirurgia e alle radiazioni, il rischio di metastasi si può innalzare. I problemi di salute connessi all’avanzare dell’età durante il periodo di osservazione possono anch’essi complicare la chirurgia e la radioterapia.
Chirurgia
La rimozione chirurgica della prostata, o prostatectomia, è un trattamento comune sia per i tumori prostatici in stadi precoci, sia per i tumori non rispondenti alla radioterapia. Il tipo più comune è la prostatectomia retropubica radicale, in cui si rimuove la prostata tramite un’incisione addominale. Un altro tipo è la prostatectomia perineale radicale, in cui l’incisione è praticata a livello del perineo, la regione fra lo scroto e l’ano. La prostatectomia può risolvere, a cinque anni, circa il 70% dei casi di tumore della prostata; tassi di sopravvivenza più alti si sono trovati con un Gleason score inferiore a 3.
La prostatectomia radicale è stata tradizionalmente usata come unico trattamento per un tumore di piccole dimensioni. Tuttavia cicli di terapia ormonale prima della chirurgia possono migliorare le percentuali di successo, e sono correntemente oggetto di studio. La chirurgia può essere intrapresa anche quando il tumore non risponde alla radioterapia, tuttavia, poiché le radiazioni causano modifiche dei tessuti, in questa situazione aumentano i rischi di complicazioni.
Da uno studio comparativo condotto nel 2009 su un totale di 8.837 interventi di chirurgia radicali per tumore alla prostata, l’incidenza dell’incontinenza urinaria e impotenza, ha evidenziato che:
- Chirurgia con robot/laparoscopia:
- 15,9% di incontinenza urinaria
- 26,8% di impotenza e disfunzioni erettili.
- Chirurgia classica-tradizionale a “cielo aperto”:
- 12,2% di incontinenza urinaria
- 19,2% di impotenza e disfunzioni erettili.
La resezione transuretrale della prostata è una procedura chirurgica messa in atto quando l’uretra è ostruita a causa dell’ingrossamento prostatico; generalmente è riservata alle malattie prostatiche benigne e non è intesa come trattamento definitivo del tumore. Consiste nell’inserimento nell’uretra di un piccolo endoscopio, tramite il quale, con apposito strumento, si taglia via la parte di prostata che occlude il lume.
Prostatectomia radicale, nervi e disfunzione erettile
La prostatectomia radicale è molto efficace per i tumori limitati alla prostata, tuttavia può causare danni ai nervi in grado di alterare significativamente la qualità della vita dei pazienti. I nervi deputati all’erezione e alla minzione sono immediatamente adiacenti con la prostata, per cui le complicazioni più importanti sono l’incontinenza urinaria e l’impotenza. Circa il 40% degli uomini residuano incontinenza urinaria, di solito sotto forma di perdite quando starnutiscono, tossiscono o ridono. L’impotenza è anch’essa un problema comune: sebbene la sensibilità sul pene e la capacità di raggiungere l’orgasmo rimangano intatte, l’erezione e l’eiaculazione sono spesso compromesse; farmaci come il sildenafil (Viagra), il tadalafil (Cialis), o il vardenafil (Levitra) possono ristabilire un certo grado di potenza. In alcuni uomini con tumori più piccoli, una tecnica chirurgica meno invasiva può essere d’aiuto per evitare queste complicazioni.
Leggi anche:
- Erezione debole o assente da cause psicologiche: cura e rimedi
- Anorgasmia: quando manca l’orgasmo, cause e rimedi
- Micropene: quanto misura, complicazioni, c’è una cura?
- Eiaculazione retrograda: quando lo sperma non esce o è troppo poco
- Fino a che età un uomo può avere figli?
- Testicoli piccoli: quali sono le cause e le dimensioni normali?
- Testicolo gonfio e dolorante: cause, diagnosi e terapie
Cure palliative
Una cura palliativa per i tumori prostatici in fase avanzata è rivolta al migliorare la qualità della vita attenuando i sintomi delle metastasi. La chemioterapia può utilizzarsi per ridurre la progressione della malattia e procrastinarne i sintomi. Il regime terapeutico usato più di frequente combina il chemioterapico docetaxel con un corticosteroide come il prednisone. I bifosfonati come l’acido zoledronico si sono dimostrati in grado di posticipare le complicazioni a carico dello scheletro come le fratture inoltre inibiscono direttamente la crescita delle cellule neoplastiche. L’utilizzo della radioterapia in pazienti con metastasi di carcinoma prostatico refrattarie alla terapia ormonale. Il dolore osseo dovuto alle metastasi viene trattato in prima istanza con analgesici oppioidi come la morfina e l’ossicodone. La radioterapia a fascio esterno diretta sulle metastasi ossee assicura una diminuzione del dolore ed è indicata in caso di lesioni isolate, mentre la terapia radiometabolica è impiegabile nella palliazione della malattia ossea secondaria più diffusa.
Prognosi
Nelle società occidentali i tassi di tumori della prostata sono più elevati, e le prognosi più sfavorevoli che nel resto del mondo. Molti dei fattori di rischio sono maggiormente presenti in Occidente, tra cui la maggior durata di vita e il consumo di grassi animali. Inoltre, dove sono più accessibili i programmi di screening, v’è un maggior tasso di diagnosi. Il tumore della prostata è il nono più frequente tumore nel mondo, e il primo, a parte i tumori cutanei, negli Stati Uniti per quanto riguarda gli uomini, dove nel 2005 ha colpito il 18% degli uomini, e causa di morte per il 3%. In Giappone, il tasso di morte per tumore della prostata era da un quinto alla metà rispetto agli Stati Uniti e all’Europa negli anni novanta; in India nello stesso periodo metà delle persone con tumore della prostata non invasivo morivano entro dieci anni. Gli afroamericani contraggono il tumore e ne muoiono 50-60 volte più frequentemente rispetto agli uomini di Shanghai, Cina. In Nigeria il 2% degli uomini sviluppano tumore prostatico e il 64% di essi muoiono entro due anni. Nei pazienti sottoposti a trattamento gli indicatori prognostici più importanti sono lo stadio di malattia, i livelli pre-terapia di PSA e l’indice di Gleason. In generale maggiore il grado e lo stadio peggiore è la prognosi. Si può ricorrere ad algoritmi per calcolare il rischio stimato in un determinato paziente. Le predizioni sono basate sull’esperienza su ampi gruppi di pazienti affetti da tumori in vari stadi.
Leggi anche:
- Due eiaculazioni consecutive sono possibili? Come funziona una eiaculazione?
- Prostata: ogni quanto tempo fare il controllo del PSA?
- Come aumentare il testosterone per migliorare muscoli e rapporti sessuali
- Cos’è il perineo maschile e femminile, dove si trova ed a cosa serve? Perché è così importante per la donna, specie in gravidanza?
- Vescica: dove si trova, anatomia, funzioni e patologie frequenti in sintesi
- Urodinamica: cos’è, a che serve e come funziona
- Finasteride per ipertrofia prostatica ed alopecia androgenetica
- Finasteride e disfunzione erettile: la Sindrome post finasteride
- Propecia (Finasteride): collaterali e foglietto illustrativo
- Minzione: come funziona l’emissione di urina e come si controlla
- Uretra maschile e femminile: anatomia, funzioni e patologie in sintesi
- Uretere: dove si trova, anatomia, funzioni e patologie in sintesi
- Testicoli e scroto: dimensioni, anatomia e funzioni in sintesi Punto G maschile: trovare e stimolare il punto L per provare orgasmi più intensi ed aumentare la forza dell’eiaculazione
- Quanto deve durare un rapporto sessuale prima che si parli di eiaculazione precoce?
- Masturbazione compulsiva e dipendenza dalla pornografia online causano impotenza anche nei giovani: colpa dell’effetto Coolidge
- Cosa accade e cosa si prova quando si frattura il pene?
- Priapismo: quando l’erezione dura più di quattro ore
- Presenza di sangue nello sperma: cause e terapie dell’ematospermia
- Cancro del testicolo: prevenzione, diagnosi, stadiazione, cure
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Testicolo gonfio e dolorante: cause, diagnosi e terapie
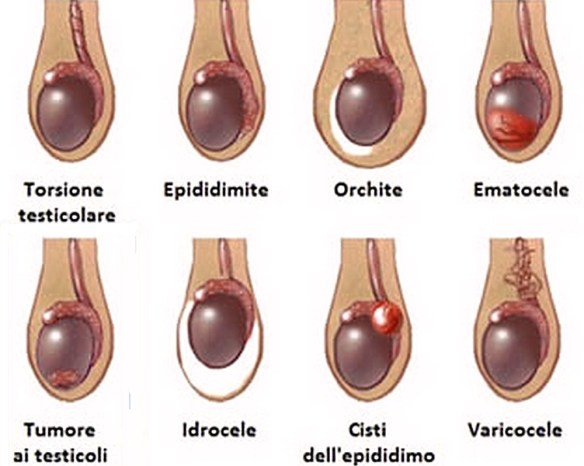 La presenza di un testicolo gonfio, o di entrambi, è una condizione che può facilmente indurre il soggetto ad attraversare uno stato di forte preoccupazione e di paura, nel sospetto che si tratti di una patologia grave. È molto comune ricondurre il gonfiore di un testicolo al segno di un tumore, ma in realtà, è bene premettere fin da subito che un tumore ai testicoli in genere si manifesta con la presenza di un nodulo facilmente identificabile mediante palpazione dello scroto e dei testicoli, e che si nota per una consistenza molto più dura rispetto ai tessuti circostanti. È anche bene ribadire che il tumore ai testicoli non è certo una patologia diffusa quanto temuta, e che se trattata in tempo ha probabilità molto alte di guarigione. Notare un testicolo gonfio, dolorante e duro può comportare delle forti ripercussioni psicologiche, temendo per la propria capacità riproduttiva, per la propria virilità e per la propria vita sessuale. Ma se per un lato la presenza di un gonfiore ai testicoli procura un forte senso di ansia, dall’altro spesso il soggetto temporeggia per senso di imbarazzo.
La presenza di un testicolo gonfio, o di entrambi, è una condizione che può facilmente indurre il soggetto ad attraversare uno stato di forte preoccupazione e di paura, nel sospetto che si tratti di una patologia grave. È molto comune ricondurre il gonfiore di un testicolo al segno di un tumore, ma in realtà, è bene premettere fin da subito che un tumore ai testicoli in genere si manifesta con la presenza di un nodulo facilmente identificabile mediante palpazione dello scroto e dei testicoli, e che si nota per una consistenza molto più dura rispetto ai tessuti circostanti. È anche bene ribadire che il tumore ai testicoli non è certo una patologia diffusa quanto temuta, e che se trattata in tempo ha probabilità molto alte di guarigione. Notare un testicolo gonfio, dolorante e duro può comportare delle forti ripercussioni psicologiche, temendo per la propria capacità riproduttiva, per la propria virilità e per la propria vita sessuale. Ma se per un lato la presenza di un gonfiore ai testicoli procura un forte senso di ansia, dall’altro spesso il soggetto temporeggia per senso di imbarazzo.
Il gonfiore testicolare può associarsi a molteplici altri sintomi, in relazione all’evento patologico alla base della manifestazione, quali:
- febbre;
- dolore ai testicoli e allo scroto;
- ematuria (presenza di sangue nelle urine);
- emospermia (sangue nello sperma);
- vasi sanguigni dilatati ben visibili attraverso la cute dello scroto.
Inolte, al tatto il testicolo può essere duro e rigido e portare alla manifestazione di disuria (difficoltà nell’atto della minzione) e stranguria (dolore nell’atto di urinare). In ogni caso, sia che il sintomo si manifesti da solo, ai testicoli ed allo scroto, che accompagnato da altri sintomi, si raccomanda di informare il proprio medico con la massima celerità, il quale, valutata la situazione, vi indirizzerà verso una visita specialistica più approfondita, in genere presso un medico specialista in andrologia. In molti casi la causa alla base del sintomo in questione può essere risolta del tutto, preservando la capacità riproduttiva e quindi la fertilità del soggetto, ma in altri casi un intervento tardivo può compromettere in maniera irreversibile sia la fertilità che la salute generale del soggetto. Come lasciato intuire le cause di testicolo gonfio sia destro che sinistro sono molteplici, alcune di facile risoluzione, mentre per altre vi è la necessità di trattamenti più mirati.
Ernia inguinale
Per buona parte della vita fetale i testicoli sono accolti nella cavità addominale, per poi, in genere nel corso del 7° mese di gestazione, discendere nello scroto attraversando una struttura anatomica complessa che prende il nome di canale inguinale. Non è raro, specie nei bambini nati prematuri, o molto più facilmente a seguito di un eccessivo sforzo fisico, che alcune strutture dell’addome attraversino proprio questo canale andando a localizzarsi all’interno dei testicoli causando gonfiore e dolore, anche se quest’ultimo non è sempre avvertito dal paziente. Alla palpazione si nota facilmente la presenza di un’asimmetria e di una massa che ha una consistenza diversa rispetto al tessuto circostante.
Idrocele
Si verifica nei soggetti in cui non vi è stata la corretta chiusura del canale inguinale a seguito del passaggio dei testicoli dall’addome allo scroto. Questa mancata chiusura consente il transito di liquidi provenienti dall’addome che di norma vengono riassorbiti dai tessuti, ma che in alcuni soggetti, specie nei bambini, quando il liquido è presente in quantità, determina la comparsa di testicolo gonfio e dolorante destro o sinistro. Negli adulti questa condizione si instaura a seguito di un traumatismo, di un’ infezione o di un tumore.
Varicocele
Si tratta di un’ectasia venosa, ossia una dilatazione delle vene che costituiscono il cosiddetto plesso pampiniforme. Questo evento si manifesta con molta più frequenza nel testicolo sinistro rispetto al destro, a causa delle caratteristiche anatomiche dei vasi sanguigni. In condizioni di varicocele il flusso di sangue è rallentato, il suo riversamento nella vena renale risulta più lento e si ha il ristagno di sangue all’interno delle vene del testicolo, che appariranno congestionate e dilatate. Caratteristica ben osservabile anche attraverso la cute dello scroto. Il ristagno di sangue va a causare un aumento della temperatura del testicolo, e quando questa supera la soglia di tollerabilità degli spermatozoi, il paziente corre il rischio di subire serie ripercussioni sulla sua capacità fertile.
Epididimite
L’epididimo è una piccola struttura situata posteriormente al testicolo e che rappresenta il tratto di congiunzione tra il didimo (testicolo) e le vie spermatiche, consentendo allo sperma di fluire verso il dotto deferente. Questa struttura è facilmente soggetta ad infiammazione che può essere provocata sia da traumi che da infezioni che colpiscono le vie genito-urinarie, e ancora da infezioni sessualmente trasmissibili (gonorrea e clamidia). Il gonfiore al testicolo, se la causa è di natura infettiva, si associa facilmente a febbre, dolore, brividi e linfonodi ingrossati.
Orchite
L’orchite è un’infiammazione dei testicoli, analogamente per quanto accade nell’epididimite può essere sia di natura traumatica che di natura infettiva, pertanto al gonfiore testicolare si associano febbre, brividi, ematuria, emospermia (presenza di sangue nello sperma), l’intera zona pelvica può essere dolorante ed in genere si riscontrano linfonodi ingrossati. Si tratta di una condizione più frequente negli uomini adulti, specie dalla quinta decade di vita in avanti.
Torsione del testicolo
Si tratta di una vera e propria emergenza medico-chirurgica, per cui si deve intervenire entro 4-6 dall’episodio di torsione, altrimenti il testicolo viene perso per la mancanza di flusso sanguigno a nutrire il normale metabolismo dei tessuti. Questa evenienza si manifesta con più frequenza a seguito di sforzi fisici di grande entità, a seguito di forti emozioni, di traumi o di rapporti sessuali intensi, e consiste nell’attorcigliamento del legamento gubernaculum che permette la fissità del testicolo all’interno della borsa scrotale. Come anticipato, la torsione del testicolo va a comprimere la rete vascolare, causando una progressiva sofferenza che procede fino alla necrosi e quindi alla perdita del testicolo. La torsione del testicolo porta al gonfiore del testicolo e dello scroto, dovuto alla congestione sanguigna, ma si caratterizza sicuramente ben più per una sensazione dolorosa molto intensa e che porta il soggetto a rivolgersi al pronto soccorso con celerità.
Come si effettua la diagnosi?
Ribadiamo ancora una volta la necessità di rivolgersi al consulto medico in ogni caso, sia quando il testicolo si presenta gonfio senza altri sintomi, che ovviamente quando al gonfiore si associano altri sintomi. Quando, invece, il gonfiore è improvviso ed è accompagnato da un dolore molto intenso si invita a rivolgersi alle cure immediate in un pronto soccorso, perché potrebbe trattarsi di una torsione del testicolo. Condizione che come abbiamo visto in precedenza, costituisce una vera e propria emergenza e che necessita di un intervento immediato. Una visita medica in genere è costituita da una fase di raccolta di informazioni (anamnesi), momento in cui il medico chiede quando è insorto il sintomo, da quanto persiste, se è accompagnato da altri sintomi e se il soggetto aveva manifestato episodi precedenti. A questa fase segue l’esame obiettivo, ossia il momento in cui il medico verifica visivamente e manualmente l’entità del problema, quindi osserva se vi è la presenza di vasi sanguigni ben visibili attraverso la cute dello scroto (indice di varicocele), se il testicolo interessato ha una colorazione differente da quello sano, se alla palpazione sono distinguibili masse, noduli o ernie. Sulla base delle informazioni raccolte il medico valuterà quali indagini diagnostiche effettuare per indagare più a fondo sulla base di precisi sospetti diagnostici. Risulteranno utili l’esame del sangue o delle urine, al fine di individuare la presenza di un’infezione, o un’ecografia per verificare la presenza di un’ernia o di una raccolta di liquidi nello scroto.
Quali sono le terapie più efficaci?
La terapia più efficace ed idonea sarà in funzione della patologia alla base del rigonfiamento del testicolo, pertanto dovrà essere prescritta e somministrata esclusivamente da un medico dopo aver preso visione di tutte le indagini effettuate e dopo essere giunto ad una diagnosi precisa. In caso di infezione, la terapia andrà ad eradicare l’agente patogeno scatenante mediante antivirali, in caso di virus, o di antibiotici in caso di batteri. Se la causa è di natura strettamente infiammatoria la terapia potrà essere di natura farmacologica con l’assunzione di antinfiammatori. In caso di varicocele, invece, talvolta si rende necessario un intervento chirurgico che vada a correggere le alterazioni venose, salvaguardando la fertilità del paziente.
Integratori alimentari efficaci nel migliorare quantità di sperma, potenza dell’erezione e libido sia maschile che femminile
Qui di seguito trovate una lista di integratori alimentari acquistabili senza ricetta, potenzialmente in grado di migliorare la prestazione sessuale sia maschile che femminile a qualsiasi età e trarre maggiore soddisfazione dal rapporto, aumentando la quantità di sperma disponibile, potenziando l’erezione e procurando un aumento di libido sia nell’uomo che nella donna. Ogni prodotto viene periodicamente aggiornato ed è caratterizzato dal miglior rapporto qualità prezzo e dalla maggior efficacia possibile, oltre ad essere stato selezionato e testato ripetutamente dal nostro Staff di esperti:
- Estratto di radice di Maca peruviana: http://amzn.to/2AVOn7P
- Integratore completo per aumentare il testosterone: https://amzn.to/2GGi1BK
- Ossido Nitrico: http://amzn.to/2iXspKA
- Arginina: http://amzn.to/2yc70Pv
- Citrullina: http://amzn.to/2ybVQtR
- ZMA (Zinco/Magnesio/Vitamina B6): http://amzn.to/2BgYpRg
- Ginkgo Biloba: http://amzn.to/2j0EdvE
- Ginseng coreano: http://amzn.to/2iZiZP1
- Guaranà: http://amzn.to/2AXfXl9
- Zinco: http://amzn.to/2iupUvz
- Integratore completo di arginina, zinco e vitamine: https://amzn.to/2HppPoE
- Tribulus Terrestris: http://amzn.to/2nu4kt9
- Muira Puama: http://amzn.to/2jZ8cAM
- Fieno greco: http://amzn.to/2AVrdhJ
- Cordyceps Sinensis: http://amzn.to/2B6TTVK
- Carnitina: http://amzn.to/2islmFV
- Taurina: http://amzn.to/2AU6lrp
- Vitamine e sali minerali: http://amzn.to/2iXrBW4
- Acido folico: http://amzn.to/2ycaCRA
- Ossido Nitrico: http://amzn.to/2iXspKA
- Allicina: http://amzn.to/2ATNLzJ
- Saw Palmetto: http://amzn.to/2AxY7FT
- Calcio, vitamina D3 e vitamina K : http://amzn.to/2BDGeBE
- Omega 3: http://amzn.to/2AdJXtx
Per approfondire, leggi:
- Come avere un’eiaculazione più abbondante e migliorare sapore, odore, colore e densità dello sperma?
- Come avere la più potente erezione della tua vita senza farmaci
Leggi anche:
- Perché la pelle del pene è più scura rispetto al resto del corpo?
- Poliorchidismo: l’uomo nato con tre testicoli [FOTO]
- Testicoli e scroto: dimensioni, anatomia e funzioni in sintesi
- L’autopalpazione del testicolo ti salva dal cancro testicolare
- Torsione del testicolo: sintomi, cure, conseguenze, neonati. E’ doloroso?
- Com’è fatto il pene al suo interno?
- Scroto: dimensioni, anatomia e funzioni in sintesi
- Micropene: quanto misura, complicazioni, c’è una cura?
- Testicolo ritenuto (criptorchidismo): terapia e complicazioni
- Ipospadia nel bambino e nell’adulto: sintomi, diagnosi e cure
- Ipospadia nel bambino e nell’adulto: terapia chirurgica e post-operatorio
- Impianto di protesi testicolare: quando, come e perché si effettua
- Cancro del testicolo: prevenzione, diagnosi, stadiazione, cure
- Composizione, caratteristiche e produzione dello sperma
- Prurito a scroto, testicoli e ano: cause e rimedi naturali
- Differenza tra sperma, liquido seminale, plasma seminale e spermatozoi
- Differenza tra oligospermia e azoospermia
- Differenza tra eiaculazione precoce e ritardata
- Differenza tra idrocele e varicocele
- Differenza tra testicolo destro e sinistro
- Differenza tra testicolo e scroto
- Differenza tra spermatozoo e cellula uovo
- Posso mettere incinta una donna dopo una vasectomia?
- Dopo una vasectomia si eiacula ancora?
- Vasectomia: dopo quanto avere rapporti e rischio di gravidanza
- La vasectomia è reversibile?
- La vasectomia protegge da HIV ed altre malattie sessualmente trasmissibili?
- Perché il glande ha un colore diverso rispetto al resto del pene?
- Quali sono le forme di pene più comuni ed in cosa sono facilitate nel rapporto?
- Quali sono le paure sessuali più diffuse tra le donne?
- Quali sono le paure sessuali più diffuse tra gli uomini?
- Impianto di protesi testicolare: quando, come e perché si effettua
- Testicoli piccoli: quali sono le cause e le dimensioni normali?
- Differenza tra ovaio microcistico, policistico e cisti ovariche
- Differenza tra ovaio policistico, micropolicistico e microfollicolare
- Differenza tra ovaio policistico e multifollicolare
- Ovaio: anatomia, funzioni e patologie in sintesi
- Vagina: anatomia, funzioni e patologie in sintesi
- Differenza tra vagina e vulva
- Utero: anatomia, funzioni, patologie e sintomi in sintesi
- Apparato genitale femminile: anatomia, funzioni e patologie in sintesi
- La vagina è uguale in tutte le donne?
- Quanto è profonda una vagina?
- Come capire se una donna ha avuto davvero un orgasmo? Ecco i segnali del piacere femminile
- Non ho mai raggiunto l’orgasmo: è un problema? Quali soluzioni?
- Il sesso è davvero importante in una coppia?
- Amore senza sesso o sesso senza amore?
- Come distinguere un vero orgasmo femminile da uno “finto”
- L’orgasmo femminile è tutta questione di ritmo
- Lui ha il pene piccolo? I 6 trucchi per raggiungere lo stesso l’orgasmo
- Le 6 cose che gli uomini con il pene piccolo vogliono che la donna sappia
- Micropene: intervista a due uomini che hanno il pene piccolo
- Le donne rivelano le 16 piccole cose che rendono un uomo irresistibile
- Orgasmo femminile: dieci consigli per raggiungerlo più facilmente
- Differenza tra orgasmo maschile e femminile
- L’orgasmo e le altre fasi del ciclo di risposta sessuale
- Orgasmo maschile e femminile: nuovo studio sulle differenze fisiologiche
- Qual è la lunghezza media del pene?
- Come raggiungere un orgasmo femminile lungo ed intenso
- Orgasmo femminile: una donna su 5 non lo ha mai provato in vita sua
- Dare un nome al proprio pene ed altre cose che fanno gli uomini di nascosto
- Come avere un orgasmo vaginale
- Orgasmo femminile: le posizioni migliori per raggiungerlo
- Sintomi di eccitazione sessuale femminile e maschile
- Cos’è il liquido emesso da una donna durante l’orgasmo?
Lo Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenze tra linfoma di Hodgkin e non Hodgkin: qual è il più grave?

Per linfoma si intende un gruppo di tumori sia benigni che maligni del tessuto linfoide (tessuto connettivo di timo, milza e linfonodi, caratterizzato dall’essere composto in gran parte da varie cellule sostenute da una fitta rete connettivale, cioè linfociti T e B, NK e loro precursori). Vi sono dozzine di sottotipi di linfoma, tra cui i più diffusi sono il linfoma di Hodgkin (HL), il linfoma non-Hodgkin (NHL), il mieloma multiplo ed i disordini immunoproliferativi. Relativamente all’argomento dell’articolo, un linfoma non Hodgkin si differenzia dal linfoma di Hodgkin per svariati motivi, epidemiologici, eziologici, relativi alla prognosi e istologici.
Epidemiologia
La prima distinzione è la frequenza: i linfomi non Hodgkin sono molto più frequenti, andando a costituire circa il 90% dei casi di linfoma, mentre i linfomi di Hodgkin solo circa il 10%.
Cause
Un’altra distinzione è rappresentata dai diversi fattori di rischio, anche se il rischio di patologia è aumentato in presenza di condizioni di immunodepressione (ad esempio in seguito a un trapianto d’organo o AIDS in caso di infezione da HIV) in entrambi i tipi di linfoma.
I fattori di rischio specifici per l’HL comprendono le infezioni da virus di Epstein-Barr.
I fattori di rischio specifici per la NHL invece includono: l’infezione da virus T-linfotropico dell’uomo, l’assumere ingenti quantità di carne e grasso, così come l’uso massiccio di farmaci immunosoppressori e l’esposizione ad alcuni pesticidi.
Per approfondire:
- Cos’è un linfoma e quali tipi di linfomi esistono?
- Linfoma di Hodgkin: sintomi, cure, prognosi e recidive
- Linfoma non Hodgkin: sintomi, cure, prognosi e recidive
- Globuli bianchi (leucociti) alti, bassi, valori normali ed interpretazione
Istopatologia
Dal punto di vista istopatologico, il linfoma non Hodgkin si differenzia dal linfoma di Hodgkin anche perché è privo della cellula di Reed-Sternberg, una cellula gigante caratterizzata da due nuclei distinti, che è l’elemento distintivo dei linfomi del secondo tipo.
Prognosi
La prognosi è diversa, migliore per i linfomi di Hodgkin. Il tasso di sopravvivenza complessivo a cinque anni, negli Stati Uniti, per gli Hodgkin è dell’85% mentre per i non Hodgkin è del 69%. Ha comunque poco senso parlare di gravità maggiore nell’uno o nell’altro tipo, dal momento che essa è estremamente soggettiva, dipendendo dallo stadio del linfoma, dall’età del paziente e dal suo stato di salute generale.
L’importanza della diagnosi differenziale
La diagnosi differenziale tra i due tipi di linfoma si pone con l’esame istologico, ossia lo studio delle cellule e dei tessuti al microscopio, oppure con l’analisi molecolare, che consiste nello studio delle modificazioni genetiche nel DNA delle cellule malate. La differenza tra i due tipi di linfoma è sostanziale, e classificare correttamente la malattia è molto importante ai fini della definizione del piano terapeutico: la scelta della terapia dipende infatti dal tipo e dallo stadio del linfoma, dall’età del paziente e dal suo stato di salute generale.
Leggi anche:
- Differenza tra tumore benigno, maligno, neoplasia, cancro e metastasi
- Sistema linfatico e linfonodi: anatomia e funzioni in sintesi
- Leucemia: sintomi, cause, cure e le diverse forme
- Leucemia mieloide acuta: cause, sintomi, diagnosi e cura
- Mieloma multiplo: cause, sintomi, diagnosi e cura
- Cosa sono le metastasi? Tutti i tumori danno metastasi?
- Linfonodo sentinella: cos’è e perché è importante in caso di cancro
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Differenza tra prevenzione primaria, secondaria e terziaria con esempi
- Capire se si ha un tumore: come viene diagnosticato un cancro
- Come prevenire i tumori ed il cancro? I 10 cambiamenti consigliati
- Differenza tra adenocarcinoma e carcinoma con esempi
- Differenza tra cancro e carcinoma con esempi
- Stomie: cosa sono, a che servono, quanti tipi esistono?
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Ipertrofia muscolare: cosa significa e come si raggiunge
- Che significa malattia terminale?
- Quanto tempo mi rimane da vivere?
- Cure palliative: cosa sono ed a che servono?
- Dolore: cos’è, da cosa è causato, quanti tipi di dolore esistono?
- Differenza tra sintomo e segno con esempi
- Differenza tra malattia, sindrome e disturbo con esempi
- Differenza tra malattia acuta e cronica con esempi
- Che significa malattia cronica? Esempi di malattia cronica
- Tumore del colon retto: diagnosi, metastasi, prognosi e stadiazione
- Tumore del colon retto: sintomi iniziali, tardivi e ritardo nella diagnosi
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Linfoma non Hodgkin: sintomi, cure, prognosi e recidive
 Il linfoma non Hodgkin è un tumore che nasce nel sistema linfatico e si sviluppa dai linfociti, cellule presenti nel sangue e nel tessuto linfatico di linfonodi, milza, timo, midollo osseo, tonsille e altre piccole aree dell’organismo. Invece di combattere le malattie, i linfociti (linfociti B o linfociti T) si accumulano nei linfonodi e in altri organi. Il linfoma non Hodgkin ha un’incidenza di 5 volte maggiore rispetto al linfoma di Hodgkin, e il 95% dei pazienti colpiti da questa malattia sono adulti. Sono state identificate almeno 30 forme diverse di questo tipo di tumore.
Il linfoma non Hodgkin è un tumore che nasce nel sistema linfatico e si sviluppa dai linfociti, cellule presenti nel sangue e nel tessuto linfatico di linfonodi, milza, timo, midollo osseo, tonsille e altre piccole aree dell’organismo. Invece di combattere le malattie, i linfociti (linfociti B o linfociti T) si accumulano nei linfonodi e in altri organi. Il linfoma non Hodgkin ha un’incidenza di 5 volte maggiore rispetto al linfoma di Hodgkin, e il 95% dei pazienti colpiti da questa malattia sono adulti. Sono state identificate almeno 30 forme diverse di questo tipo di tumore.
I linfomi possono nascere da tutti i tipi di linfociti (B, T e NK): i più comuni nel nostro Paese sono i linfomi di derivazione dai linfociti B. Le cause di questo tipo di tumore non sono ancora del tutto chiare. Si sa che alla base vi è un’anormale produzione di linfociti. In condizioni non patologiche, questi seguono un normale ciclo di vita: i più vecchi muoiono mentre l’organismo ne produce di nuovi per sostituirli. Nel linfoma non Hodgkin, invece, i vecchi linfociti non muoiono, ma continuano ad aumentare e ad accumularsi all’interno dei linfonodi o di altri tessuti, che si ingrossano o si alterano nella loro struttura.
Quali sono i fattori di rischio per il linfoma non Hodgkin?
La causa precisa di questo tipo di linfoma non è ancora conosciuta, ma alcuni fattori che possono aumentare il rischio di ammalarsi sono:
- condizioni di immunodepressione (ad esempio in seguito a un trapianto d’organo o a infezione da HIV).
- alcune infezioni virali, tra cui HIV, epatite C e virus di Epstein-Barr (responsabile della mononucleosi infettiva).
- agenti chimici presenti ad esempio negli insetticidi.
- età (soprattutto dopo i 60 anni).
Come si può prevenire il linfoma non hodgkin?
Trattandosi di una malattia rara, non è purtroppo noto alcun modo per prevenire l’insorgenza del linfoma non Hodgkin, se non evitando l’esposizione ai fattori di rischio comuni a tutti i tipi di cancro.
Per approfondire:
- Cos’è un linfoma e quali tipi di linfomi esistono?
- Linfoma di Hodgkin: sintomi, cure, prognosi e recidive
- Differenze tra linfoma di Hodgkin e non Hodgkin
Diagnosi
Adulti e bambini con sospetta diagnosi di linfoma non Hodgkin vengono innanzitutto sottoposti ad un accurato esame obiettivo: l’ingrossamento non dolente dei linfonodi di collo, ascelle o inguine è spesso l’unico segno di linfoma non Hodgkin agli stadi iniziali. Altri sintomi possono includere febbre, sudorazione notturna, spossatezza, perdita di peso, dolore o gonfiore addominale, prurito persistente e dolore toracico, tosse o difficoltà respiratoria, a seconda della sede di insorgenza della malattia.
Durante la visita il medico analizza dimensioni e consistenza di tutti i linfonodi, alterati e normali. Vengono quindi eseguite le analisi del sangue e delle urine per escludere un’infezione o un’altra malattia che possano essere la causa dell’ingrossamento dei linfonodi.
Il primo passo per la diagnosi di linfoma non Hodgkin è la biopsia, di parte o di tutto il linfonodo. Il tessuto prelevato viene analizzato dall’anatomopatologo, che oltre a porre la diagnosi di linfoma ne stabilisce il sottogruppo di appartenenza: in generale un linfoma può crescere lentamente (linfoma indolente o “a basso grado di malignità”) o rapidamente (linfoma aggressivo o “ad alto grado di malignità”).
Esiste poi il piccolo sottogruppo dei linfomi “acuti” o molto aggressivi, assimilabili per la loro velocità di crescita alle leucemie acute. Il linfoma non Hodgkin è classificato in circa 30 tipi diversi, sulla base di numerosi fattori, tra cui la derivazione del tumore dai linfociti B o dai linfociti T, le dimensioni e le modificazioni genetiche dei linfociti, le modalità di aggregazione delle cellule tumorali e il loro tasso di crescita.
Successivamente vengono prescritti radiografie, TAC, spesso PET e a volte RMN, allo scopo di valutare l’estensione della malattia ai vari organi e tessuti. A questi esami si aggiunge la biopsia osteomidollare, utile per determinare la presenza di cellule malate a livello del midollo osseo. Al termine di queste indagini al linfoma viene attribuito lo stadio: da I a IV in base al numero di sedi infiltrate, alla presenza di localizzazioni in organi non linfonodali, e il suffisso B o A alla presenza o meno di segni sistemici (febbre, sudorazione, calo ponderale).
Trattamenti
La scelta della terapia dipende dal tipo e dallo stadio del linfoma non-Hodgkin, dall’età del paziente e dal suo stato di salute generale.
Malattia in stadio iniziale (I-II)
Il paziente affetto da linfoma indolente in stadio iniziale (ossia con malattia localizzata da un lato del diaframma) viene generalmente sottoposto a radioterapia con l’applicazione di radiazioni in dosi adatte per distruggere le cellule neoplastiche. Il paziente affetto da linfoma aggressivo in stadio iniziale, invece, a meno di gravi comorbidità, viene sottoposto ad una breve chemioterapia (3 cicli) associata ad anticorpo monoclonale (rituximab) se la malattia è derivata dai linfociti B, e viene successivamente sottoposto a radioterapia di consolidamento sulla/e sede/i di malattia.
Malattia in stadio avanzato (III-IV)
Il paziente affetto da linfoma indolente in stadio avanzato non sempre necessita di un trattamento immediato: se la malattia non mostra segni clinici di rapida evoluzione, si può rimandarne l’inizio monitorando regolarmente il paziente. In caso contrario vengono effettuati da 6 a 8 cicli chemioterapia, sempre associata a rituximab se il linfoma è di derivazione B-linfocitaria. Il paziente affetto da linfoma aggressivo a uno stadio avanzato viene sottoposto a 6-8 cicli di chemioterapia (sempre associata a rituximab per i linfomi B) da iniziarsi in tempi piuttosto rapidi. Nella scelta della chemioterapia vengono utilizzate combinazioni di farmaci, somministrati tramite iniezione endovenosa, per distruggere le cellule tumorali che crescono rapidamente. Esistono anche farmaci da assumere per via orale, che tuttavia vengono oggi riservati a pazienti anziani o con altre patologie concomitanti che rendono troppo rischiosa la somministrazione della terapia endovenosa. I linfomi aggressivi possono insorgere anche primitivamente in sedi extranodali uniche, ad esempio il cervello, e in questo caso richiedere trattamenti chemioterapici dedicati e radioterapia aggiuntiva.
Radioimmunoterapia
Si tratta di farmaci che combinano un anticorpo monoclonale specifico per il linfoma (di derivazione B linfocitaria) con isotopi radioattivi. Questi composti si legano alle cellule tumorali, tramite l’anticorpo che le riconosce, e successivamente le distruggono attraverso la componente radioattiva. La radioimmunoterapia è generalmente ben tollerata, e gli effetti collaterali sono molto rari, tanto che in alcuni casi viene proposta a pazienti che non possono ricevere terapie aggressive, purché siano monitorati regolarmente per i valori dell’emocromo. In Italia è disponibile un solo tipo di radioimmunoconiugati (ibritumomab tiuxetano: combinazione di anticorpo anti-CD20 rituximab con ittrio90), la cui somministrazione è approvata per i linfomi indolenti follicolari in recidiva oppure in prima linea come consolidamento dopo chemioterapia.
Recidiva
Il trattamento standard della recidiva prevede, in pazienti fino a 65-70 anni di età e in buone condizioni, la chemioterapia ad alte dosi con il trapianto (o meglio il supporto) di cellule staminali autologhe, generalmente periferiche come descritto nella scheda “Linfoma di Hodgkin”. In caso di fallimento anche di questa procedura, viene preso in considerazione il trapianto allogenico di cellule staminali, da fratello/sorella compatibile oppure da donatore volontario.
Leggi anche:
- Cos’è un tumore? Perché viene il cancro? Quali sono le cause?
- Differenza tra prevenzione primaria, secondaria e terziaria con esempi
- Capire se si ha un tumore: come viene diagnosticato un cancro
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Ipertrofia muscolare: cosa significa e come si raggiunge
- Differenza tra ipertrofia ed iperplasia con esempi
- Differenza tra iperplasia e neoplasia
- Differenza tra atrofia, distrofia ed aplasia con esempi
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Che differenza c’è tra tumore benigno o maligno, neoplasia, cancro?
- Tumore del colon retto: diagnosi, metastasi, prognosi e stadiazione
- Tumore del colon retto: sintomi iniziali, tardivi e ritardo nella diagnosi
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Linfoma di Hodgkin: sintomi, cure, prognosi e recidive
 Il linfoma di Hodgkin può colpire tutte queste parti del corpo e poi diffondersi ad altri organi. Nel linfoma di Hodgkin, le cellule del sistema linfatico (chiamate linfociti B) crescono in modo anormale e possono accumularsi sia nel sistema linfatico stesso che in altri organi. Con il progredire della malattia, viene compromessa la capacità dell’organismo di combattere le infezioni.
Il linfoma di Hodgkin può colpire tutte queste parti del corpo e poi diffondersi ad altri organi. Nel linfoma di Hodgkin, le cellule del sistema linfatico (chiamate linfociti B) crescono in modo anormale e possono accumularsi sia nel sistema linfatico stesso che in altri organi. Con il progredire della malattia, viene compromessa la capacità dell’organismo di combattere le infezioni.
Quali sono i fattori di rischio per il linfoma di Hodgkin?
La causa precisa di questo tipo di linfoma non è ancora conosciuta, ma i principali fattori di rischio sono:
- età: le fasce più a rischio sono principalmente tra i 20 e i 30 anni e tra i 50 e i 60 anni
- storia familiare: fattori ambientali piuttosto che genetici sembrano essere chiamati in causa
- sesso: sembra che gli uomini presentino un rischio di ammalarsi leggermente maggiore
- virus di Epstein-Barr, responsabile della mononucleosi infettiva
- condizioni di immunodepressione (ad esempio in seguito a un trapianto d’organo o in caso di infezione da HIV)
- fattori geografici: il linfoma Hodgkin è maggiormente diffuso nel Nord Europa, negli Stati Uniti e in Canada e meno presente nei Paesi asiatici
- livello socio-economico: questo linfoma è più comune fra le persone che hanno un tenore di vita elevato.
Esiste un modo di prevenire il linfoma di Hodgkin?
Trattandosi di una malattia rara, non è purtroppo noto alcun modo di prevenire l’insorgenza del linfoma di Hodgkin, se non evitando l’esposizione ai fattori di rischio comuni a tutti i tipi di cancro.
Per approfondire:
- Cos’è un linfoma e quali tipi di linfomi esistono?
- Linfoma non Hodgkin: sintomi, cure, prognosi e recidive
- Differenze tra linfoma di Hodgkin e non Hodgkin
Diagnosi
Il linfoma di Hodgkin può essere difficile da diagnosticare poiché è caratterizzato da sintomi simili a quelli di altre malattie molto frequenti, ad esempio l’influenza. Le persone affette da linfoma di Hodgkin sono spesso asintomatiche. Talvolta è una radiografia del torace eseguita per altri motivi a rivelare un’anomalia che porta alla diagnosi di linfoma di Hodgkin.
Il linfoma di Hodgkin ha tuttavia alcune caratteristiche cliniche peculiari, tra cui la diffusione “ordinata” a stazioni linfonodali limitrofe, cioè, come si dice comunemente, è un linfoma che “non salta le stazioni linfonodali”. Ad esempio è tipico il coinvolgimento dei linfonodi sovra diaframmatici del collo, delle ascelle e del torace, ma molto raramente si verifica coinvolgimento linfonodale al collo e all’addome “saltando” il torace.
Un paziente con linfoma di Hodgkin può riferire febbre, sudorazione notturna, spossatezza, perdita di peso, dolore o gonfiore addominale, prurito persistente e dolore toracico, tosse o difficoltà respiratoria, a seconda della sede di insorgenza della malattia.
In caso di sospetto linfoma di Hodgkin, tramite biopsia vengono prelevati un linfonodo intero oppure un campione di tessuto da un linfonodo patologico. L’anatomopatologo esamina il tessuto per verificare la presenza di modifiche nella struttura del linfonodo normale e per identificare l’eventuale presenza delle cellule caratteristiche del linfoma di Hodgkin, chiamate cellule di Reed-Sternberg.
In caso di linfoma di Hodgkin il linfonodo malato contiene solo una piccola quantità di cellule neoplastiche, e una maggior quantità di infiltrato infiammatorio e di fibrosi circostante. Il paziente viene inoltre sottoposto a esami del sangue e a biopsia osteomidollare, oltre che a radiografie e a PET, TAC o RMN allo scopo di sondare la diffusione del tumore.
Al termine di queste indagini al linfoma viene attribuito lo stadio: da I a IV in base al numero di sedi infiltrate e alla presenza di localizzazioni in organi non linfonodali, associato al suffisso A o B in base alla presenza o meno di segni sistemici (febbre, sudorazione, calo ponderale). In base allo stadio viene stabilito l’approccio terapeutico.
Trattamenti
Le opzioni terapeutiche per il linfoma di Hodgkin dipendono principalmente dallo stadio della malattia al momento della diagnosi. Altrettanto importanti sono il numero e le stazioni di linfonodi intaccati e il coinvolgimento di uno o di entrambi i lati del diaframma. Altri fattori comprendono l’età del paziente, i sintomi e lo stato di salute generale. La maggior parte delle persone trattate per linfoma di Hodgkin vanno incontro ad una remissione completa della malattia. I protocolli di ricerca clinica possono rappresentare un’opzione nei casi in cui le terapie standard si dimostrano inefficaci.
Malattia in stadio iniziale (I-II)
Il paziente con linfoma di Hodgkin circoscritto a una o più aree dallo stesso lato del diaframma, viene sottoposto a una chemioterapia di breve durata (da 2 a 4 cicli) e successivamente a radioterapia con irradiazione dei linfonodi colpiti dalla malattia all’esordio. La radioterapia può in casi molto selezionati essere utilizzata da sola nei casi in cui il paziente presenti delle controindicazioni assolute alla chemioterapia. La radioterapia può aumentare il rischio di altre forme di tumori, ad esempio del seno o del polmone. Per le adolescenti e le donne sotto i 30 anni di età, questo rischio è considerato troppo elevato: anche per questo motivo oggi la radioterapia viene somministrata a basse dosi.
Malattia in stadio avanzato (III-IV)
Il paziente con malattia estesa ad altri distretti linfonodali o ad altri organi è trattato con la chemioterapia, utilizzata anche in caso di recidiva dopo la radioterapia. Dopo la chemioterapia, generalmente 6 cicli, il paziente che all’esordio aveva localizzazioni di malattia di grosse dimensioni (>10 cm) riceve su quelle sedi un ciclo di radioterapia. Negli ultimi anni si è visto che il risultato della PET dopo i primi due cicli di trattamento è particolarmente importante nel predire la prognosi del paziente e l’eventuale rischio di recidiva.
Protocolli di ricerca clinica
La terapia standard di prima linea o di salvataggio è inefficace nel 15% circa dei pazienti affetti da linfoma di Hodgkin. Per questi pazienti in alcuni centri medici esiste l’opzione di partecipare a un protocollo di ricerca clinica che prevede l’utilizzo controllato di nuove terapie non ancora approvate ufficialmente. I protocolli di ricerca clinica hanno lo scopo di determinare la sicurezza e l’efficacia di una terapia: possono non rappresentare una cura, ma prolungare la vita o migliorarne la qualità. Tali protocolli possono prevedere l’utilizzo di nuove molecole di diversa origine, come chemioterapici o terapie biologiche, la cui azione è mirata al meccanismo di proliferazione cellulare tipico di un preciso tipo di neoplasia (farmaci “intelligenti”). Per avere maggiori informazioni e capire quali protocolli possono essere adatti al proprio caso, è opportuno che il paziente si rivolga al proprio emato-oncologo di fiducia.
Recidiva
In caso di linfoma di Hodgkin recidivante dopo la chemioterapia iniziale, viene proposta al paziente l’opzione della chemioterapia in dosi elevate con trapianto di cellule staminali. Poiché dosi elevate di chemioterapia distruggono il midollo osseo, prima si procede al prelievo e al congelamento di cellule staminali emopoietiche dal sangue periferico del paziente stesso. Una volta completata la chemioterapia, le cellule vengono reinfuse al paziente. In caso di fallimento anche di questa procedura, viene preso in considerazione il trapianto allogenico di cellule staminali, da fratello/sorella compatibile oppure da donatore volontario.
Leggi anche:
- Cos’è un tumore? Perché viene il cancro? Quali sono le cause?
- Differenza tra prevenzione primaria, secondaria e terziaria con esempi
- Capire se si ha un tumore: come viene diagnosticato un cancro
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Ipertrofia muscolare: cosa significa e come si raggiunge
- Differenza tra ipertrofia ed iperplasia con esempi
- Differenza tra iperplasia e neoplasia
- Differenza tra atrofia, distrofia ed aplasia con esempi
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Che differenza c’è tra tumore benigno o maligno, neoplasia, cancro?
- Tumore del colon retto: diagnosi, metastasi, prognosi e stadiazione
- Tumore del colon retto: sintomi iniziali, tardivi e ritardo nella diagnosi
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
