 L’energia usata dagli esseri viventi deriva da reazioni di ossido-riduzione metaboliche, caratterizzate da uno scambio di elettroni (sempre accompagnato da uno spostamento di protoni nella stessa direzione).
L’energia usata dagli esseri viventi deriva da reazioni di ossido-riduzione metaboliche, caratterizzate da uno scambio di elettroni (sempre accompagnato da uno spostamento di protoni nella stessa direzione).
Le reazioni di ossido-riduzione possono liberare una grande quantità di energia, che viene accumulata in molecole di adenosin trifosfato (ATP), e sono catalizzate da enzimi specifici detti ossidoreduttasi con il contributo di alcuni coenzimi, i più importanti dei quali sono il NAD+ (nicotinammide adenin dinucleotide) e il FAD (flavin adenin dinucleotide). Negli eucarioti, il principale processo di produzione dell’ATP è la respirazione cellulare, nel corso della quale i componenti elementari ottenuti dalla digestione – aminoacidi, zuccheri semplici e acidi grassi – vengono demoliti per produrre energia. Il substrato principale della respirazione cellulare è il glucosio, che viene ossidato, mentre l’accettore finale di elettroni è sempre l’ossigeno, che viene ridotto dando origine, con l’idrogeno, a molecole d’acqua.
NAD e NADH
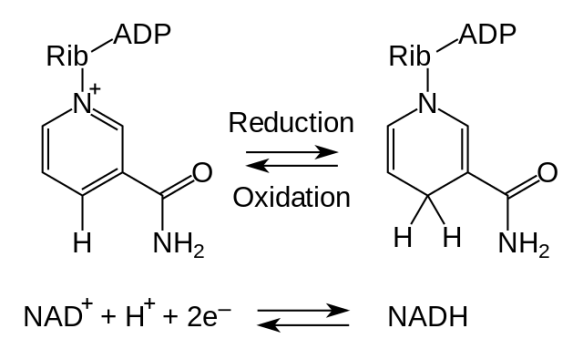
L’anello piridinico della niacina è quello che può sommare gli elettroni: lo ione idruro può essere sommato o al di sopra del piano dell’anello e allora abbiamo una deidrogenazione di tipo A, oppure viene inserito al di sotto del piano della niacina e allora abbiamo una deidrogenazione di tipo B. Addirittura gli enzimi riconoscono l’inserimento di questo ione al di sopra o al di sotto del piano (3 tipo di specificità). La niacina è la parte vitaminica del NAD, chiamata anche vitamina PP.
Pur non essendo l’organismo in grado di sintetizzarle, le vitamine sono sostanze che devono essere sempre presenti nel nostro organismo perché hanno una funzione catalitica, quella di formare i cofattori come il NAD, infatti questi vengono utilizzati più volte nelle reazioni e le proteine si rendono necessarie a basse concentrazioni, tuttavia, poiché avviene un certo ricambio di queste molecole di cofattori, se ne devono assumere i costituenti con la dieta (in questo caso la vitamina PP) con continuità.
La niacina (o acido nicotinico) è la struttura di base, la sua forma attiva è la nicotinammide che si forma quando il gruppo carbossilico della niacina reagisce con un’ammina. In questo modo si forma la nicotinammide, cioè l’ammide dell’acido nicotinico. La nicotinammide si lega ad uno zucchero, cioè il ribosio, il quale si lega con un ponte difosfato ad un altro nucleotide che è l’adenina. Il NAD è formato da 2 nucleotidi: un nucleotide è la nicotinammide, l’altro è l’adenina. Anche la nicotinammide infatti è un nucleotide e anche se non lo troviamo nella costituzione degli acidi nucleici.
Il NAD entra nelle reazioni di ossidoriduzione: il NAD+ , che rappresenta la forma ossidata, si carica di equivalenti riducenti e diventa NAD ridotto, cioè NADH+H+ (si scrive così perché nella posizione para rispetto all’azoto, in cui si sommano gli elettroni, entrano i due elettroni sottoforma di ione idruro H– e quindi sul NAD entra un H– che ha carica negativa, sparisce la carica positiva dell’azoto, che sta sotto, e in soluzione rimane uno ione H+, insomma si scrive NADH+H+ perché uno ione H+ rimane sempre in soluzione). Questi due idrogeni sono i 2 che si staccano dal substrato durante la reazione di ossidoriduzione e di questi 2 idrogeni, uno viene assunto come ione idruro (è quello che porta con sé i 2 elettroni), l’altro rimane in soluzione sottoforma di ione H+.
Una caratteristica del NAD ossidato e del NAD ridotto, è che queste 2 forme assorbono la luce a diverse lunghezze d’onda. Infatti se alla lunghezza d’onda di 270 nm sia la forma ossidata che la forma ridotta del NAD presentano un picco per cui non è possibile distinguere la presenza di una o dell’altra, alla lunghezza d’onda di 340 vi è una differenza di assorbimento che viene sfruttata: a 340 il NAD ridotto assorbe, mentre il NAD ossidato non assorbe.
Questa proprietà può essere sfruttata per scopi clinici: ad esempio consideriamo una reazione catalizzata dall’enzima lattico deidrogenasi (enzima presente nel nostro organismo che può essere un indicatore di rottura di tessuti, infatti i tessuti che si stanno disgregando liberano nel sangue questi enzimi che normalmente sono presenti all’interno dei tessuti), si può fare l’analisi della presenza di questo enzima mettendo i substrati e partendo dal NAD ossidato. Se l’enzima è presente ed è attivo accadrà che man mano che la reazione va avanti diminuisce il NAD ossidato e aumenta il NAD ridotto.
A noi basta una provetta in cui mettiamo il lattato, il piruvato e il NAD ossidato e facciamo attraversare la soluzione da un raggio di luce alla lunghezza d’onda di 340 e vediamo che il NAD ossidato scompare e pian piano aumenta l’assorbimento della luce perché si sta formando il NAD ridotto. Quindi viene sfruttata questa proprietà di assorbire la luce a 340 del NAD ridotto per scopi diagnostici (negli esami di laboratorio si va proprio a vedere la presenza dell’enzima attraverso la produzione di NAD ridotto).
Leggi anche:
- Glicolisi in biochimica: riassunto, schema, spiegazione semplice
- Fotosintesi clorofilliana: riassunto, schema delle fasi, spiegazione semplice
- Modificazioni post-traduzionali delle proteine: dalla fosforilazione alla glicosilazione
NADP (nicotinammide adenin dinucleotide fosfato)
Il NADP ha la stessa struttura del NAD, ma nella posizione 2 del ribosio legato all’adenina entra il gruppo fosforico (quindi differisce il gruppo fosfato in posizione 2 del ribosio). Questa piccola differenza è sufficiente per essere riconosciuta dagli enzimi: alcune deidrogenasi legano il NAD e altre legano il NADP. C’è un’altra differenza fra NAD e NADP, oltre a quella strutturale, c’è una differenza di utilizzo nel nostro organismo. La concentrazione di NAD ossidato è più alta rispetto alla concentrazione del NAD ridotto, mentre la concentrazione di NADP ossidato è più bassa della concentrazione di NADP ridotto (cioè NADPH+H+). Quindi normalmente all’interno della cellula prevale per quanto riguarda il NAD la forma ossidata, mentre per quanto riguarda il NADP la forma ridotta.
Questa differenza spiega i diversi ruoli assunti da questi 2 coenzimi:
- Il NAD ossidato è un substrato pronto ad accettare gli elettroni che derivano dal catabolismo e quindi il NAD interviene nelle reazioni cataboliche del metabolismo. Il NAD ridotto che si forma dove poi essere riconvertito in NAD ossidato altrimenti i processi catabolici non possono più andare avanti perché all’interno della cellula vi deve essere una quantità costante di NAD ossidato e una quantità costante di NAD ridotto, quindi il NAD ridotto man mano che si forma deve essere in qualche modo riportato alla forma ossidata. Questo succede principalmente attraverso il processo della fosforilazione ossidativa: il NAD ridotto cede i suoi elettroni alla catena respiratoria e in ultima analisi li cede all’ossigeno (accettore finale). In quei tessuti in cui mancano i mitocondri (ad esempio nei globuli rossi), dove quindi la catena respiratoria non può essere presente, il NAD ridotto cede i suoi equivalenti riducenti in un processo chiamato fermentazione lattica. Quindi quella dello catena respiratoria e quello della fermentazione lattica, sono i 2 modi attraverso i quali noi riusciamo a riossidare il NAD.
- Il NADP ridotto, che si forma nella via dei pentosi, serve invece per le reazioni biosintetiche (ad esempio la sintesi degli acidi grassi, del colesterolo, degli ormoni steroidei).
Quindi NAD e NADP non sono intercambiabili, ma svolgono compiti ben definiti e ben precisi: il NAD interviene principalmente nel catabolismo, il NADP nella biosintesi.
FAD (flavina adenin dinucleotide)
Anche questo coenzima è formato da due nucleotidi: AMP e FMN. FMN (flavin mononucleotide) deriva dalla riboflavina o proteina B2 in cui il ribitolo (uno zucchero a 5 atomi di carbonio) è stato fosforilato. I due nucleotidi sono uniti mediante un ponte difosfato. L’anello della riboflavina è quello che partecipa al trasferimento degli elettroni (e può svolgere questa funzione anche isolatamente). Se all’FMN si aggiunge un altro nucleotide, si ottiene il FAD.
L’anello della riboflavina, rappresenta la parte vitaminica della struttura ed è detto anche vitamina B2: la parte funzionale è rappresentata dai 2 azoti che sono in grado di sommare degli idrogeni ciascuno con il suo elettrone. Il FAD ha il vantaggio che ogni idrogeno può essere sommato uno per volta, quindi questa molecola può anche partecipare nel trasferimento degli elettroni uno alla volta (cosa non possibile per il NAD: il NAD prende o cede 2 elettroni per volta) e questo può essere una vantaggio nella catena respiratoria. In sostanza può legare uno o anche due atomi di H.
Il FAD si lega in modo covalente (o con un legame molto forte) al centro del sito attivo dell’enzima e questo fa si che questo gruppo (che non è un coenzima, ma un gruppo prostetico) rimanga sempre legato al centro attivo dell’enzima. Quindi dovrà intervenire un’altra molecola per caricarsi di elettroni e cederli alla catena respiratoria. Non sono tantissime le deidrogenasi che presentano questi gruppi (ad esempio la succinato deidrogenasi, che è una delle deidrogenasi del ciclo di Krebs, mentre la maggior parte degli enzimi del ciclo di Krebs sono solubili all’interno della matrice mitocondriale, questo enzima è strutturato sulla membrana mitocondriale nelle vicinanze della catena respiratoria e in questo modo gli elettroni che si legano la FAD sono subito trasferiti alla catena respiratoria).
Leggi anche:
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
- Differenza tra organismi aerobi ed anaerobi con esempi
- Differenza tra aerobico e anaerobico: tipi di esercizio e vantaggi
- Differenza tra catabolismo, anabolismo, metabolismo basale e totale
- Differenza tra endocitosi, fagocitosi, pinocitosi, esocitosi
- Differenza tra trasporto attivo e passivo nella membrana plasmatica
- Differenza tra diffusione semplice, passiva, facilitata e osmosi
- Differenza tra cellula aploide e diploide con esempi
- Differenza tra cellule eucariote e procariote
- Riproduzione cellulare e ciclo cellulare
- Mitosi: spiegazione delle quattro fasi
- Meiosi: spiegazione di tutte tappe
- Differenza tra gemelli omozigoti ed eterozigoti
- E’ vero che il gemello partorito per primo è quello minore?
- Differenza tra allele dominante e recessivo
- Differenza tra omozigote ed eterozigote
- Differenza tra gene e allele
- Differenza tra genotipo e fenotipo
- Organelli (organuli) citoplasmatici della cellula animale: cosa sono ed a che servono?
- Mitocondri: definizione, dimensioni e funzioni
- Citoscheletro: funzioni e struttura
- Ribosomi e reticolo endoplasmatico: cosa sono e che funzioni svolgono?
- Nucleo cellulare: funzioni, dimensioni e membrane nucleari
- Lisosomi: cosa sono? Significato e dimensioni
- Perossisomi: definizione e funzioni
- Membrana plasmatica: definizione e funzioni
- Apparato del Golgi: spiegazione semplice e funzioni
- Citosol: definizione e funzioni
- Quanti cromosomi hanno esseri umani, scimmie, cani, gatti e topi?
- Quanti cromosomi ha chi è affetto da Sindrome di Down?
- Cos’è un cromosoma ed a che serve?
- Cos’è un gene ed a che serve?
- Cosa sono gli alleli ed a che servono?
- Differenza tra riproduzione sessuata e asessuata
- Differenza tra vaccini vivi ed attenuati: vantaggi e svantaggi
- Differenza tra immunità specifica ed immunità aspecifica
- Differenza tra linfociti B e T
- Differenza tra immunità umorale e cellulare
- Differenza tra self non self in immunologia
- Differenza tra ciglia e flagelli con esempi
- Differenza tra ciglia e stereociglia: movimento, struttura e funzioni
- Differenza tra ciglia e microvilli: struttura, movimento e funzioni
- Shock settico e sepsi: sintomi, terapia, conseguenze, si può guarire
- Differenza tra sepsi e Sindrome da risposta infiammatoria sistemica (SIRS)
- Meningite: contagio, sintomi, vaccino, gravità e profilassi
- Endocardite: cause, sintomi, diagnosi e terapie
- Differenza tra batteri Gram negativi e Gram positivi
- Differenza tra batteri bacilli, cocchi, streptococchi e spirilli
- Triade di Virchow: i tre fattori di rischio per la trombosi
- Chetosi: cos’è, da cosa è causata, sintomi e terapia in adulti e bambini
- Coagulazione intravascolare disseminata: cause e trattamenti
- Sepsi: cause, sintomi, diagnosi e terapie
- Differenza tra sepsi e setticemia
- Batteriemia: cura, segni, sintomi, diagnosi ed antibiotici
- I cinque segni cardinali dell’infiammazione
- Differenza tra infezione ed infiammazione: sono la stessa cosa?
- Infiammazione: le alterazioni dei vasi sanguigni, permeabilità vascolare e migrazione leucocitaria
- Differenza tra infezione acuta e cronica
- Morte cellulare: differenza tra necrosi, apoptosi ed autofagia
- Infestazione: cos’è, da cosa è causata, come si cura
- Differenza tra infezione ed infestazione
- Differenza tra infestazione interna ed esterna
- Differenza tra infiammazione cronica granulomatosa e non granulomatosa
- Differenza tra granulomi asettici (da corpo estraneo) e settici
- Linfonodi: cosa sono, come riconoscerli, quando sono pericolosi
- Linfonodo sentinella: cos’è e perché è importante in caso di cancro
- Biopsia del linfonodo sentinella: a che serve, perché è importante
- Sistema linfatico e linfonodi: anatomia e funzioni in sintesi
- Differenza tra cisti e linfonodo
- Differenza tra cisti, pseudocisti, ascesso ed empiema
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su YouTube, su LinkedIn, su Reddit, su Tumblr e su Pinterest, grazie!
