 Il termine emopoiesi o ematopoiesi si riferisce alla formazione e alla maturazione degli elementi corpuscolati del sangue (globuli rossi, globuli bianchi e piastrine) a partire dai loro precursori. Ricordiamo che, nei soggetti di sesso maschile, il sangue è costituito per il 45% circa dalla parte corpuscolata (solida) e per il 55% dal plasma (parte liquida del sangue); nelle donne la parte liquida è percentualmente superiore (60%), mentre la parte corpuscolata è inferiore (40%). Per approfondire, leggi anche:
Il termine emopoiesi o ematopoiesi si riferisce alla formazione e alla maturazione degli elementi corpuscolati del sangue (globuli rossi, globuli bianchi e piastrine) a partire dai loro precursori. Ricordiamo che, nei soggetti di sesso maschile, il sangue è costituito per il 45% circa dalla parte corpuscolata (solida) e per il 55% dal plasma (parte liquida del sangue); nelle donne la parte liquida è percentualmente superiore (60%), mentre la parte corpuscolata è inferiore (40%). Per approfondire, leggi anche:
- Ematocrito (HCT): basso, alto, in gravidanza, valori normali e interpretazione
- Emocromo: valori di riferimento e significato clinico [SCHEMA]
Etimologia
Il termine “emopoiesi” deriva dall’unione di due parole greche: αίμα (sangue) e ποιὲω (creare) ad indicare il processo di creazione delle cellule ematiche.
Dove avviene l’emopoiesi?
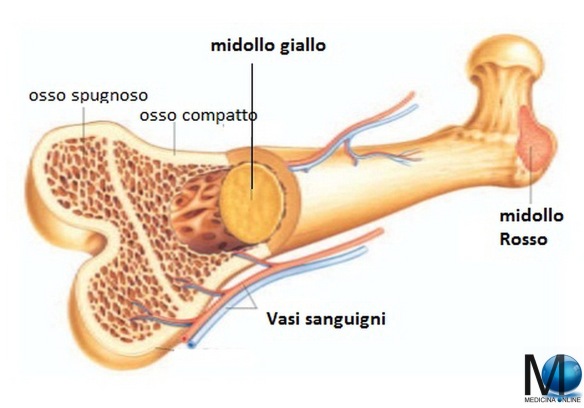
Nell’essere umano adulto normale le cellule ematiche sono formate nel midollo osseo dello scheletro assile, mentre durante la vita intrauterina avviene in altri tessuti (vedi paragrafo in fondo all’articolo). Il midollo osseo occupa i canali delle ossa lunghe (ad esempio il femore) e la fascia centrale delle ossa piatte (ad esempio le ossa del bacino). Nell’anatomia umana possiamo riconoscere due tipi di midollo osseo:
- il midollo osseo rosso (costituito principalmente da tessuto mieloide, la maggioranza del midollo presente alla nascita);
- il midollo osseo giallo (costituito soprattutto da tessuto adiposo che ne determina il colore).
Gli spazi occupati da midollo emopoietico si riducono progressivamente dall’infanzia all’età adulta, fino ad essere confinati alla parte centrale dello scheletro.
Per approfondire, leggi anche: A cosa serve il midollo osseo e dove si trova?
Fisiologia dell’emopoiesi
La maggior parte delle cellule è incapace di ulteriore divisione e, avendo vita relativamente breve, è rimpiazzata continuamente da nuovi elementi provenienti dal midollo osseo. I globuli rossi, i globuli bianchi e le piastrine derivano da un’unica cellula staminale emopoietica pluripotente. La formazione di questa cellula staminale è la prima di una serie di tappe, sequenziali e ordinate, di crescita e maturazione cellulare. La cellula staminale pluripotente può seguire linee di maturazione morfologicamente e funzionalmente diverse, a seconda del condizionamento determinato dal tipo di stimolo o di mediatore presente. Questa procede verso due direzioni principali:
- la linea linfoide da cui si avvia la linfopoiesi (linfociti B, T ed NK ovvero “NATURAL KILLER”)
- la linea mieloide da cui si sviluppa la mielopoiesi, processo che porta alla produzione di granulociti, monociti, megacariociti-piastrine e globuli rossi maturi.
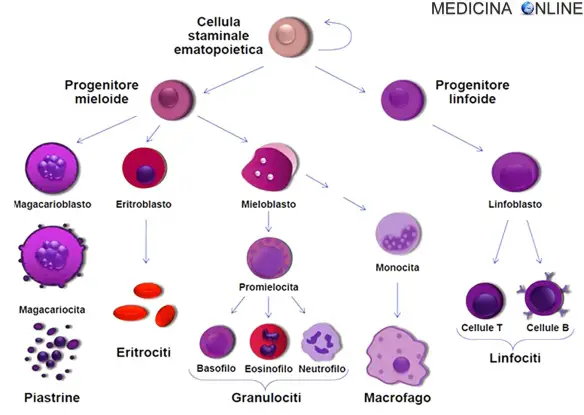
Il processo di emopoiesi è regolato attraverso una serie di passi inizianti con la cellula staminale ematopoietica TOTIpotente (oltre alla linea ematopoietica infatti può differenziarsi teoricamente in ogni linea cellulare, connettivo, fibroblasti, condroblasti, ecc.), che quando prende la via ematopoietica diventa PLURIpotente. Le cellule staminali sono capaci di produrre globuli rossi, tutte le classi di granulociti, monociti, piastrine, e linfociti. Il preciso meccanismo molecolare – o intrinseco nelle cellule staminali stesse o attraverso l’azione di fattori estrinseci – con il quale la cellula staminale diventa adatta a dare la linea differenziativa non è ancora pienamente definita, ma il loro sviluppo e differenziamento è guidato da vari elementi regolatori (es.citochine) che ne guidano il percorso.
Esperimenti su topi suggeriscono che le cellule eritroidi derivano da un progenitore eritroide/megacariocita comune che non si sviluppa in assenza dell’espressione dei fattori di trascrizione GATA-1 e FOG-1. Con l’impegno nella linea differenziativa, i progenitori ematopoietici e le cellule precursori vanno sempre di più sotto influenze regolatorie di fattori di crescita e ormoni. Per la produzione di globuli rossi, l’eritropoietina (EPO) è l’ormone regolatore. EPO è richiesta per il mantenimento di determinate cellule progenitrici eritroidi che, in assenza dell’ormone, vanno incontro alla morte cellulare programmata (apoptosi).
Per approfondire: Eritropoietina (EPO): alta, bassa, anemia, farmaco, rene, effetti collaterali
Eritropoiesi
Il processo regolatorio della produzione di globuli rossi è chiamato eritropoiesi. La linea eritrocitaria (o serie rossa) è caratterizzata da precursori in via di differenziazione morfologica a partire dal proeritroblasto fino agli eritrociti maturi. I cambiamenti osservabili durante la maturazione degli eritrociti sono l’espressione morfologica della sintesi di emoglobina e dell’involuzione del nucleo.
Le manifestazioni morfologiche più importanti consistono:
- Nella progressiva modificazione delle proprietà tintoriali del citoplasma, dalla basofilia (caratteristica degli stadi immaturi dovuta alla presenza di poliribosomi impegnati nella sintesi di emoglobina) all’acidofilia dipendente dal progressivo accumulo di emoglobina.
- Nelle modificazioni del nucleo che perde i nucleoli e diventa via via più compatto e condensato e quindi più piccolo (picnotico) finché viene espulso.
Tutti gli elementi in via di maturazione fino all’eritroblasto policromatofilo presentano attività mitotica che provvede insieme al continuo commissiona mento di nuove cellule staminali ad assicurare una larga produzione di globuli rossi. Il processo di differenziazione completo fino all’eritrocito maturo dura 4-5 giorni.
Il proeritroblasto (E1) è una cellula rotonda, con un diametro di 15-22 µm, con nucleo eucromatico e citoplasma poco abbondante e basofilo, spesso fornito di 1-2 nucleoli.
L’eritroblasto basofilo (E2, E3) ha un diametro di circa 15µm. La cromatina è condensata in grosse zolle disposte spesso radialmente; non sono visibili nucleoli. Il citoplasma è abbondante ed intensamente basofilo; presenta un elevato numero di poliribosomi liberi e scarsi elementi di reticolo endoplasmatico, un complesso di Golgi, molti mitocondri e granuli di ferritina. L’attività mitotica è intensa.
L’eritroblasto policromatofilo (E4) è caratterizzato dall’involuzione e scomparsa del nucleolo e dalla presenza di zone acidofile nel citoplasma (di colore grigiastro o roseo con il metodo di Giemsa o di Wright) frammiste a zone basofile (di colore blu con i precedenti metodi). La colorazione mista del citoplasma dipende dal progressivo accumulo di emoglobina (sintetizzata sui ribosomi citoplasmatici) che ha una reazione acidofila. Via via che l’emoglobina si accumula, il citoplasma diventa progressivamente acidofilo, le aree basofile (cioè il numero di poliribosomi) diminuiscono, scompare il complesso di Golgi, si riducono i mitocondri e il nucleo diventa più piccolo e più denso. Si passa così per gradi allo stadio successivo.
L’eritroblasto ortocromatico (o acidofilo) ha un nucleo piccolo con cromatina molto addensata; il citoplasma mostra intensa acidofilia (ha colore rosso-rosa con il metodo di Giemsa). Negli stadi più avanzati l’attività mitotica si arresta, il nucleo si fa picnotico finché viene espulso dalla cellula che diventa così un eritrocito maturo. Il nucleo espulso è incluso in una sottilissima porzione di citoplasma rivestito da membrana plasmatica; esso è fagocitato dai macrofagi.
L’eritrocito maturo, attraversando la parete dei sinusoidi, passa nel circolo sanguigno. Gli eritrociti maturi giovani, cioè appena immessi in circolo, conservano per circa 24 ore residui citoplasmatici (ribosomi) che si colorano in blu con il metodo di Giemsa (sostanza policromatofila) e precipitano sottoforma di reticolo con la colorazione vitale al blu-cresile brillante (sostanza granulo-filamentosa). Queste cellule sono perciò dette reticolociti e conservano una residua capacità di sintetizzare emoglobina. I reticolociti rappresentano lo 0,8% di tutti gli eritrociti circolanti ed il loro numero è un indice approssimativo della funzionalità eritropoietina del midollo.
Tutti gli stadi di maturazione dell’eritroblasto contengono ferritina, una proteina complessata con micelle colloidali di sali di ferro, che rappresenta una forma di deposito del ferro utilizzato per la sintesi di emoglobina. La ferritina è costituita da un involucro proteico, l’apoferritina, e da un nucleo formato da micelle di un complesso idrato ferrico-fosfato ferrico. Le molecole di ferritina possono raggrupparsi insieme in aggregati denominati siderosomi, evidenziabili anche con la reazione al blu di Prussia. La ferritina è depositata nelle cellule del sistema reticolo-istiocitario da cui è assunta dagli eritroblasti per micro pinocitosi. Inoltre, è stata identificata una globulina plasmatica coniugata con il ferro, la transferrina, che rappresenta la vera forma di trasporto del ferro. La transferrina non è incorporata nell’eritroblasto ma aderisce alla sua superficie e libera il ferro che penetra nella cellula; nel citoplasma il ferro è utilizzato direttamente per la sintesi di emoglobina oppure si lega a molecole di ferritina, sintetizzate nell’eritroblasto stesso. La ferritina, quindi, sia negli elementi del sistema reticolo-istiocitario, sia negli eritroblasti, funge da forma di deposito del ferro in eccesso.
Per approfondire, leggi anche:
- Globuli rossi (eritrociti) alti, bassi, valori normali e interpretazione
- Reticolociti alti, bassi, valori di riferimento, sintomi, cosa fare
- Ferritina alta, bassa, valori normali, significato, cure
- Transferrina: alta, bassa, valori normali, significato, cure
Leucopoiesi
Il processo regolatorio della produzione di globuli bianchi è chiamato leucopoiesi, il quale è un processo fisiologico che è scandito in diversi momenti, a partire dalla fase proliferativa, che interessa l’elemento staminale indifferenziato, a questo primo step seguono delle vere e proprie tappe maturative che caratterizzano la fase dell’emopoiesi. In base alle stesse caratteristiche dei globuli bianchi l’emopoiesi si distingue in: granulocitopoiesi, linfopoiesi, monocitopoiesi. Attraverso la leucopoiesi nel midollo osseo dalle cellule staminali mieloidi si differenziano i progenitori dei leucociti tranne il gruppo dei linfociti, per cui nel midollo osseo si verifica la maturazione e la proliferazione dei globuli bianchi che hanno modo di completare integralmente la loro differenziazione, tranne dei linfociti e dei monociti. Un processo alquanto articolato coinvolge la formazione dei granulociti che avviene in varie tappe maturative che vanno dal mieloblasto al promieloblasto al mielocita ed al metamielocita, nel corso di questi passaggi si vengono così a creare delle metamorfosi relative alla struttura microscopica nucleocitoplasmatica.
Per approfondire: Globuli bianchi (leucociti) alti, bassi, valori normali ed interpretazione
Piastrinopoiesi (o trombopoiesi o megacariocitopoiesi)
Le piastrine sono piccole unità di citoplasma che si separano da una cellula gigante presente nel midollo osseo, il megacariocito, la quale a sua volta si differenzia dalla cellula staminale con uno specifico progenitore: Unità Formante Colonie Megacariocitarie (CFU-MK). I megacariociti sono cellule con diametro di 60-100 µm, dai contorni irregolari e provvisti di molti pseudopodi. Sono caratterizzati da un nucleo polimorfo, nucleolato, formato da molteplici lobi connessi da tratti più ristretti di cromatina. Il nucleo è poliploide (il contenuto di DNA ammonta fino a 64 volte il valore aploide) e deriva da una serie di successive divisioni del nucleo non accompagnate da divisione del citoplasma e seguite da fusione dei nuclei figli all’anafase o alla telofase. I megacariociti non devono essere confusi con gli osteoclasti del midollo e con le cellule giganti da corpo estraneo che sono multinucleati e si formano per fusione cellulare.
Il citoplasma, lievemente acidofilo, è ripieno di granuli raccolti in piccoli gruppi che sono molto simili a quelli che formano il cromomero delle piastrine. Una terza caratteristica saliente dei megacariociti è la presenza di un esteso sistema di cisterne appiattire o tubuli di reticolo endoplasmatico liscio che invade tutto il citoplasma delimitando gruppi di granuli: è il cosiddetto sistema di demarcazione delle piastrine che provvede alla separazione del citoplasma in piccole unità che sono espulse dalla cellula come piastrine. Il citoplasma contiene inoltre un complesso di Golgi, reticolo endoplasmatico granulare e poliribosomi. I megacariociti originano dalla cellula staminale. Il primo precursore identificabile morfologicamente è una cellula più piccola di quella matura (20-40 µm di diametro), con un nucleo non lobato e citoplasma basofilo e privo di granuli che può essere denominata megacarioblasto o megacariocito I (MK1). Questa cellula subisce una serie di endomitosi che conducono alla formazione di un nucleo poliploide e polimorfo. Terminata la duplicazione del DNA, il megacarioblasto sintetizza i granuli specifici, in associazione con il reticolo endoplasmatico granulare e il complesso di Golgi, ed elabora il sistema di membrane di demarcazione, differenziandosi in megacariocito II e III (MK2 e MK3). Probabilmente le membrane di demarcazione originano da invaginazioni concentriche della membrana plasmatica del megacariocito. L’intervallo di tempo che la cellula staminale impiega a diventare megacariocito è di circa 10 giorni.
La produzione di piastrine per frammentazione degli pseudopodi dei megacariociti avviene tramite separazione del citoplasma granulare del megacariocito in piccole unità delimitate da membrana che sono poi espulse come piastrine senza interrompere la continuità della membrana plasmatica. I megacariociti giacciono a ridosso dei seni vascolari del midollo, di modo che le piastrine neo formate possono essere immesse direttamente nel lume vascolare attraverso le aperture della parete del sinusoide.
Per approfondire:
- Piastrine: valori normali, funzioni, numero, alte e basse
- Trombocitosi: valori, sintomi cos’è quando preoccuparsi
- Trombocitemia essenziale: evoluzione, sintomi, sopravvivenza, cure
Vita media cellule mature
- globulo rosso: 120 giorni;
- piastrina: 10 giorni;
- granulociti e monociti: 4 ore;
- linfociti: di solito muoiono dopo aver debellato l’infezione (ad eccezione di linfociti particolari, le cellule della memoria, che vivono anche mesi in attesa di una seconda infezione provocata dallo stesso agente patogeno della prima).
Questi dati sono molto importanti dal punto di vista medico, poiché condizionano le trasfusioni di sangue (o di sole cellule), le operazioni chirurgiche e la somministrazione di farmaci che influenzano l’emostasi. La vita delle cellule del sangue può ridursi drasticamente in caso di varie patologie , a tal proposito leggi anche: Emolisi: significato, sintomi, bilirubina, indici e valori
Alterata emopoiesi
Patologie e condizioni che interessano il midollo direttamente, come i tumori, o indirettamente (ad esempio un tumore renale secernente eritropoietina o, al contrario una insufficienza renale), ma anche gravidanza, sforzo fisico, disidratazione, stress, fumo di sigaretta, ipossia e carenze alimentari, possono determinare una alterazione fisiologica o patologica nell’emopoiesi, che porta a mutamento positivo o negativo del numero assoluto o relativo delle cellule nel sangue o a loro alterazione qualitativa, a tal proposito approfondisci con:
- Sindromi mielodisplastiche: classificazione, sopravvivenza, cure
- Talassemia: cause, sintomi, diagnosi, portatore sano, cura
- Alfa talassemia: cause, sintomi, gravidanza, rischi
- Anemia mediterranea (beta talassemia): conseguenze, analisi, minor, sintomi
- Pancitopenia: significato, cure, sintomi, secondaria, severa, farmaci
- Policitemia: sintomi, falsa, valori, cura, primaria e secondaria
- Leucopenia: cause, sintomi, lieve, grave, da stress, cura
- Leucocitosi: sintomi, da stress, valori, relativa, cronica, significato
- Piastrinopenia lieve e grave: valori, cura, farmaci, autoimmune, cosa fare
- Trombocitosi: valori, sintomi cos’è quando preoccuparsi
Emopoiesi intrauterina
Durante lo sviluppo fetale, l’emopoiesi si svolge in diversi tessuti a seconda della settimana di gestazione:
- dalla terza settimana: nel sacco vitellino;
- dalla quarta settimana: nel fegato;
- dal secondo trimestre: nella milza;
- dal terzo trimestre: nel midollo osseo, come nella vita extrauterina.
Leggi anche:
- Anemia: significato, cause, grave, sintomi, occhi, cura e rimedi
- Ittero emolitico, colestatico, ostruttivo, neonatale: significato, occhi, cura
- Emoglobina bassa, alta, cause e valori normali
- Emocromo: guida completa a tutti i valori del sangue normali e patologici
- Indici corpuscolari MCV, MCH, MCHC, RDW: cosa sono ed a che servono
- Anemia da carenza di ferro: cause, sintomi e cure
- Ferro: alimenti ricchi di ferro, fabbisogno giornaliero, integratore
- Aumentare il ferro in modo naturale, specie in gravidanza
- Anemia emolitica: farmaci, bilirubina, ittero, diagnosi di laboratorio
- Anemia emolitica microangiopatica e schistociti: l’anemia del corridore
- Diagnosi di laboratorio di anemia da carenza di ferro
- Esame con biopsia del midollo osseo: negativo, positivo, fa male?
- Sideremia alta, bassa, valori normali, significato, cure
- Capacità totale di legare il ferro (TIBC): calcolo, formula, valori
- Differenza tra anemia, leucopenia, piastronopenia e pancitopenia
- Differenza tra anemia microcitica, macrocitica e normocitica
- Differenza tra anemia ipercromica, ipocromica e normocromica
- Formula leucocitaria invertita: quando preoccuparsi, leucemia, cure
- Piastrinopenia lieve e grave: valori, cura, farmaci, autoimmune, cosa fare
- Differenza tra emoglobina, ferro, ferritina e transferrina
- A che serve la vitamina B12? L’importanza in gravidanza e allattamento
- Acido folico (vitamina B9): a cosa serve, in quali alimenti trovarlo e perché è importante prima e durante la gravidanza
- Porpora trombotica trombocitopenica: diagnosi e terapia
- Emocromatosi ereditaria e secondaria: sintomi, dieta, diagnosi, cure
- Emosiderosi: cause, sintomi, emosiderina, terapie
- Volume corpuscolare medio (MCV): alto, basso, valori normali e significato
- MCH alto, basso, valori normali ed interpretazione
- MCHC alto, basso, valori normali ed interpretazione
- RDW alto, basso, valori normali ed interpretazione
- Differenza tra anemia e leucemia
- Differenza tra anemia e microcitemia
- Differenza tra anemia megaloblastica e perniciosa
- Differenza tra anemia mediterranea e falciforme
- Differenza tra emoglobina e mioglobina
- Differenza tra emoglobina fetale ed adulta
- Differenza tra emoglobina, ferro, ferritina e transferrina
- Differenza tra emoglobina e globuli rossi
- Emogasanalisi arterioso: procedura, interpretazione, è dolorosa?
- Transaminasi alte, basse, cosa sono, cosa indicano e come si curano
- Azotemia (Urea) alta o bassa: valori, cause, sintomi e cosa fare
- Albumina ed albuminemia alta o bassa: cause, valori e terapie
- VES alta o bassa: cause, sintomi e valori normali della velocità di eritrosedimentazione
- Differenza tra acidosi ed alcalosi, metabolica e respiratoria
- Insulina alta: cause, diabete, prediabete, valori normali e cure
- Emoglobina glicata alta, valori normali, IFCC e diabete
- Clearance della creatinina: alta o bassa, valori, calcolo e sintomi
- Colesterolo e trigliceridi: valori normali, alti, bassi ed interpretazione
- Differenza tra colesterolo HDL “buono” e LDL “cattivo”
- Eccesso di colesterolo (ipercolesterolemia): perché è pericoloso?
- Fattore reumatoide alto o basso? Valori normali e Reuma test
- Testosterone basso, alto, valori normali ed interpretazione
- Ormone follicolo stimolante (FSH) alto, basso, valori normali e significato
- Anemia da carenza di ferro: cause, sintomi e cure
- Ormoni tiroidei: differenza T3 e T4, valori normali e patologici
- TSH alto, basso e valori normali: qual è il significato clinico?
- Tireoglobulina alta, bassa, valori normali ed interpretazione
- Plasma e cellule (elementi corpuscolati) che compongono il sangue
- Plasma e suoi derivati (plasmaderivati)
- Gruppi sanguigni: cosa sono e quali sono compatibili tra loro
- Leucemia: sintomi, cause, cure e le diverse forme
- Eosinofili alti, bassi, valori normali ed interpretazione
- Neutrofili alti, bassi, valori normali ed interpretazione
- Basofili alti, bassi, valori normali ed interpretazione
- Emoglobina nelle urine (emoglobinuria): cause, sintomi e terapia
- Insufficienza epatica lieve, acuta e cronica: dieta e rischio di morte
- Funzionalità epatica; cos’è, cosa indica e come si misura
- Insufficienza renale acuta: sintomi, terapia, linea guida, morte
- Esami per valutare funzionalità renale ed insufficienza renale
- Emodialisi: come funziona, effetti collaterali e complicanze
- Differenza tra dialisi, emodialisi e dialisi peritoneale
- Esame delle urine completo con urinocoltura: come fare e capire i risultati
- Emoglobina nelle urine (emoglobinuria): cause, sintomi e terapia
- Differenza tra insufficienza renale acuta, cronica e dialisi
- Scura o chiara, liquida o schiumosa: la tua urina rivela la tua salute
- Prelievo di sangue venoso: come si fa, linee guida, complicanze
- Differenza tra provette con tappo rosso, verde, viola, nero, blu, grigio, turchese, rosa e giallo
- Fleboclisi (terapia endovenosa): significato, procedura, rischi
- Pressione arteriosa: valori normali e patologici
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure
- Perché la pressione arteriosa alta (ipertensione) è pericolosa?
- Differenza tra neuroni e nervi
- Qual è la differenza tra arteria e vena?
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su YouTube, su LinkedIn, su Reddit, su Tumblr e su Pinterest, grazie!
