 Con leucemia mieloide acuta (LMA, anche chiamata leucemia non linfocitica acuta) si indica una neoplasia della linea mieloide delle cellule del sangue, caratterizzata dalla rapida crescita di leucociti (globuli bianchi) anormali che si accumulano nel midollo osseo e, interferendo con la normale produzione delle altre cellule del sangue (piastrine e globuli rossi), determinano i sintomi della malattia.
Con leucemia mieloide acuta (LMA, anche chiamata leucemia non linfocitica acuta) si indica una neoplasia della linea mieloide delle cellule del sangue, caratterizzata dalla rapida crescita di leucociti (globuli bianchi) anormali che si accumulano nel midollo osseo e, interferendo con la normale produzione delle altre cellule del sangue (piastrine e globuli rossi), determinano i sintomi della malattia.
Diffusione
La LMA è la leucemia acuta più comune negli adulti e la sua incidenza aumenta con l’età (è maggiormente diffusa dall’età dei 60 anni in poi) mentre quella totale è di 3,7 su 100.000 persone. Per quanto riguarda il sesso è leggermente più frequente in quello maschile. Nonostante sia una malattia relativamente rara, rappresentando circa l’1,2% delle morti per tumore, la sua incidenza è destinata ad aumentare con il progressivo invecchiamento della popolazione.
Cause e fattori di rischio per la leucemia
Le cause specifiche della leucemia non sono attualmente note, tuttavia le ricerche indicano che determinati fattori di rischio fanno aumentare il rischio di sviluppare leucemia. Avere uno o più fattori di rischio non significa che ci si ammalerà necessariamente di leucemia, come anche il non avere alcun fattore di rischio non indica che non ci si possa comunque ammalare di leucemia. I fattori di rischio noti, sono i seguenti:
- Esposizione alle radiazioni. Le persone esposte a dosi massicce di radiazioni hanno maggiori probabilità di ammalarsi di leucemia mieloide acuta, leucemia mieloide cronica o leucemia linfocitica acuta.
- Radioterapia. Un’altra fonte di esposizione a dosi massicce di radiazioni è la radioterapia contro il tumore e altre malattie. La radioterapia fa aumentare il rischio di ammalarsi di leucemia.
- Chemioterapia. In alcuni casi i pazienti affetti da tumore e curati con determinati farmaci chemioterapici possono ammalarsi in un secondo momento di leucemia mieloide acuta o di leucemia linfocitica acuta. Ad esempio, la cura con gli agenti alchilanti o con gli inibitori della topoisomerasi è associata a una scarsa probabilità di soffrire di leucemia acuta in una fase successiva
- Radiografie e TAC. Le radiografie e le TAC espongono il paziente a dosi di radiazioni ionizzanti estremamente basse, tuttavia la ripetizione frequente di tali indagini potrebbe aumentare il rischio di sviluppare un tumore. Discorso diverso per ecografie e risonanze magnetiche, le quali NON usano radiazioni ionizzanti.
- Fumo. Il fumo di sigaretta fa aumentare il rischio di leucemia mieloide acuta.
- Benzene. L’esposizione al benzene sul posto di lavoro può provocare la leucemia mieloide, la leucemia mieloide cronica oppure la leucemia linfocitica acuta. Il benzene è una sostanza molto usata nell’industria chimica, ma si può trovare anche nel fumo di sigaretta e nel gasolio.
- Formaldeide. L’esposizione alla formaldeide, utilizzata nell’industria petrolifera e chimica, aumenta il rischio di sviluppare leucemia.
- Sindrome di Down e altre malattie ereditarie. Essere affetti da sindrome di Down ed altre altre malattie ereditarie, determina un rischio da 10 a 20 volte superiore di sviluppare una leucemia nei primi dieci anni di vita.
- Precedenti famigliari di leucemia. È raro che diversi membri di una famiglia si ammalino di leucemia, ma la famigliarità è comunque un possibile fattore di rischio.
- Età avanzata e sesso maschile: sono due fattori di rischio non modificabili per la leucemia mieloide acuta.
- Preleucemia: alcune malattie del sangue “preleucemiche”, come la sindrome mielodisplasica o la malattia mieloproliferative, sono in grado di evolvere in leucemia mieloide acuta; il rischio esatto dipende dal tipo di preleucemia.
Fisiopatologia
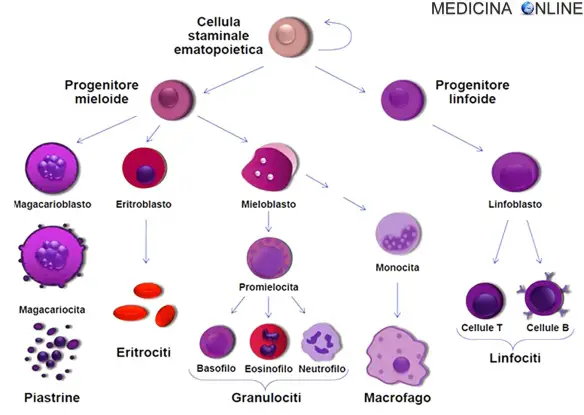
Nella leucemia mieloide, invece, un unico mieloblasto accumula modifiche genetiche che “congelano” la cellula nel suo stato immaturo ed impediscono la differenziazione. Tale mutazione da sola non causa la leucemia; tuttavia, quando tale “arresto nella differenziazione” è combinato con altre mutazioni che perturbano i geni che controllano la proliferazione, il risultato è la crescita incontrollata di cellule immature che comporta l’instaurarsi dell’entità clinica della leucemia mieloide acuta. Gran parte della diversità e l’eterogeneità della condizione è dovuta al fatto che la trasformazione leucemica può verificarsi in una serie di diversi passi lungo il percorso di differenziazione. I moderni schemi di classificazione per la LMA riconoscere le caratteristiche e il comportamento della cellula leucemica, possono dipendere dalla fase in cui la differenziazione si è fermata. Anomalie citogenetiche specifiche si possono trovare in molte persone con leucemia mieloide acuta; i tipi di anomalie cromosomiche hanno spesso un significato prognostico. Le traslocazioni cromosomiche codificano proteine anomale, di solito fattori di trascrizione le cui proprietà alterate possono causare la “differenziazione arresto”. Ad esempio, nella leucemia promielocitica acuta, la t(15;17) produce una proteina di fusione PML-RARa che si lega al recettore dell’acido retinoico elemento nei promotori di diversi geni specifici mieloidi e inibisce la differenziazione mieloide.
Sintomi e segni precoci di leucemia
Nelle fasi iniziali, la leucemia può essere del tutto asintomatica (non dare alcun sintomo), almeno finché le cellule leucemiche non interferiscano in modo eccessivo con le funzioni delle altre cellule. Successivamente il paziente con leucemia cronica può avvertire sintomi aspecifici come malessere e stanchezza a cui spesso il soggetto dà poca importanza.
Sintomi e segni tardivi di leucemia
Il quadro clinico della leucemia nelle fasi successive è dovuto essenzialmente all’invasione del midollo da parte del clone neoplastico e alla conseguente distruzione delle cellule emopoietiche normali: il paziente affetto da leucemia sviluppa quindi tre “blocchi” di sintomi principali:
- anemia: a causa dell’insufficiente produzione di globuli rossi e relativo calo di emoglobina;
- infezioni frequenti e gravi: per la ridotta produzione di globuli bianchi;
- emorragia: a causa di ridotta produzione di piastrine.
Gli altri sintomi di leucemia, sono:
- febbre;
- sudorazioni notturne;
- astenia (stanchezza);
- facile affaticabilità;
- mal di testa;
- anemia;
- dolori ossei;
- dolori articolari;
- inspiegabile perdita di peso;
- infezioni frequenti;
- infezioni opportunistiche;
- facilità al sanguinamento;
- splenomegalia (ingrossamento milza);
- ingrossamento dei linfonodi;
- dolore ai linfonodi.
L’ingrossamento della milza può verificarsi nei casi di leucemia mieloide acuta, ma è in genere lieve e asintomatica; molto più raramente si riscontra epatomegalia (ingrossamento del fegato). L’ingrossamento dei linfonodi appare raramente in questa condizione, a differenza della leucemia linfoblastica acuta. La cute viene coinvolta nel circa il 10% del tempo sotto forma di cloroma. Raramente può verificarsi la sindrome di Sweet, un’infiammazione paraneoplastica che coinvolge la pelle. Alcuni pazienti con la LMA possono andare incontro ad un gonfiore delle gengive a causa dell’infiltrazione di cellule leucemiche nel tessuto gengivale. Raramente, il primo segno di leucemia può essere lo sviluppo di una massa solida leucemica o di un tumore al di fuori del midollo osseo, chiamato cloroma. Di tanto in tanto, una persona può non mostrare alcun sintomo e la leucemia può essere scoperta solo casualmente nel corso di un esame del sangue di routine.
Diagnosi
Il primo indizio per una diagnosi di leucemia mieloide acuta è in genere un risultato anormale su un emocromo ottenuto da semplice prelievo di sangue venoso. Mentre un eccesso di globuli bianchi anormali (leucocitosi) viene frequentemente riscontrato e i blasti leucemici vengono talvolta notati, la condizione può presentarsi con una diminuzione isolata delle piastrine, dei globuli rossi o anche con un basso numero di globuli bianchi (leucopenia). Una diagnosi presuntiva di leucemia mieloide acuta può essere fatta mediante l’esame dello striscio di sangue periferico quando si riscontrano blasti leucemici circolanti con colorazione di Giemsa, tuttavia, per una diagnosi definitiva, di solito è necessaria una biopsia o un agoaspirato del midollo osseo: il campione ottenuto viene esaminato dal patologo per:
- diagnosticare la presenza di leucemia
- differenziare la leucemia mieloide acuta dagli altri tipi di leucemia (per esempio dalla leucemia linfoblastica acuta)
- per classificare il sottotipo di malattia.
La presenza di alcune caratteristiche morfologiche (come corpi di Auer) o specifici risultati nella citometria possono distinguere la leucemia mieloide acuta da altre leucemie; tuttavia, in assenza di tali caratteristiche, la diagnosi può essere più difficile. Gli studi genetici possono anche essere effettuati per cercare specifiche mutazioni nei geni, come FLT3 e nucleofosmina, che possono influenzare l’esito della malattia.
Secondo i criteri OMS ampiamente utilizzati, la diagnosi viene formulata dimostrando il coinvolgimento di più del 20% di sangue e/o del midollo osseo da parte dei mieloblasti leucemici, tranne che nelle tre forme migliori prognosi con anomalie genetiche ricorrenti in cui la presenza della anomalia genetica è indipendentemente dalla percentuale di blasti. Nella maggior parte dei casi le cellule leucemiche invadono il midollo osseo ed il sangue periferico. Molto rararamente, la leucemia mieloide acuta può manifestarsi come un tumore “extra-midollare” (cloroma o sarcoma granulocitico). Molto raro è anche il coinvolgimento del sistema nervoso centrale.
Poiché la leucemia promielocitica acuta (LPA) vanta la più alta curabilità e richiede un’unica forma di trattamento è importante stabilire o escludere rapidamente la diagnosi di questo sottotipo di leucemia. L’ibridazione fluorescente in situ eseguita sul sangue o sul midollo osseo è spesso usata per questo scopo, essendo facile identificare la traslocazione cromosomica [t(15;17)(q22;q12)] che caratterizza il sottotipo.
Classificazione FAB
La classificazione prevede 7 forme differenti:
| Forma | Antigeni | Diffusione | Sottoforme |
|---|---|---|---|
| M1- Mieloblastica senza maturazione | CD13 – CD31 – CD33 – CD34 – HLA-DR | Dal 15 al 20% | Nessuna |
| M2 – Mieloblastica con maturazione | CD13 – CD15 – CD31 – CD33 – HLA-DR | Dal 25 al 35% | Nessuna |
| M3 – Promielocitica tipica | CD13 – CD31 – CD33 | Dal 25 al 30% | M3v (Promielocitica microgranulare) |
| M4 – Mielomonoblastica | CD11c – CD13 – CD14 – CD15 – CD31 – CD33 – HLA-DR | Dal 20 al 25% | Nessuna |
| M5 – Monoblastica | CD11b – CD11c – CD13 – CD14 – CD15 – CD31- CD33 | dal 2 al 15% | M5a (senza maturazione) M5b (con maturazione) |
| M6 – Eritroblastica | Glicoforina A | dal 3 al 5% | Nessuna |
| M7 Megacarioblastica | CD41 CD42 CD61 | dal 1 al 3% | Nessuna |
Ci sono forme più rare che non fanno parte di questa classificazione:
- leucemia basofila acuta;
- leucemia mastocitaria;
- leucemia eosinofila acuta.
Leucemia promielocitica tipica (M3)
Una menzione a parte merita la leucemia promielocitica tipica (M3) che si caratterizza per la presenza di una peculiare alterazione a carico dei cromosomi 15 e 17, con scambio reciproco di materiale cromosomico. Questa alterazione blocca la maturazione dei globuli bianchi allo stadio di promielociti e lo sblocco può essere facilitato da una sostanza derivata dalla vitamina A nota come acido transretinoico (ATRA). Molto spesso i pazienti con LAM-M3 hanno all’esordio della malattia importanti problemi di coagulazione per i quali deve essere prontamente intrapreso un trattamento specifico in centri di ematologia altamente specializzati. Grazie ad un’approfondita conoscenza dei meccanismi molecolari alla base di questa forma di leucemia, la prognosi della LMA-M3 è molto migliorata. L’associazione tra ATRA e chemioterapia permette di ottenere remissioni complete durature e guarigioni. Per i pazienti che presentano iniziali segni di ripresa di malattia, oggi sono disponibili nuove terapie mirate come il Triossido di Arsenico, capaci di riportare la malattia in remissione completa e duratura nella grande maggioranza dei casi.
Terapia
Il piano terapeutico dei vari tipi di LMA, dipende da svariati fattori tra cui:
- età del paziente (specialmente se inferiore o superiore ai 60 anni);
- condizioni cliniche del paziente ed eventuale presenza di altre patologie;
- sottotipo di LMA;
- presenza di malattia nel sistema nervoso centrale;
- presenza di gravi infezioni alla diagnosi;
- storia di precedente mielodisplasia o di precedenti terapie radio-chemioterapiche.
Nella maggior parte dei casi il trattamento di scelta è rappresentato dalla chemioterapia secondo schemi inseriti nell’ambito di protocolli clinici condivisi da numerosi centri di Ematologia con esperienza nel campo della cura delle leucemie acute. La terapia si distingue in intensiva e conservativa. Nei pazienti con età maggiore di 60-65 anni la chemioterapia intensiva ha molto spesso risultati inferiori rispetto ai più giovani. Questo è in relazione sia ad una maggiore frequenza di caratteristiche biologiche più aggressive rispetto alle leucemie dei soggetti più giovani, sia ad una maggiore fragilità clinica dei soggetti più anziani. nonostante ciò, sulla scorta dei risultati clinici fino ad oggi disponibili, la possibilità di porre l’indicazione per una chemioterapia intensiva va sempre presa in considerazione anche nei soggetti di età maggiore di 60-65 anni, previa un’attenta ed approfondita valutazione delle caratteristiche della leucemia e del paziente. La chemioterapia intensiva molto spesso abbina almeno due chemioterapici allo scopo di ottenere la remissione completa di malattia. Quella conservativa ha l’obiettivo di attuare un controllo temporaneo della progressione della malattia senza cercare la remissione completa e prevede solitamente l’uso di un solo chemioterapico.
La terapia della leucemia mieloide acuta prevede:
Chemioterapia
Ha lo scopo di eliminare le cellule leucemiche presenti nel midollo osseo e nel sangue così da permettere alle cellule immature normali residue del midollo di crescere e maturare per produrre cellule normali del sangue. Nella terapia intensiva i chemioterapici sono somministrati per via endovenosa, nella terapia conservativa possono essere somministrati anche per bocca. La chemioterapia intensiva viene somministrata in regime di ricovero, durante il quale il paziente viene sottoposto ad uno stretto monitoraggio dei valori dell’emocromo che raggiungono livelli molto bassi sia di globuli bianchi, sia di rossi e piastrine (fase di aplasia). La fase di aplasia può complicarsi con infezioni talora gravi che richiedono una complessa terapia antibiotica. La fase iniziale della chemioterapia intensiva viene denominata chemioterapia di induzione mentre le fasi successive chemioterapia di consolidamento e/o di mantenimento. Nella larga maggioranza dei protocolli clinici la chemioterapia di induzione si basa sull’associazione di 2 chemioterapici, un‘antraciclina (va ricordato che le antraciclinie furono scoperte in Italia) e la citarabina. La chemioterapia di consolidamento e/o di mantenimento possono avere modalità leggermente diverse in base ai diversi protocolli clinici. Al termine della chemioterapia di induzione ed in alcuni casi anche delle terapie di consolidamento/mantenimento, vengono ripetute alcune analisi sul midollo osseo e sul sangue periferico per definire la risposta al trattamento
Catetere venoso
Data la necessità di utilizzare molto frequente la via di somministrazione endovenosa, in particolare nella terapia intensiva, si posiziona di un catetere venoso centrale (CVC) in una vena del collo o sotto la clavicola. Il catetere è solitamente “tunnellizzato” ovvero una sua piccola porzione decorre sottocute prima di entrare nella vena succlavia, allo scopo di garantire una prolungata permanenza, una pronta accessibilità agli operatori e una più bassa incidenza di infezioni. Grazie al catetere venoso centrale vengono facilitati i prelievi di sangue, le trasfusioni di sangue e l’infusione di chemioterapici e antibiotici.
Trasfusioni
A seguito della chemioterapia, i valori dell’emocromo scendono spesso a livelli molto bassi prima che le cellule normali del sangue ricomincino a crescere. In questa fase è molto frequente che i pazienti debbano ricorrere a trasfusioni di globuli rossi e di piastrine. In Humanitas l’Unità Operativa di Ematologia ha maturato un’adeguata esperienza nella gestione delle complicanze della fase di aplasia post-chemioterapica nella cura delle leucemie acute.
Risposta al trattamento
Se la chemioterapia di induzione ha successo, il paziente ottiene la remissione completa della malattia. I valori dell’emocromo tornano nella norma (o quasi), il numero di cellule leucemiche (blasti) all’analisi morfologica del midollo osseo è <5% ed il paziente è solitamente in grado di lasciare l’ospedale. Le terapie di consolidamento/mantenimento hanno lo scopo di mantenere la remissione completa il più a lungo possibile, e fino al trapianto per coloro che possono essere avviati a tale procedura. La durata della chemioterapia e l’indicazione al trapianto dipendono dal tipo di leucemia, dalla sua categoria di rischio e dalle condizioni del paziente.
Trapianto di cellule staminali emopoietiche
Fino a 65 anni di età, i pazienti affetti da LMA possono essere candidati al trapianto di midollo. Il trapianto di midollo autologo (ovvero utilizzando le proprie cellule staminali emopoietiche) trova limitate indicazioni nella LMA. Il trapianto allogenico (ovvero utilizzando le cellule staminali emopoietiche di un donatore sano) trova piena indicazione per tutte le leucemie acute ad alto rischio che raggiungono la remissione completa. La decisione di candidare un paziente con leucemia al trapianto autologo o allogenico è in relazione al tipo di leucemia, alla sua categoria di rischio, all’età del paziente, alle sue condizioni cliniche e si accompagna sempre ad un approfondito colloquio con i medici dell’Unità Trapianto su potenziali rischi e benefici. Le leucemie a buona prognosi non vengono mai candidate al trapianto, a meno che nel corso del trattamento si assista ad una ricaduta della malattia o la risposta venga giudicata insoddisfacente o incompleta. Il trapianto allogenico resta l’unica arma in grado di offrire una speranza di guarigione anche in leucemie in fase avanzata o refrattarie ai trattamenti convenzionali. Humanitas ha maturato un’adeguata esperienza in campo trapiantologico, è accreditato per il trapianto da donatore non consanguineo ed offre la possibilità del trapianto da sorgenti alternative come cordone ombelicale e donatore familiare aploidentico o parzialmente compatibile.
Prognosi, mortalità, aspettative di vita e guarigione
Non esistono criteri prognostici assoluti. La valutazione prognostica prende in considerazione vari fattori, tra cui:
- l’età del soggetto
- le condizioni generali del soggetto;
- le eventuali altre patologie del soggetto (ipertensione, diabete, obesità…)
- la modalità di insorgenza della patologia
- la morfologia
- il fenotipo
- la citogenetica dei blasti
- le mutazioni genetiche.
La condizione presenta diversi sottotipi: il trattamento e la prognosi variano tra di essi. La leucemia mieloide acuta ha generalmente prognosi più sfavorevole nei soggetti che hanno più di 60 anni: viene curata nel 35%-40% delle persone con un’età inferiore ai 60 anni e nel 5%-15% in coloro di età superiore. Le persone anziane che non sono in grado di sopportare un regime intensivo di chemioterapia, presentano una sopravvivenza media di 5-10 mesi. La mortalità varia, a seconda dell’età calcolata, da 2,7 a 18 ogni 100.000. Se viene trattata precocemente con la chemioterapia tanto da raggiungere una remissione; i pazienti possono continuare a beneficiare di un trattamento chemioterapico aggiuntivo o di un trapianto di cellule staminali ematopoietiche. Dal 1960, grazie a nuovi farmaci, la prognosi è mediamente migliorata arrivando ad una remissione completa nel 65-75% dei pazienti. Nei pazienti pediatrici la sopravvivenza a 5 anni oscilla tra il 75-95%, e al 50% nei casi di recidiva (50% delle prime diagnosi).
Leucemia e gravidanza
La leucemia è raramente associata con la gravidanza, con circa solo 1 caso su 10.000 donne incinte. Il trattamento dipende principalmente dal tipo di leucemia. Le leucemie acute richiedono normalmente, un precoce trattamento aggressivo, nonostante i notevoli rischi di difetti nel feto e di aborto spontaneo, soprattutto se la chemioterapia viene somministrata durante il primo trimestre, il periodo evolutivamente più sensibile.
Per approfondire, leggi:
- Leucemia acuta e cronica: cause, tipi, sopravvivenza e cura
- Leucemia linfoblastica acuta: sopravvivenza, guarigione, aspettativa di vita
- Leucemia linfoblastica acuta a cellule B: cause, diagnosi, sopravvivenza
- Leucemia indifferenziata acuta: cause, diagnosi, cure, sopravvivenza
- Leucemia promielocitica acuta: recidiva, diagnosi, ad alto rischio, cura
- Leucemia linfatica cronica: sintomi, sopravvivenza, guarigione
- Leucemia mieloide cronica: sintomi, emocromo, terapia, sopravvivenza
- Leucemia aleucemica (pseudoleucemia) mieloide e linfatica
- Leucemia a cellule capellute: sopravvivenza, guarigione, cure
Leggi anche:
- Emocromo: guida completa a tutti i valori del sangue normali e patologici
- Esame con biopsia del midollo osseo: negativo, positivo, fa male?
- Stadiazione e classificazione TNM: cancro curabile o terminale?
- Emopoiesi: fasi, schema, dove avviene, fisiologia, significato
- Leucemia: sintomi, cause, cure e le diverse forme
- Globuli bianchi (leucociti) alti, bassi, valori normali ed interpretazione
- Sindromi mielodisplastiche: classificazione, sopravvivenza, cure
- Eosinofili alti, bassi, valori normali ed interpretazione
- Neutrofili alti, bassi, valori normali ed interpretazione
- Basofili alti, bassi, valori normali ed interpretazione
- Leucocitosi: sintomi, da stress, valori, relativa, cronica, significato
- Pancitopenia: significato, cure, sintomi, secondaria, severa, farmaci
- Formula leucocitaria invertita: quando preoccuparsi, leucemia, cure
- Differenza tra tumore e cancro: sono la stessa cosa?
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- A cosa serve il midollo osseo?
- Differenza tra anemia e leucemia
- Esami per valutare funzionalità renale ed insufficienza renale
- Funzionalità epatica; cos’è, cosa indica e come si misura
- Anemia: significato, cause, grave, sintomi, occhi, cura e rimedi
- Leucopenia: cause, sintomi, lieve, grave, da stress, cura
- Piastrinopenia lieve e grave: valori, cura, farmaci, autoimmune, cosa fare
- Policitemia: sintomi, falsa, valori, cura, primaria e secondaria
- Policitemia vera: diagnosi, sintomi, cura, prognosi, ereditarietà
- Ematocrito (HCT): basso, alto, in gravidanza, valori normali e interpretazione
- Emocromo: valori di riferimento e significato clinico [SCHEMA]
- Eritrocitosi: benigna, lieve, valori, da stress, secondaria e primaria
- Anemia da carenza di ferro: cause, sintomi e cure
- Emolisi: significato, sintomi, bilirubina, indici e valori
- Eritropoietina (EPO): alta, bassa, anemia, farmaco, rene, effetti collaterali
- Ittero emolitico, colestatico, ostruttivo, neonatale: significato, occhi, cura
- Emoglobina bassa, alta, cause e valori normali
- Indici corpuscolari MCV, MCH, MCHC, RDW: cosa sono ed a che servono
- Globuli rossi (eritrociti) alti, bassi, valori normali e interpretazione
- Trombocitosi: valori, sintomi cos’è quando preoccuparsi
- Trombocitemia essenziale: evoluzione, sintomi, sopravvivenza, cure
- Piastrine: valori normali, funzioni, numero, alte e basse
- Malattia di Von Willebrand: sintomi, tipo 1 e 2, acquisita, valori, terapia
- Ferro: alimenti ricchi di ferro, fabbisogno giornaliero, integratore
- Aumentare il ferro in modo naturale, specie in gravidanza
- Talassemia: cause, sintomi, diagnosi, portatore sano, cura
- Alfa talassemia: cause, sintomi, gravidanza, rischi
- Anemia mediterranea (beta talassemia): conseguenze, analisi, minor, sintomi
- Anemia emolitica: farmaci, bilirubina, ittero, diagnosi di laboratorio
- Anemia emolitica microangiopatica e schistociti: l’anemia del corridore
- Diagnosi di laboratorio di anemia da carenza di ferro
- Transferrina: alta, bassa, valori normali, significato, cure
- Ferritina alta, bassa, valori normali, significato, cure
- Sideremia alta, bassa, valori normali, significato, cure
- Capacità totale di legare il ferro (TIBC): calcolo, formula, valori
- Differenza tra anemia, leucopenia, piastronopenia e pancitopenia
- Differenza tra anemia microcitica, macrocitica e normocitica
- Differenza tra anemia ipercromica, ipocromica e normocromica
- Differenza tra emoglobina, ferro, ferritina e transferrina
- A che serve la vitamina B12? L’importanza in gravidanza e allattamento
- Acido folico (vitamina B9): a cosa serve, in quali alimenti trovarlo e perché è importante prima e durante la gravidanza
- Porpora trombotica trombocitopenica: diagnosi e terapia
- Emocromatosi ereditaria e secondaria: sintomi, dieta, diagnosi, cure
- Emosiderosi: cause, sintomi, emosiderina, terapie
- Volume corpuscolare medio (MCV): alto, basso, valori normali e significato
- MCH alto, basso, valori normali ed interpretazione
- MCHC alto, basso, valori normali ed interpretazione
- RDW alto, basso, valori normali ed interpretazione
- Differenza tra anemia e microcitemia
- Differenza tra anemia megaloblastica e perniciosa
- Differenza tra anemia mediterranea e falciforme
- Differenza tra emoglobina e mioglobina
- Differenza tra emoglobina fetale ed adulta
- Differenza tra emoglobina, ferro, ferritina e transferrina
- Differenza tra emoglobina e globuli rossi
- Emogasanalisi arterioso: procedura, interpretazione, è dolorosa?
- Transaminasi alte, basse, cosa sono, cosa indicano e come si curano
- Azotemia (Urea) alta o bassa: valori, cause, sintomi e cosa fare
- Albumina ed albuminemia alta o bassa: cause, valori e terapie
- VES alta o bassa: cause, sintomi e valori normali della velocità di eritrosedimentazione
- Differenza tra acidosi ed alcalosi, metabolica e respiratoria
- Insulina alta: cause, diabete, prediabete, valori normali e cure
- Emoglobina glicata alta, valori normali, IFCC e diabete
- Clearance della creatinina: alta o bassa, valori, calcolo e sintomi
- Colesterolo e trigliceridi: valori normali, alti, bassi ed interpretazione
- Differenza tra colesterolo HDL “buono” e LDL “cattivo”
- Eccesso di colesterolo (ipercolesterolemia): perché è pericoloso?
- Fattore reumatoide alto o basso? Valori normali e Reuma test
- Testosterone basso, alto, valori normali ed interpretazione
- Ormone follicolo stimolante (FSH) alto, basso, valori normali e significato
- Anemia da carenza di ferro: cause, sintomi e cure
- Ormoni tiroidei: differenza T3 e T4, valori normali e patologici
- TSH alto, basso e valori normali: qual è il significato clinico?
- Tireoglobulina alta, bassa, valori normali ed interpretazione
- Plasma e cellule (elementi corpuscolati) che compongono il sangue
- Plasma e suoi derivati (plasmaderivati)
- Gruppi sanguigni: cosa sono e quali sono compatibili tra loro
- Emoglobina nelle urine (emoglobinuria): cause, sintomi e terapia
- Insufficienza epatica lieve, acuta e cronica: dieta e rischio di morte
- Insufficienza renale acuta: sintomi, terapia, linea guida, morte
- Emodialisi: come funziona, effetti collaterali e complicanze
- Differenza tra dialisi, emodialisi e dialisi peritoneale
- Esame delle urine completo con urinocoltura: come fare e capire i risultati
- Emoglobina nelle urine (emoglobinuria): cause, sintomi e terapia
- Differenza tra insufficienza renale acuta, cronica e dialisi
- Scura o chiara, liquida o schiumosa: la tua urina rivela la tua salute
- Prelievo di sangue venoso: come si fa, linee guida, complicanze
- Differenza tra provette con tappo rosso, verde, viola, nero, blu, grigio, turchese, rosa e giallo
- Fleboclisi (terapia endovenosa): significato, procedura, rischi
- Pressione arteriosa: valori normali e patologici
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure
- Perché la pressione arteriosa alta (ipertensione) è pericolosa?
Lo Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
