 La noradrenalina (anche chiamata norepinefrina) è un neurotrasmettitore; differisce dall’adrenalina in quanto rispetto ad essa manca di un metile legato al gruppo amminico. Essa è una catecolammina (cioè un’ammina la cui struttura ricorda quella del catecolo) e una fenetilammina avente formula chimica C8H11NO3. Lo stereoisomero naturale è la L-(−)-(R)-norepinefrina. Rilasciata dalle cellule cromaffini come ormone nel sangue, è anche un neurotrasmettitore nel sistema nervoso, dove è rilasciato dai neuroni noradrenergici durante la trasmissione sinaptica. In quanto ormone dello stress, coinvolge parti del cervello dove risiedono i controlli dell’attenzione e delle reazioni. Insieme all’epinefrina, provoca la risposta di “attacco o fuga“, attivando il sistema nervoso simpatico per aumentare il battito cardiaco, rilasciare energia sotto forma di glucosio dal glicogeno e aumentare il tono muscolare. La noradrenalina è rilasciata quando una serie di cambiamenti fisiologici sono attivati da un evento. Questo è provocato dall’attivazione di un’area, che nell’uomo si situa nel tronco encefalico chiamata locus ceruleus. Questo nucleo è all’origine della maggior parte delle azioni della noradrenalina nel cervello umano. I neuroni attivati inviano segnali in entrambe le direzioni dal locus ceruleus lungo diversi percorsi verso varie parti, inclusa la corteccia cerebrale, il sistema limbico e la colonna vertebrale. La Noradrenalina agisce su alcuni recettori adrenergici, in particolare su tutti gli α e sui β1.
La noradrenalina (anche chiamata norepinefrina) è un neurotrasmettitore; differisce dall’adrenalina in quanto rispetto ad essa manca di un metile legato al gruppo amminico. Essa è una catecolammina (cioè un’ammina la cui struttura ricorda quella del catecolo) e una fenetilammina avente formula chimica C8H11NO3. Lo stereoisomero naturale è la L-(−)-(R)-norepinefrina. Rilasciata dalle cellule cromaffini come ormone nel sangue, è anche un neurotrasmettitore nel sistema nervoso, dove è rilasciato dai neuroni noradrenergici durante la trasmissione sinaptica. In quanto ormone dello stress, coinvolge parti del cervello dove risiedono i controlli dell’attenzione e delle reazioni. Insieme all’epinefrina, provoca la risposta di “attacco o fuga“, attivando il sistema nervoso simpatico per aumentare il battito cardiaco, rilasciare energia sotto forma di glucosio dal glicogeno e aumentare il tono muscolare. La noradrenalina è rilasciata quando una serie di cambiamenti fisiologici sono attivati da un evento. Questo è provocato dall’attivazione di un’area, che nell’uomo si situa nel tronco encefalico chiamata locus ceruleus. Questo nucleo è all’origine della maggior parte delle azioni della noradrenalina nel cervello umano. I neuroni attivati inviano segnali in entrambe le direzioni dal locus ceruleus lungo diversi percorsi verso varie parti, inclusa la corteccia cerebrale, il sistema limbico e la colonna vertebrale. La Noradrenalina agisce su alcuni recettori adrenergici, in particolare su tutti gli α e sui β1.
Fisiologia della trasmissione adrenergica
Il neurone noradrenergico
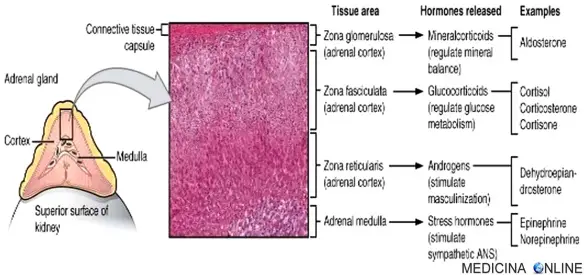
I neuroni noradrenergici periferici sono neuroni simpatici postgangliari, i cui corpi cellulari sono localizzati all’interno dei gangli simpatici. Ad eccezione della midollare del surrene, le terminazioni nervose simpatiche contengono tutta la noradrenalina presente nel sistema nervoso periferico.
Biosintesi
La noradrenalina è sintetizzata da una serie di passaggi enzimatici nelle cellule cromaffini a partire dall’amminoacido tirosina. La prima reazione è l’ossidazione in diidrossifenilalanina (L-DOPA), seguita dalla decarbossilazione nel neurotrasmettitore dopamina, e infine dalla β-ossidazione in noradrenalina. Questa può essere ulteriormente metilata dalla feniletanolammina N-metiltransferasi (PNMT) in adrenalina (detta anche epinefrina dal greco “epi” ovvero sopra e “nefro” cioè nefrone, a indicare l’unità funzionale dell’organo renale, ma usato comunemente anche per riferirsi in toto al rene; quindi “sopra-rene” è un chiaro riferimento alla ghiandola surrenale, ove, solo nei mammiferi, tale ormone è prodotto).
Accumulo della noradrenalina
La maggior parte della noradrenalina presente nelle terminazioni nervose o nelle cellule cromaffini è contenuta all’interno di vescicole. La concentrazione intravescicolare è molto elevata e viene mantenuta grazie a un meccanismo di trasporto garantito da due trasportatori di membrana chiamati VMAT1 e VMAT2. Alcuni farmaci, come la reserpina, bloccano questo trasporto causando la deplezione della noradrenalina della terminazione nervosa.
Liberazione della noradrenalina
La depolarizzazione della membrana della terminazione nervosa determina l’apertura dei canali del calcio nelle membrane della terminazione stessa e il conseguente ingresso di 
Regolazione della liberazione di noradrenalina
La liberazione di noradrenalina è controllata da una serie di sostanze che agiscono sui recettori presinaptici. La noradrenalina, agendo sui recettori presinaptici, può regolare la propria liberazione, e anche quella dell’ATP co-rilasciato. Si ritiene che questo sia un evento fisiologico, mediante il quale la noradrenalina rilasciata esercita un effetto inibitorio localizzato sulle stesse terminazioni dalle quali è stata liberata, il cosiddetto meccanismo di feedback auto-inibitorio. Questo meccanismo opera attraverso i recettori 
Captazione e degradazione metabolica delle catecolamine
Il principale meccanismo alla base della terminazione dell’azione della noradrenalina rilasciata è quello della ricaptazione del trasmettitore nelle terminazioni nervose noradrenergiche.
Captazione delle catecolammine
Vi sono due meccanismi, chiamati uptake 1 e uptake 2, che corrispondono rispettivamente alla captazione neuronale ed extraneuronale. L’uptake 1 – che porta la noradrenalina dalla sinapsi all’interno del neurone – è un sistema ad alta affinità, relativamente selettivo per la noradrenalina e con una velocità massima di trasporto delle catecolammine relativamente bassa, mentre l’uptake 2 – il quale porta l’adrenalina, la noradrenalina e altre sostanze simili (anfetammina, tirammina, efedrina, isoprenalina) dal bottone sinaptico all’interno di specifiche vescicole – è caratterizzato da bassa affinità, ma ha una velocità massima di trasporto molto più elevata.
Degradazione metabolica delle catecolammine
Le catecolammine endogene ed esogene vengono metabolizzate essenzialmente da due classi di enzimi, le monoamminossidasi (MAO) e le catecol-O-metiltransferasi(COMT). Le MAO si trovano all’interno delle cellule, legate alla superficie delle membrane mitocondriali. Le MAO trasformano le catecolammine nelle corrispondenti aldeidi, che, a livello periferico, vengono rapidamente metabolizzate dall’aldeide deidrogenasi, formando i corrispondenti acidi carbossilici. La seconda via responsabile della degradazione enzimatica delle catecolammine implica la metilazione di uno dei due ossidrili del gruppo catecolico per dare origine a un derivato metossilico. La COMT è un enzima diffuso che si trova sia nei neuroni sia in cellule non neuronali. A livello periferico, la terminazione della trasmissione noradrenergica non è determinata in maniera sostanziale né dalle MAO né dalla COMT, in quanto la maggior parte della noradrenalina liberata viene rapidamente captata ad opera dell’uptake 1. Le catecolammine circolanti vengono solitamente inattivate dall’azione combinata di uptake 1, uptake 2 e COMT. L’importanza relativa di questi processi varia in funzione del tipo di catecolammina. La noradrenalina circolante viene infatti rimossa essenzialmente dall’uptake 1, mentre la rimozione dell’adrenalina è imputabile soprattutto all’uptake 2. Il metabolismo della noradrenalina nel SNC presenta un andamento differente. Il ruolo più importante per la terminazione dell’azione del trasmettitore a livello centrale è rivestito dalle MAO.
Farmaci attivi sui recettori adrenergici
Relazione struttura-attività
La struttura molecolare della noradrenalina può essere modificata in modi diversi per dare origine a composti che interagiscano con i vari recettori adrenergici.
- Aumentando le dimensioni dei gruppi sostituenti sull’atomo di azoto: si ottengono composti (adrenalina, isoprenalina e salbutamolo) di potenza relativamente superiore come
-agonisti e meno sensibili all’uptake 1 e all’azione delle MAO.
- L’aggiunta di un gruppo
-metilico aumenta la selettività nei confronti del recettore
e rende i composti resistenti alle MAO.
- La rimozione del gruppo -OH dalla catena laterale (dopamina) riduce significativamente l’interazione con i recettori
e
adrenergici.
- La modificazione dei gruppi -OH catecolici rende i composti resistenti all’azione delle COMT e all’uptake 1 (salbutamolo).
- La rimozione di uno o entrambi i gruppi -OH (tiramina, amfetamina, efedrina) abolisce l’affinità per il recettore, ma mantiene le caratteristiche di ammine simpaticomimetiche indirette, dato che i composti derivati sono substrati dell’uptake 1.
- L’allungamento della catena laterale alchilica, con l’inserimento di un gruppo isopropilico legato all’atomo di azoto, e la modifica dei gruppi -OH catecolici (propranololo, oxprenololo) determinano la generazione di potenti antagonisti dei recettori
.
Agonisti dei recettori adrenergici
Azioni
- Muscolatura liscia. Tutti i tipi di muscolatura liscia, ad eccezione di quella del tratto gastrointestinale che contiene i recettori adrenergici di tipo
, si contraggono in risposta alla stimolazione dei recettori
-adrenergici. L’azione più importante si manifesta sulla muscolatura liscia vasale, e particolarmente nei letti vascolari sottocutaneo e splancnico, che si contraggono fortemente. Anche le grandi arterie, le vene e le arteriole si contraggono, causando una riduzione della perfusione degli organi, un aumento della pressione del ritorno venoso e un aumento delle resistenze periferiche. Tutto ciò contribuisce all’aumento della pressione arteriosa sistolica e diastolica. La stimolazione dei recettori
determina il rilasciamento di buona parte della muscolatura liscia, con un meccanismo che coinvolge un aumento della concentrazione intracellulare di cAMP. L’attivazione dei recettori
provoca un potente rilasciamento della muscolatura liscia bronchiale e gli agonisti selettivi di tipo
risultano pertanto molto importanti nel trattamento dell’asma.
- Cuore. L’azione sui recettori
delle catecolammine determina un potente effetto stimolatorio sul cuore. Sia la frequenza cardiaca (effetto cronotropo) sia la forza di contrazione (effetto inotropo) risultano aumentate, con conseguente marcato aumento della gittata cardiaca e del consumo di ossigeno. Le catecolammine possono anche provocare disturbi del ritmo cardiaco, culminanti nella fibrillazione ventricolare.
- Metabolismo. Le catecolamine promuovono la conversione dei depositi energetici (glicogeno e grasso) in combustibili prontamente disponibili (glucosio e acidi grassi liberi) e causano iperglicemia e iperlipidemia. Anche la secrezione di insulina viene influenzata, prevalentemente in modo inibitorio, attraverso i recettori
, un effetto che contribuisce ulteriormente all’iperglicemia.
- Altri effetti. Il muscolo scheletrico viene influenzato dall’adrenalina tramite la sua interazione con i recettori
. La forza di contrazione delle fibre muscolari veloci (bianche), viene aumentata dall’adrenalina, particolarmente nel muscolo affaticato, mentre la contrazione delle fibre lente (rosse) viene ridotta. L’adrenalina e altri agonisti
provocano inoltre marcato tremore.
Antagonisti dei recettori adrenergici
Diversamente da quanto avviene per gli agonisti, la maggior parte degli antagonisti adrenergici risulta selettiva nei confronti dei recettori 

Antagonisti dei recettori  -adrenergici
-adrenergici
- Antagonisti non selettivi del recettore
-adrenergico (fenossibenzammina, fentolammina). Questi farmaci provocano una caduta pressoria (determinata dal blocco della vasocostrizione mediata dai recettori
) e ipotensione posturale. La gittata e la frequenza cardiaca sono aumentate, come risposta riflessa alla caduta della pressione arteriosa, mediata dai recettori
.
- Antagonisti
-selettivi (prasozina). Causano un’elevata vasodilatazione e caduta della pressione arteriosa, ma con minore tachicardia riflessa rispetto agli antagonisti non selettivi del recettore
.
- Antagonisti
-selettivi (yohimbina). Hanno effetti vasodilatatori e grazie a questa proprietà sono noti come afrodisiaci.
Uso clinico generale ed effetti indesiderati degli antagonisti  -adrenergici
-adrenergici
- Ipertensione: antagonisti
-selettivi
- Ipertrofia prostatica benigna
- Feocromocitoma: fenossibenzammina
L’impotenza è un frequente effetto collaterale degli antagonisti 
Antagonisti dei recettori  -adrenergici
-adrenergici
Azioni
Gli effetti più importanti si manifestano a carico del sistema cardiovascolare e sulla muscolatura liscia bronchiale. In un soggetto a riposo, il propranololo provoca modeste alterazioni della frequenza cardiaca o della pressione arteriosa, ma riduce gli effetti dell’esercizio fisico o dell’eccitazione su queste variabili. La tolleranza allo sforzo massimo è considerevolmente ridotta nel soggetto normale, in parte a causa della ridotta risposta cardiaca, e in parte perché la vasodilatazione nel muscolo scheletrico mediata dal recettore 
Un importante effetto dei 
- riduzione della gittata cardiaca;
- riduzione della liberazione di renina dalle cellule iuxtaglomerulari renali;
- azione centrale che riduce l’attività simpatica.
Molti antagonisti dei recettori 

Impiego clinico
- Sistema cardiovascolare:
- ipertensione arteriosa
- angina pectoris
- dopo infarto miocardico
- aritmie cardiache
- Scompenso cardiaco clinicamente stabile
- Altri impieghi:
- glaucoma
- tireotossicosi
- stati d’ansia, per controllare i sintomi somatici associati all’iperattività simpatica, quali tremore e palpitazioni
- profilassi dell’emicrania
- tremore benigno essenziale (malattia ereditaria)
Effetti indesiderati
- Broncocostrizione. È di scarsa importanza in assenza di malattie delle vie aeree, ma nei pazienti asmatici questo effetto può avere conseguenze drammatiche fino a mettere in pericolo la vita.
- Scompenso cardiaco
- Bradicardia
- Ipoglicemia. Il rilascio di glucosio in risposta all’adrenalina è un meccanismo di sicurezza che può diventare assai importante nel paziente diabetico e in altri individui soggetti ad attacchi di ipoglicemia.
- Affaticamento. Sensazione di fatica dovuta alla ridotta gittata cardiaca e alla ridotta perfusione dei muscoli durante l’attività fisica.
- Estremità fredde. Questo effetto deriva dalla perdita della vasodilatazione mediata dai recettori
nei vasi cutanei.
Farmaci attivi sui neuroni noradrenergici
Farmaci attivi sulla sintesi della noradrenalina
L’
Farmaci attivi sull’accumulo di noradrenalina
La reserpina, a concentrazioni molto basse, blocca il trasporto della noradrenalina e di altre ammine nelle vescicole sinaptiche, legandosi alla proteina di trasporto. La noradrenalina si accumula così nel citoplasma, dove viene degradata dalle MAO. Il contenuto di noradrenalina nel tessuto si riduce progressivamente fino a raggiungere livelli molto bassi e la trasmissione sinaptica viene bloccata.
Farmaci attivi sul rilascio di noradrenalina
I farmaci possono influenzare la liberazione di noradrenalina in quattro modi principali:
- Bloccandone direttamente la liberazione (farmaci bloccanti i neuroni noradrenergici).
- Evocando la liberazione di noradrenalina in assenza di depolarizzazione della membrana (farmaci simpaticomimetici ad azione indiretta).
- Interagendo con i recettori presinaptici che inibiscono o aumentano la liberazione del neurotrasmettitore evocato dalla depolarizzazione.
- Aumentando o diminuendo la quantità di noradrenalina disponibile (reserpina, inibitori delle MAO).
Farmaci che bloccano i neuroni noradrenergici
L’effetto principale della guanetidina consiste nell’inibizione del rilascio di noradrenalina dalle terminazioni simpatiche. I farmaci appartenenti a questa classe riducono o aboliscono la risposta dei tessuti alla stimolazione dei nervi simpatici, ma non influenzano gli effetti della noradrenalina in circolo. La guanetidina è accumulata all’interno delle vescicole sinaptiche mediante un trasportatore vescicolare, e agisce interferendo con l’esocitosi vescicolare e spiazzando la noradrenalina dalle vescicole stesse. In questo modo la guanetidina causa una lenta, progressiva e duratura deplezione della noradrenalina nelle terminazioni simpatiche, effetto simile a quello indotto dalla reserpina.
Ammine simpaticomimetiche ad azione indiretta
I farmaci più importanti di questo gruppo sono la tirammina, l’amfetamina e l’efedrina. La loro azione sui recettori adrenergici è molto scarsa, ma la loro analogia strutturale con la noradrenalina permette il trasporto dall’uptake 1 all’interno delle terminazioni nervose. Una volta all’interno della terminazione, sono accumulate nelle vescicole grazie a un trasportatore vescicolare delle monoammine; questo avviene per scambio con la noradrenalina che viene rilasciata nel citosol. Una parte della noradrenalina citosolica viene degradata dalle MAO, mentre il resto sfugge dalla terminazione stessa attraverso un processo di trasporto mediato dall’uptake 1 per agire sui recettori postsinaptici. Una caratteristica importante degli effetti delle ammine simpaticomimetiche indirette è rappresentata dalla loro capacità di sviluppare tolleranza (anche agli effetti centrali). Le azioni periferiche delle ammine simpaticomimetiche indirette comprendono broncodilatazione, aumento della pressione arteriosa, vasocostrizione periferica, tachicardia, aumento della forza di contrazione del miocardio e inibizione della motilità gastrointestinale.
Inibitori della ricaptazione della noradrenalina
La ricaptazione neuronale della noradrenalina libera (uptake 1) è il meccanismo più importante grazie al quale viene terminata la sua azione sui recettori. Molti farmaci inibiscono questo trasporto e di conseguenza aumentano gli effetti sia dell’attività del nervo simpatico sia della noradrenalina in circolo. La classe principale di inibitori dell’uptake 1 è costituita dagli antidepressivi triciclici, quali la desiprammina (causa tachicardia e aritmie cardiache). Un’altra classe di antidepressivi attivi sulla ricaptazione della Noradrenalina sono i NaRI (Inibitori Selettivi della Ricaptazione della Noradrenalina), questi possiedono la caratteristica unica di inibire la ricaptazione della Noradrenalina, avendo specificità e selettivita recettoriale altissima, senza agire sui sistemi Istamminergici, Muscarinici e Adrenergici α1 e α2, al contrario dei Triciclici che invece non possiedono questa selettività; unico farmaco attualmente in commercio di questa classe è la reboxetina.
La cocaina è nota soprattutto per la possibilità di abuso e per la sua attività di anestetico locale (potenzia la trasmissione simpatica, causando tachicardia e aumento della pressione arteriosa).
Usi clinici
Disturbo da deficit di attenzione e iperattività
La noradrenalina, insieme alla dopamina, è ritenuta svolgere un importante ruolo nell’attenzione e nella sua focalizzazione. Per i pazienti affetti da ADD/ADHD, sostanze psicostimolanti come il Ritalin/Concerta (metilfenidato), la Dexedrina (dextroanfetammine), e Adderall (una mistura non-racemica di sali anfetamminici) sono prescritte per supportare l’aumento dei livelli di noradrenalina e di dopamina. La strattera (atomoxetina) è un inibitore selettivo della ricaptazione della noradrenalina (NaRI), ed è la sola cura per l’ADD/ADHD, in quanto agisce solo sulla noradrenalina, e non sulla dopamina. Come risultato la strattera ha un più basso potenziale d’abuso. Comunque, può non essere così efficace come altri psicostimolanti sulle molte persone che hanno l’ADD/ADHD.
Depressione
Differenze nel sistema della noradrenalina sono implicate nella depressione. Gli inibitori di riassorbimento della serotonina e della noradrenalina (SNRIs) sono antidepressivi che trattano la depressione aumentando la quantità di serotonina e noradrenalina disponibili ai recettori postsinaptici del cervello. Si hanno prove che il trasportatore della noradrenalina trasporta anche la dopamina, con l’effetto che i SNRI possono anche aumentare la trasmissione di dopamina. Questo perché i SNRIlavorano inibendo il riassorbimento, ad esempio evitando che i trasportatori di serotonina e noradrenalina riportino i rispettivi neurotrasmettitori nelle vescicole presinaptiche per utilizzi futuri. Se il trasportatore di noradrenalina normalmente “ricicla” anche un po’ di dopamina, allora i SNRI miglioreranno la trasmissione dopaminergica. Pertanto, gli effetti antidepressivi associati ai crescenti livelli di noradrenalina sono anche in parte o largamente dovuti al concomitante aumento della dopamina (particolarmente nella corteccia prefrontale). Altri antidepressivi (per esempio alcuni antidepressivi triciclici (TCAs) agiscono ugualmente sulla noradrenalina, in alcuni casi senza agire direttamente su altri neurotrasmettitori.
Vasocompressione
La norepinefrina è anche usata come vasocompressore nei pazienti con ipotensione critica. Si introduce per via endovenosa e si lega sui recettori adregenici alpha-1 per provocare la vasocostrizione, e beta-1 per accelerare il ritmo cardiaco aumentare la pressione e la gittata cardiaca. Viene usata soprattutto per trattare i pazienti in setticemia i quali mostrano una percentuale di sopravvivenza superiore a quelli trattati con la dopamina.
Metaboliti
Nei mammiferi la noradrenalina è rapidamente degradata in vari metaboliti. I principali metaboliti sono:
- Normetanefrina (attraverso l’enzima COMT)
- Acido 3,4-diidrossimandelico (attraverso la monoammina ossidasi)
- Acido 3-Metossi-4-idrossimandelico (attraverso la monoammina ossidasi)
- 3-Metossi-4-idrossifenilglicolo (attraverso la monoammina ossidasi)
- Adrenalina (attraverso la N-metiltransferasi)
Leggi anche:
- Surrene: anatomia, funzioni e patologie in sintesi
- Asse ipotalamo-ipofisi-surrene: funzionamento ed ormoni rilasciati
- Cos’è l’adrenalina ed a cosa serve?
- Adrenalina e “combatti o fuggi”: ecco cosa accade nel nostro corpo quando siamo terrorizzati
- Differenza tra beta bloccanti, ace inibitori, calcio antagonisti, sartani e diuretici
- Testosterone basso, alto, valori normali ed interpretazione
- Ormoni estrogeni: cosa sono e quali funzioni svolgono?
- Progesterone: cos’è, a cosa serve, valori e quali funzioni ha in gravidanza?
- Quando la donna ha troppi peli dove non dovrebbero essere: irsutismo, cause, trattamenti e differenze con ipertricosi
- Cos’è una ghiandola endocrina? A che servono gli ormoni ed il sistema endocrino?
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Ipotalamo: anatomia, struttura e funzioni
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
- Asse ipotalamo-ipofisi-gonade: funzionamento ed ormoni rilasciati
- Asse ipotalamo-ipofisi-testicolo: funzionamento ed ormoni rilasciati
- Asse ipotalamo-ipofisi-tiroide: funzionamento ed ormoni rilasciati
- Differenze tra adrenalina e noradrenalina
- Apparato urinario: anatomia e fisiologia [SCHEMA]
- Rene: anatomia, funzioni e patologie in sintesi
- Differenza tra surrene e rene
- Dopammina: cos’è ed a che serve?
- Neurotrasmettitori: cosa sono ed a che servono
- Si può vivere senza reni? Conseguenze della nefrectomia
- Dopammina: biosintesi, rilascio nello spazio sinaptico e degradazione
- Sistema dopamminergico: i circuti nervosi della dopammina
- Colesterolo: cos’è ed a cosa serve?
- Adrenalina ed epinefrina sono la stessa cosa?
- Ormone della crescita (GH) a che serve e da cosa è prodotto?
- Serotonina e triptofano: cosa sono e in quali cibi trovarli
- Glutamina: a che serve, quando assumerlo, dosi ed effetti collaterali
- Creatinina alta o bassa: cos’è, cosa indica e come si corregge
- Rene: anatomia, funzioni e patologie in sintesi
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso simpatico: funzioni
- Sistema nervoso parasimpatico: funzioni
Lo Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
