 Secondo la teoria di Brønsted-Lowry, un acido è una sostanza capace di cedere ioni H+ a un’altra specie chimica detta base, una base è invece una sostanza capace di acquisire ioni H+ da un’altra specie chimica, detta acido.
Secondo la teoria di Brønsted-Lowry, un acido è una sostanza capace di cedere ioni H+ a un’altra specie chimica detta base, una base è invece una sostanza capace di acquisire ioni H+ da un’altra specie chimica, detta acido.
Secondo la teoria di Lewis, un acido è una sostanza capace di accettare un doppietto elettronico da un’altra specie chimica capace di donarli detta base; una base è invece una sostanza capace di donare un doppietto elettronico a un’altra specie chimica detta acido.
Gli acidi e le basi appartengono a due classi di composti chimici che presentano alcune proprietà completamente opposte.
Gli acidi:
- hanno un sapore prevalentemente aspro;
- conferiscono alle cartine al tornasole una colorazione rossa;
- a contatto con quasi tutti i metalli reagiscono liberando idrogeno allo stato gassoso.
le basi:
- hanno sapore amaro;
- danno al tornasole una colorazione blu;
- sono viscide al tatto.
Le reazioni acido-base sono quelle reazioni chimiche in cui un protone (ione H+) passa da una specie chimica ad un’altra. Fra queste le più comuni, in soluzione acquosa, sono quelle di neutralizzazione. Mescolando soluzioni acquose di un acido e di una base, si sviluppa questo tipo di reazione, che ha la caratteristica di procedere rapidamente producendo un sale e acqua. Ad esempio se facciamo reagire insieme l’acido cloridrico e l’idrossido di sodio avremo una tipica reazione di neutralizzazione:
HCl + NaOH ⇄ H2O + NaCl
Acido cloridrico + idrossido di sodio ⇄ acqua + cloruro di sodio
Misura della forza di un acido ed una base
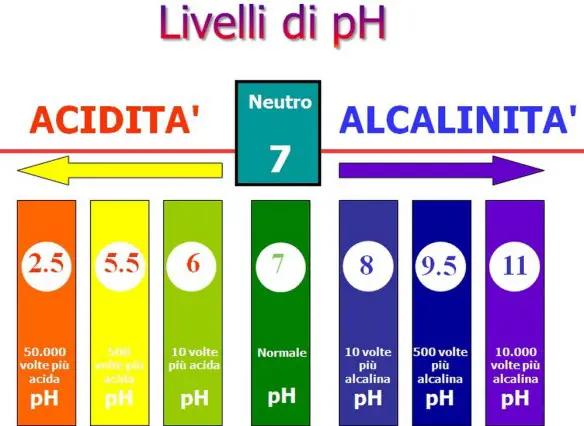
La forza di un acido o di una base può essere analizzata attraverso la misura della concentrazione degli ioni H3O+ e OH-, che saranno stati prodotti in soluzioni acquose rispettivamente acide o basiche per cessione o sottrazione di protoni. Sulla base di questo criterio, sono state ideate due scale, note come pH e pOH, i cui valori corrispondono rispettivamente al logaritmo, cambiato di segno, della concentrazione dello ione ossonio e dello ione idrossido in soluzione acquosa:
pH = -log [H3O+]
pOH = -log [OH-]
All’acqua pura corrisponde pH uguale a 7,0; l’aggiunta di un acido produce un aumento della concentrazione dello ione ossonio [H3O+] e una conseguente riduzione del valore del pH che fornisce una misura della forza dell’acido in analisi.
Leggi anche:
- Cosa significa idrofilo in italiano ed in chimica
- Cosa significa idrofobo in italiano ed in chimica
- Differenza tra idrofobo ed idrofilo con esempi
- Differenza tra aldeidi, chetoni ed alcheni
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità e viscosità di un fluido con esempi
- Differenza tra densità relativa ed assoluta
- Differenza tra densità e concentrazione
- Differenza tra sinapsi elettrica e chimica
- Mitosi: spiegazione delle quattro fasi
- Sinapsi chimica ed elettrica: cosa sono ed a che servono?
- Differenza tra neuroni e nervi
- Qual è la differenza tra arteria e vena?
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
- Differenza tra assoni e dendriti
- Differenza tra cellule eucariote e procariote
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- Differenza tra cellula aploide e diploide con esempi
- Riproduzione cellulare e ciclo cellulare
- Meiosi: spiegazione di tutte tappe
- Differenza tra neuroni e gangli
- Barriera ematoencefalica: dove si trova, funzioni, quali sostanze la attraversano
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Dopammina: cos’è ed a che serve?
- Neurotrasmettitori: cosa sono ed a che servono
- Giunzione neuromuscolare (placca motrice) cos’è ed a che serve?
- Capacità massima dello stomaco: si può “mangiare fino a scoppiare”?
- Differenza tra acidosi ed alcalosi, metabolica e respiratoria
- Differenza tra polipnea e tachipnea
- Respiro patologico: le alterazioni del ritmo respiratorio normale
- Respiro di Biot ed apnee: caratteristiche e cause patologiche e non patologiche
- Respiro di Cheyne-Stokes: caratteristiche e cause patologiche e non patologiche
- Respiro di Kussmaul: caratteristiche e cause
- Respiro di Falstaff: caratteristiche e cause
- Differenza tra monosaccaridi, disaccaridi, polisaccaridi, oligosaccaridi
- Differenza tra pentosi, esosi e triosi: cos’è il fruttosio?
- Differenza tra aldosi e chetosi con esempi
- Differenza tra zuccheri e carboidrati: sono la stessa cosa?
- Differenza tra zuccheri semplici e complessi con esempi
- Differenza tra zuccheri e grassi con esempi
- Differenza tra zuccheri di riserva e di struttura
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!