 Sintesi: l’orbita è una traiettoria definita; l’orbitale è una funzione matematica che ci consente di stabilire dove è più probabile trovare l’elettrone nello spazio intorno al nucleo; il livello energetico indica la quantità definita di energia che possiede l’elettrone quando ruota attorno al nucleo dell’atomo.
Sintesi: l’orbita è una traiettoria definita; l’orbitale è una funzione matematica che ci consente di stabilire dove è più probabile trovare l’elettrone nello spazio intorno al nucleo; il livello energetico indica la quantità definita di energia che possiede l’elettrone quando ruota attorno al nucleo dell’atomo.
Secondo il modello atomico proposto da Bohr agli inizi del secolo scorso, l’elettrone ruota attorno al nucleo atomico descrivendo un’orbita circolare; ad ogni elettrone corrisponde un’orbita ben precisa, cioè un percorso definito che, se l’atomo non assorbe o non emette energia, non varia nel tempo. Gli elettroni che percorrono tali orbite possiedono una quantità ben definita di energia: devono infatti muoversi ad una certa velocità per contrastare la forza elettrica attrattiva che il nucleo, carico positivamente, esercita su di essi, avendo gli elettroni carica elettrica negativa; se gli elettroni fossero fermi non avrebbero altro destino che di essere risucchiati dal nucleo.
Alla quantità ben definita di energia che possiede l’elettrone quando ruota attorno al nucleo si dà il nome di livello energetico dell’orbita; quindi l’orbita corrisponde al percorso che l’elettrone effettua attorno al nucleo mentre il livello energetico corrisponde alla quantità di energia che l’elettrone deve possedere per percorrere quella particolare orbita.
Il termine orbitale è stato invece introdotto con un successivo, e molto più complesso, modello atomico, il modello quantomeccanico dell’atomo. La meccanica quantistica è una teoria della fisica moderna in grado di descrivere il comportamento di particelle piccolissime, come gli elettroni, per le quali non valgono le leggi della fisica classica. La meccanica quantistica dimostra che non è possibile definire la traiettoria di un elettrone, motivo per cui è necessario abbandonare il concetto di orbita percorsa da un elettrone. Al suo posto compare il concetto di orbitale atomico, una complicata funzione matematica che ci consente di ricavare informazioni sulla posizione dell’elettrone, ma soltanto in termini di probabilità della sua presenza in un certo spazio intorno al nucleo. Per esempio, mentre secondo Bohr l’elettrone dell’atomo di idrogeno percorre un’orbita circolare intorno al nucleo e ad una certa distanza da esso (e può trovarsi quindi soltanto su uno dei punti dell’orbita stessa), secondo la meccanica quantistica l’elettrone dell’idrogeno può trovarsi in un punto qualsiasi dello spazio sferico intorno al nucleo, con una probabilità di presenza che è molto alta nella zona più vicina al nucleo e che diventa via via più bassa man mano che ci si allontana dal nucleo.
Ogni orbitale ci consente di descrivere il comportamento di non più di due elettroni; per descrivere gli atomi polielettronici servono quindi più orbitali atomici. Essi si differenziano prima di tutto per il valore di energia (così come per l’orbita, anche a ciascun orbitale corrisponde uno specifico livello energetico), poi per la forma della zona di spazio in cui è grande la probabilità di rinvenire l’elettrone e per l’orientamento nello spazio di tale zona (sui libri di testo di chimica trovi spesso le rappresentazioni di alcuni di tali orbitali). Quando gli orbitali atomici presentano valori simili di energia, ma diversa forma e orientamento nello spazio, si dice che appartengono a diversi sottolivelli energetici. Devi quindi immaginare che gli elettroni di un atomo polielettronico siano distribuiti a distanze via via crescenti dal nucleo e che siano concentrati più a certe distanze dal nucleo che ad altre, cioè più in certe fasce che in altre. All’aumentare della distanza aumenta il valore di energia dell’elettrone, cioè aumenta il suo livello energetico, e aumenta anche il numero di elettroni che può trovarsi nella stessa fascia. Gli elettroni che si trovano in una stessa fascia, che appartengono cioè ad uno stesso livello energetico, ma che occupano zone di spazio differenti, hanno valori di energia leggermente diversi e appartengono per questo a sottolivelli energetici diversi.
Leggi anche:
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- Differenza tra stella, pianeta e satellite con esempi
- Differenza tra satellite naturale ed artificiale con esempi
- Differenza tra satellite artificiale scientifico ed applicativo
- Differenza tra pianeta e pianeta nano con esempi
- Differenza tra pianeta gioviano e terrestre con esempi
- Qual è la differenza fra meteoroide, meteora e meteorite?
- Differenza tra stella cadente e meteora
- In quali giorni dell’anno si possono vedere molte stelle cadenti?
- Differenza tra orbita e traiettoria
- Cos’è un anno luce ed a quanti km corrisponde?
- Differenza tra meteorite, asteroide e cometa con esempi
- Le distanze dell’universo, ovvero: bagliori di luce da una stella ormai scomparsa
- Un giorno sul pianeta Marte: quanto dura un Sol in astronomia?
- Samantha Cristoforetti e il vero simbolo del degrado italiano
- Andremo tutti a vivere su Kepler, il pianeta simile alla terra
- I 5 migliori libri da regalare ad un nerd
- Pale Blue Dot: la Terra vista dallo spazio è un granello nell’universo
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Differenza tra raggi infrarossi, ultravioletti e visibili
- Quanto è grande il sole e quante volte è più grande di terra e luna?
- Come moriremmo se un mega asteroide colpisse la Terra?
- L’astronauta Luca Parmitano è stato proposto per tornare nello spazio nel 2019
- Samantha Cristoforetti astronauta da record mondiale: è la donna con la più grande permanenza consecutiva nello spazio!
- Entro dieci anni scopriremo forme di vita extraterrestri
- Cos’è la radiazione solare? Cosa sono i raggi ultravioletti? Che danni possono provocare alla nostra pelle?
- Prendere il sole fa bene alla salute del cuore: la vitamina D riduce il rischio di coronaropatia
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- L’iraniana Mirzakhani è la prima donna al mondo a ricevere il “Nobel” per la matematica
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Quando inizia e finisce la primavera?
- Quando inizia e finisce l’estate?
- Quando inizia e finisce l’autunno?
- Quando inizia e finisce l’inverno?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Lorenzo il Magnifico: l’amore per la natura, gli animali e la prima giraffa in Italia
- Ciao Margherita!
- L’esperimento di Standford: la pazzia che colpisce chi indossa una divisa
- Donne italiane di cui andare orgogliosi
- Il mio professore era Albert Einstein
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Differenza tra massa e peso in fisica ed in medicina
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Il cardiochirurgo stremato dopo un trapianto cardiaco durato 23 ore
- Le 20 droghe più potenti e pericolose al mondo
- Il mio mito è invece Michel Petrucciani
- Il mio mito è invece Django Reinhardt
- Il mio mito è invece Albert Bruce Sabin
- Il mio mito è invece Giuseppe Moscati
- Il mio mito è invece Ignác Fülöp Semmelweis
- Il mio mito è invece Frederick Treves
- Differenza tra tuono, lampo, fulmine e saetta
- Calcolare la distanza di un temporale con il tempo tra lampo e tuono
- Differenza tra neve, grandine, ghiaccio, nevischio e pioggia
- Differenza tra temporale, pioggia, rovescio e tempesta
- Differenza tra neve artificiale e naturale: qual è la migliore per sciare?
- Differenze tra i vari tipi di neve
- Differenza tra tornado, tromba d’aria, uragano, ciclone e tifone
- Neve: cos’è, come si forma, come si verifica la neve sopra i 2 °C
- Tempesta: come si forma, tipi e classificazione
- Pioggia: come si forma, perché cade e quanti tipi esistono?
- Da cosa sono formate le nuvole e come si creano? Perché piove? Cos’è la grandine e come si forma?
- Quasi 70 gradi sotto zero: il villaggio più freddo al mondo
- Il profumo della pioggia e della natura
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!

 I composti organici includono la quasi totalità dei composti del carbonio, i quali comprendono le molecole costitutive degli organismi viventi .
I composti organici includono la quasi totalità dei composti del carbonio, i quali comprendono le molecole costitutive degli organismi viventi .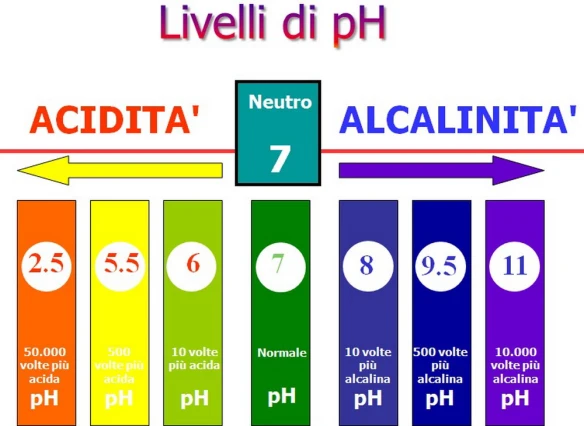 Secondo la teoria di Brønsted-Lowry, un acido è una sostanza capace di cedere ioni H+ a un’altra specie chimica detta base, una base è invece una sostanza capace di acquisire ioni H+ da un’altra specie chimica, detta acido.
Secondo la teoria di Brønsted-Lowry, un acido è una sostanza capace di cedere ioni H+ a un’altra specie chimica detta base, una base è invece una sostanza capace di acquisire ioni H+ da un’altra specie chimica, detta acido.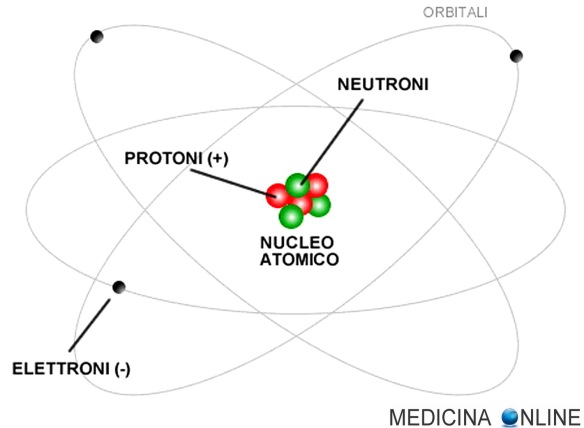 L’atomo è una struttura nella quale è normalmente organizzata la materia nel mondo fisico o in natura. Gli atomi sono formati da costituenti subatomici quali protoni, elettricamente positivi, neutroni, elettricamente neutri, ed elettroni, elettricamente negativi. In un atomo, inoltre, il numero di protoni è uguale al numero di elettroni; protoni ed elettroni hanno carica uguale in valore assoluto, ma di segno opposto. Il termine atomo deriva dal greco e significa “indivisibile”, ciò sta ad indicare che non può essere né creato né distrutto, cosa che poi si scoprì non essere vera.
L’atomo è una struttura nella quale è normalmente organizzata la materia nel mondo fisico o in natura. Gli atomi sono formati da costituenti subatomici quali protoni, elettricamente positivi, neutroni, elettricamente neutri, ed elettroni, elettricamente negativi. In un atomo, inoltre, il numero di protoni è uguale al numero di elettroni; protoni ed elettroni hanno carica uguale in valore assoluto, ma di segno opposto. Il termine atomo deriva dal greco e significa “indivisibile”, ciò sta ad indicare che non può essere né creato né distrutto, cosa che poi si scoprì non essere vera.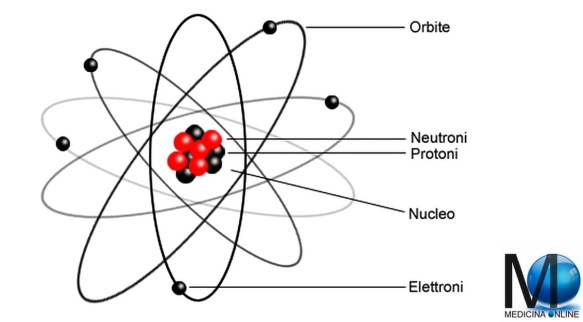 L’atomo è una struttura nella quale è normalmente organizzata la materia nel mondo fisico o in natura. Gli atomi sono formati da costituenti subatomici quali protoni, elettricamente positivi, neutroni, elettricamente neutri, ed elettroni, elettricamente negativi. In un atomo, inoltre, il numero di protoni è uguale al numero di elettroni; protoni ed elettroni hanno carica uguale in valore assoluto, ma di segno opposto. Il termine atomo deriva dal greco e significa “indivisibile”, ciò sta ad indicare che non può essere né creato né distrutto, cosa che poi si scoprì non essere vera. Il primo che ipotizzò l’esistenza di queste piccole particelle fu John Dalton che ne parlò nella sua teoria atomica.
L’atomo è una struttura nella quale è normalmente organizzata la materia nel mondo fisico o in natura. Gli atomi sono formati da costituenti subatomici quali protoni, elettricamente positivi, neutroni, elettricamente neutri, ed elettroni, elettricamente negativi. In un atomo, inoltre, il numero di protoni è uguale al numero di elettroni; protoni ed elettroni hanno carica uguale in valore assoluto, ma di segno opposto. Il termine atomo deriva dal greco e significa “indivisibile”, ciò sta ad indicare che non può essere né creato né distrutto, cosa che poi si scoprì non essere vera. Il primo che ipotizzò l’esistenza di queste piccole particelle fu John Dalton che ne parlò nella sua teoria atomica.