 Dimitri Mendeleev, scienziato russo, concepì il primo modello di tavola periodica nel 1869, disponendo gli allora 63 elementi noti verticalmente, per poi Continua a leggere
Dimitri Mendeleev, scienziato russo, concepì il primo modello di tavola periodica nel 1869, disponendo gli allora 63 elementi noti verticalmente, per poi Continua a leggere
Archivi tag: composto
Differenza tra minerale, roccia, cristallo, vetro, metallo, elemento chimico

Un”geode” cioè una cavità interna ad una roccia ignea con cristalli diffusi
Minerale
Un minerale è un corpo chimico solido costituito da un insieme di atomi disposti, al suo interno, in modo ordinato e periodico: gli atomi formano strutture ben definite nello spazio che occupano. Le strutture si ripetono conferendo la forma finale al minerale. Gli atomi all’interno del minerale formano i sistemi di cristallizzazione, ovvero una disposizione dei cristalli ben precisa. I minerali vengono classificati in varie tipologie:
- elementi nativi: oro, argento, platino, rame;
- solfuri: galena, blenda;
- solfati: gesso;
- alogenuri: salgemma (sale da cucina);
- ossidi: magnetite, ematite;
- carbonati: calcite, dolomite, aragonite;
- fosfati: apatite;
- silicati: quarzo.
La maggior parte dei minerali sono composti da molti cristalli, anche se ciò non è di solito visibile a occhio nudo, perché i singoli cristalli sono di dimensioni microscopiche.
Cristallo e diamante
Un “cristallo” è una struttura solida costituita da atomi, molecole o ioni aventi una disposizione geometricamente regolare, che si ripete indefinitamente nelle tre dimensioni spaziali, detta reticolo cristallino o reticolo di Bravais. I solidi costituiti da un singolo cristallo (detti monocristalli) sono molto rari. Il tipo di struttura assunta dal cristallo gioca un ruolo determinante in molte delle sue proprietà, quali la sfaldatura. Un insiemi di cristalli, ad esempio di quarzo, all’interno della cavità di una roccia, prendono il nome di “geode“. Il diamante è un tipo particolare di cristallo, trasparente e composto da atomi di carbonio a struttura tetraedrica. Viene chiamato cristallo anche un pezzo di vetro forgiato con un taglio così particolare da farlo luccicare in modo similare ad diamante, è ad esempio il caso dei famosi cristalli Swarovski. Tutti i diamanti sono quindi cristalli, mentre non tutti i cristalli sono necessariamente diamanti. I solidi non cristallini (come il vetro) sono detti invece “amorfi”.
Leggi anche:
- Differenza tra diamante, brillante, zircone, grafite e cristallo
- Geode: significato in mineralogia e medicina
Vetro
Il vetro è un materiale solido amorfo ottenuto tramite la solidificazione di un liquido NON accompagnata dalla cristallizzazione. I vetri dunque, al contrario dei cristalli, non possiedono un reticolo cristallino ordinato, ma una struttura disordinata e rigida composta da atomi legati covalentemente; tale reticolo disordinato permette la presenza di interstizi in cui possono essere presenti impurezze, spesso desiderate, date da metalli.
Roccia
Una roccia è un corpo chimico solido costituito da un insieme di minerali: i minerali hanno una quindi composizione chimica definita, mentre le rocce sono formate da diversi minerali e non hanno una composizione definita. Le rocce vengono classificate prima di tutto per genesi e di qui possono essere magmatiche, metamorfiche o sedimentarie:
- roccia sedimentaria = costituita da sedimenti;
- roccia magmatica = deriva dalla solidificazione di un magma;
- roccia metamorfica = deriva da rocce preesistenti (o magmatiche o sedimentarie).
Esempi di rocce
Marmo e Gneiss sono gli esempi più rappresentativi di roccia di origine metamorfica, laddove il Marmo è un prodotto di metamorfismo di rocce sedimentarie come calcari e dolomie mentre il Gneiss è un tipo generico metamorfico di alte profondità perché prodotto da elevate pressione e temperatura su feldspati e quarzo. La pomice è un prodotto vulcanico (effusivo) per lo più silicatico costituito da minerali non cristallini(o almeno non del tutto cristallizzati) con elevata porosità. La dolomia è una roccia di origine sedimentaria carbonatica data dalla dolomite (un carbonato di calcio e magnesio) mentre il basalto è un prodotto vulcanico (effusivo) povero in silice e ricco di pirosseni, plagioclasi ed olivina.
Elemento chimico
Gli elementi chimici sono sostanze pure dalle quali non è possibile ottenere, mediante gli ordinari mezzi chimici, sostanze più semplici. Se, ad esempio, facciamo l’analisi di un oggetto di ferro, si trova che esso è costituito da solo ferro e non è possibile trasformarlo in una sostanza ancora più semplice. Se una sostanza chimica è costituita da atomi dello stesso elemento viene detta “sostanza semplice”, mentre se è costituita da atomi di elementi differenti viene detta “composto chimico”. Spesso le sostanze semplici vengono impropriamente dette “elementi”.
Metallo
Con “metallo” si intende un particolare elemento chimico che costituisce un materiale conduttore di calore e di elettricità, capace di riflettere la luce (dando luogo alla lucentezza metallica), che può essere attaccato dagli acidi (con sviluppo di idrogeno) e dalle basi, spesso con buone caratteristiche di resistenza meccanica. I metalli possono anche essere attaccati dall’acqua, la quale strappa loro gli elettroni di valenza dando idrogeno attraverso una reazione esotermica. Gli elementi chimici comprendono, oltre al gruppo dei metalli, anche quelli dei semimetalli e dei non metalli, da ciò deriva che mentre un metallo è sicuramente un elemento chimico, non tutti gli elementi chimici sono necessariamente metalli. Esistono vari tipi di metalli, scoperti in epoche distanti nel tempo. I primi metalli storicamente lavorati (il rame e lo stagno) hanno naturalmente una temperatura di fusione relativamente bassa, già ottenibile con gli antichi forni di circa 10.000 anni fa (epoca in cui, presumibilmente, iniziò la lavorazione del rame). Con l’espressione “materiale metallico” si fa riferimento invece ad un materiale che contiene metalli o leghe.
Leggi anche:
- Differenza tra atomo e elemento
- Differenza tra atomo e molecola con esempi
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra elemento chimico e composto
- Big Bang: singolarità, origine ed età dell’universo
- Età ed origine del mondo, della vita e dell’uomo sulla Terra
- Ci sono acqua, aria, vento e vita sulla Luna?
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Quanto pesa un litro di acqua liquida o di ghiacciata?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra miscela omogenea ed eterogenea
 In chimica si definisce “miscela” un insieme di sostanze diverse mescolate tra loro. A differenza dei composti, che si possono definire come sostanze elettricamente neutre costituite da due o più elementi diversi i cui atomi vi figurano in proporzioni definite, le miscele hanno una composizione variabile. Ad esempio, in un campione del composto acqua vi saranno sempre due atomi di H per ogni O, mentre lo zucchero e la sabbia si possono mescolare in qualsiasi proporzione. Allo stesso modo, mentre le proprietà dei composti sono diverse da quelle dei componenti, quelle delle miscele sono affini alle proprietà dei costituenti. Non di meno, mentre non è possibile separare i componenti di un composto con mezzi fisici, i costituenti di una miscela si possono separare con l’ausilio di tecniche fisiche.
In chimica si definisce “miscela” un insieme di sostanze diverse mescolate tra loro. A differenza dei composti, che si possono definire come sostanze elettricamente neutre costituite da due o più elementi diversi i cui atomi vi figurano in proporzioni definite, le miscele hanno una composizione variabile. Ad esempio, in un campione del composto acqua vi saranno sempre due atomi di H per ogni O, mentre lo zucchero e la sabbia si possono mescolare in qualsiasi proporzione. Allo stesso modo, mentre le proprietà dei composti sono diverse da quelle dei componenti, quelle delle miscele sono affini alle proprietà dei costituenti. Non di meno, mentre non è possibile separare i componenti di un composto con mezzi fisici, i costituenti di una miscela si possono separare con l’ausilio di tecniche fisiche.
Una miscela può essere eterogenea od omogenea:
- miscela eterogenea: è un tipo particolare di miscela in cui è possibile riconoscerne i vari componenti con un microscopio ottico, o anche ad occhio nudo. È il caso di molte rocce o del latte o dell’olio immerso nell’acqua, ad esempio;
- miscele omogenee o soluzioni: sono un tipo particolare di miscela in cui le molecole o gli ioni sono così intimamente mescolati tra loro tanto che la composizione risulta uniforme ovunque, per piccolo che possa essere il campione esaminato.
Leggi anche:
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra soluzione e dispersione in chimica con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra densità e viscosità di un fluido con esempi
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra organico inorganico
 I composti organici includono la quasi totalità dei composti del carbonio, i quali comprendono le molecole costitutive degli organismi viventi .
I composti organici includono la quasi totalità dei composti del carbonio, i quali comprendono le molecole costitutive degli organismi viventi .
I composti inorganici invece includono tutti i composti che non contengono carbonio nelle loro molecole (tranne il diossido di carbonio, o anidride carbonica, e pochi altri composti del carbonio). Molti composti inorganici sono necessari alla vita: tra questi occupa un posto particolare l’acqua (la maggior parte delle reazioni fondamentali per gli organismi viventi si svolge in soluzione acquosa).
Leggi anche:
- Differenza tra virus e batteri: chi è più pericoloso? Diagnosi, sintomi e terapia
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- Differenza tra cellula aploide e diploide con esempi
- Invasività microbica: la capacità di invadere l’organismo ospite
- Differenza tra invasività clinica e microbica
- Il virus più pericoloso del mondo è più vicino a te di quanto pensi
- Qual è il virus che ha ucciso più persone in assoluto?
- Qual è il virus più letale al mondo?
- Quante persone uccide ogni anno il virus HIV che causa l’AIDS?
- L’insospettabile influenza ogni anno uccide più persone dell’Ebola
- Il virus che uccide mezzo milione di bambini ogni anno
- Febbre gialla, dengue ed altre malattie trasmesse dalle zanzare
- Febbre dengue: sintomi, trasmissione, diagnosi, terapia e prevenzione
- Virus mortali: ecco gli 11 più pericolosi al mondo
- Sierotipo in microbiologia: significato ed importanza per i vaccini
- Differenza tra DNA ed RNA
- Differenza tra organismi autotrofi ed eterotrofi
- Differenza tra organismi prototrofi ed auxotrofi
- I 12 batteri più pericolosi per l’uomo
- Differenza tra microrganismi, batteri, virus, microbi e germi
- Differenza tra funghi, muffe e lieviti
- Differenza tra capside a simmetria icosaedrica, elicoidale e complessa
- Differenza tra unicellulare e pluricellulare con esempi
- Tubercolosi: trasmissione, sintomi, diagnosi e cure in sintesi
- Tubercolosi: cause e patogenesi della malattia
- Mycobacterium tuberculosis: il batterio che causa la tubercolosi
- Sintomi della tubercolosi polmonare ed extrapolmonare
- Come si trasmette la tubercolosi?
- Tubercolosi: diagnosi e progressione della malattia
- Test cutaneo della tubercolina: Test di Mantoux per la tubercolosi
- Trattamento farmacologico per la tubercolosi
- Trattamento della tubercolosi resistente ai farmaci
- Tubercolosi: prognosi, vaccino e strategie di prevenzione
- Riproduzione cellulare e ciclo cellulare
- Mitosi: spiegazione delle quattro fasi
- Meiosi: spiegazione di tutte tappe
- Differenza tra gene e allele
- Differenza tra allele dominante e recessivo
- Differenza tra omozigote ed eterozigote
- Differenza tra genotipo e fenotipo
- Quanti cromosomi hanno esseri umani, scimmie, cani, gatti e topi?
- Quanti cromosomi ha chi è affetto da Sindrome di Down?
- Cos’è un cromosoma ed a che serve?
- Cos’è un gene ed a che serve?
- Cosa sono gli alleli ed a che servono?
- Differenza tra cellule eucariote e procariote
- Differenza tra coronarografia ed angioplastica
- Differenza tra tumore benigno, maligno, neoplasia, cancro e metastasi
- HIV: sintomi iniziali in donne e uomini
- Differenza tra HIV e AIDS: sono uguali?
- Shock settico e sepsi: sintomi, terapia, conseguenze, si può guarire
- Differenza tra sepsi e Sindrome da risposta infiammatoria sistemica (SIRS)
- Meningite: contagio, sintomi, vaccino, gravità e profilassi
- Endocardite: cause, sintomi, diagnosi e terapie
- Differenza tra batteri Gram negativi e Gram positivi
- Differenza tra batteri bacilli, cocchi, streptococchi e spirilli
- Coprocoltura feci per salmonella: perché e come si fa
- Batteriemia: cura, segni, sintomi, diagnosi ed antibiotici
- I cinque segni cardinali dell’infiammazione
- Differenza tra infezione ed infiammazione: sono la stessa cosa?
- Differenza tra infiammazione cronica granulomatosa e non granulomatosa
- Differenza tra granulomi asettici (da corpo estraneo) e settici
- Si muore di AIDS? Qual è l’aspettativa di vita?
- Sistema immunitario, immunità innata e specifica: riassunto, schema e spiegazione
- Immunodeficienza primaria e secondaria: sintomi, cause e terapie
- Immunità innata (aspecifica): barriere, infiammazione e complemento
- Immunità innata (aspecifica): neutrofili, macrofagi e linfociti natural killer
- Immunità specifica (acquisita): linfociti, T killer, T helper, T γδ, B ed anticorpi
- Immunità specifica (acquisita): memoria passiva, attiva ed immunizzazione
- Immunità specifica (acquisita) umorale e cellulare
- Patologie del sistema immunitario: immunodeficienze, autoimmunità ed ipersensibilità
- Anticorpi: (immunoglobuline): tipi, caratteristiche e funzioni
- Dolore: cos’è, da cosa è causato, quanti tipi di dolore esistono?
- Differenza tra sintomo e segno con esempi
- Differenza tra malattia, sindrome e disturbo con esempi
- Differenza tra organismi aerobi obbligati e facoltativi con esempi
- Differenza tra organismi anaerobi obbligati, facoltativi, microaerofili ed aerotolleranti
- Com’è fatto il cuore, a che serve e come funziona?
- La mammografia: un esame rapido che può salvarti la vita
- Ecografia della tiroide: a cosa serve, come si svolge e come ci si prepara all’esame
- Differenza tra prevenzione primaria, secondaria e terziaria con esempi
- Capire se si ha un tumore: come viene diagnosticato un cancro
- La colonscopia: cos’è, quando si fa, che rischi comporta, come ci si prepara ad affrontarla
- L’ecografia transvaginale esplora gli organi genitali interni femminili
- Mineralometria Ossea Computerizzata (MOC), a cosa serve, come si interpretano i risultati?
- Differenza tra pressione arteriosa e venosa
- Differenza tra atri e ventricoli
- Valvole cardiache: cosa sono, quali sono ed a che
- Differenza tra pressione massima (sistolica), minima (diastolica) e differenziale
- Pressione arteriosa: valori normali e patologici
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure
- Perché la pressione arteriosa alta (ipertensione) è pericolosa?
- Ipertensione: cibi consigliati e da evitare per abbassare la pressione sanguigna
- Qual è la differenza tra arteria e vena?
- Che significa malattia terminale?
- Capire se si ha un tumore: come viene diagnosticato un cancro
- Quanto tempo mi rimane da vivere?
- Fattori di rischio cardiovascolare modificabili e non modificabili
- Cure palliative: cosa sono ed a che servono?
- Eccesso di colesterolo (ipercolesterolemia): perché è pericoloso?;
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure;
- Emoglobina glicata alta, valori normali, IFCC e diabete;
- L’obesità è una malattia;
- Differenza tra malattia acuta e cronica con esempi
- Che significa malattia cronica? Esempi di malattia cronica
- Differenza tra adenocarcinoma e carcinoma con esempi
- Differenza tra cancro e carcinoma con esempi
- Stomie: cosa sono, a che servono, quanti tipi esistono?
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Ipertrofia muscolare: cosa significa e come si raggiunge
- Cosa sono le metastasi? Tutti i tumori danno metastasi?
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Come prevenire i tumori ed il cancro? I 10 cambiamenti consigliati
- Differenza tra ipertrofia ed iperplasia con esempi
- Differenza tra iperplasia e neoplasia
- Un oggetto che tocchi 150 volte al giorno ha più batteri della tavoletta del wc. Di cosa si tratta e come difendersi
- Differenze tra ileostomia, colostomia e urostomia
- Differenza tra atrofia, distrofia ed aplasia con esempi
- Differenza tra organismi aerobi ed anaerobi con esempi
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra elemento chimico e composto
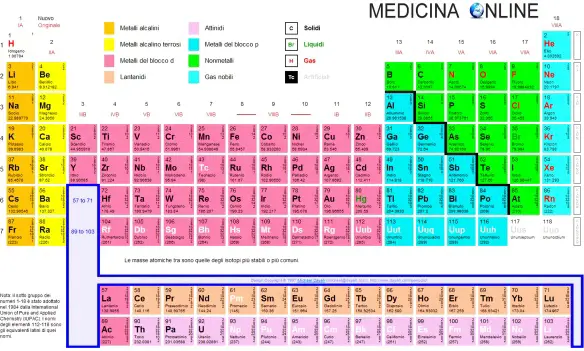
 Qual è la differenza tra elemento chimico e composto? La risposta più ovvia e immediata è che i primi formano i secondi. Ma vediamone nello specifico le caratteristiche. L’elemento chimico è una sostanza che non può essere scomposta in altre sostanze. Nell’elemento gli atomi hanno uguale numero e disposizione di elettroni, ma possono avere massa differente; quando ciò avviene si parla di isotopi e occupano il medesimo posto della tavola periodica.
Qual è la differenza tra elemento chimico e composto? La risposta più ovvia e immediata è che i primi formano i secondi. Ma vediamone nello specifico le caratteristiche. L’elemento chimico è una sostanza che non può essere scomposta in altre sostanze. Nell’elemento gli atomi hanno uguale numero e disposizione di elettroni, ma possono avere massa differente; quando ciò avviene si parla di isotopi e occupano il medesimo posto della tavola periodica.
Sono 96 gli elementi naturali presenti sulla Terra, 80 hanno almeno un isotopo stabile, e attualmente ne sono stati creati artificialmente in laboratorio altri 21 , per un totale di 118 elementi. Per ordinarli si utilizza la tavola periodica degli elementi, dove la classificazione avviene in base al numero atomico e al numero di elettroni presenti negli orbitali atomici s, p ed f. Nel 1870 il tedesco Julius Lothar Meyer pubblicò la versione estesa della sua tavola periodica elaborata precedentemente nel 1864.
Nel 1869, indipendentemente da Meyes, il professore chimico russo Dmitrij Mendeleev pubblicò la sua prima tavola periodica. In entrambi gli schemi gli elementi sono ordinati in righe e colonne, in peso atomico e si inizia una nuova riga o colonna quando le caratteristiche cominciano a ripetersi. Tuttavia tra le due venne adottata quella di Mendeleev poichè era più precisa: aveva infatti meno spazi vuoti e, in alcuni casi, il professore decise di ignorare l’ordine suggerito dai pesi atomici e scambiando elementi vicini per inserirli nella colonna con le stesse proprietà chimiche.
Il composto chimico è un sistema omogeneo formato da due o più elementi con un rapporto fisso che ne determina la composizione; ovvero è una sostanza pura costituita da atomi di natura diversa. Il rapporto fisso è determinato da specificità chimiche o fisiche. Ad esempio l’acqua (H2O, questa la sua formula), che è formata da due atomi di idrogeno e uno di ossigeno, è un composto, mentre ottone e cioccolata sono miscugli.
Infine la caratteristica principale del composto è rappresentata dalla sua formula chimica; in essa funziona come una carta d’identità: vi è descritto il rapporto del numero di atomi nella molecola, l’unità minima della sostanza. E’ possibile suddividere i composti chimici in singoli atomi o in composti più semplici attraverso processi ad alta temperatura detta temperatura di decomposizione.
Leggi anche:
- Differenza tra congelato e surgelato
- Differenza tra mito, fiaba e favola: esempi e caratteristiche
- Differenza tra bosco e foresta
- Differenza tra rischio e pericolo
- Differenza tra polpo e polipo in cucina ed in medicina
- Differenza tra pianura ed altopiano
- Differenza tra bassa ed alta pressione in meteorologia
- Differenza tra hotel e motel
- Differenza tra ostello e hotel
- Differenza tra ortogonale e perpendicolare
- Differenza tra glucosio e glicemia
- Differenza tra re ed imperatore
- Differenze tra l’inglese e l’americano
- Differenza tra ansia ed attacchi di panico
- Differenza tra mare ed oceano
- Differenza tra ostetrico e ginecologo in medicina
- Differenza tra surrene e rene
- Differenza tra rene policistico e multicistico
- Differenza tra rene destro e sinistro
- Differenza tra anuria e ritenzione urinaria
- Differenza tra anuria ed oliguria
- Differenza tra cellula aploide e diploide con esempi
- Differenza tra insufficienza e stenosi valvolare
- Differenza tra insufficienza cardiaca e scompenso
- Differenza tra nefrologo ed urologo: patologie specifiche e comuni
- Differenza tra osteopata e fisioterapista
- Differenze tra neurologo e psichiatra
- Differenza tra balcone e terrazzo
- Differenza tra carabinieri e polizia
- Differenza tra cc e ml
- Differenza tra ratto e topo
- Differenza tra popolo e popolazione
- Differenza tra agnello ed abbacchio
- Differenza tra DOC, DOP ed IGP in cucina
- Differenza tra iniezione e assunzione orale di un farmaco
- Differenza tra arma da fuoco ed arma da sparo con esempi
- Differenza tra arma automatica e semiautomatica con esempi
- Differenza tra morte assistita (suicidio assistito), eutanasia e testamento biologico
- Differenza tra prosciutto di Parma e San Daniele
- Differenza tra prosciutto e culatello
- Differenza tra prosciutto crudo e speck
- Differenza tra prosciutto cotto, crudo ed affumicato
- Differenza tra culatello e coppa
- Differenze tra merluzzo, nasello, baccalà o stoccafisso
- Differenza tra vino rosso, bianco e rosato
- Differenze tra noci ed arachidi: calorie ed idee in cucina
- Differenza tra pepe nero e peperoncino: proprietà, calorie ed idee in cucina
- Differenza tra pizza e piadina: calorie ed idee in cucina
- Differenza tre Parmigiano Reggiano e Pecorino Romano: calorie ed idee in cucina
- Differenze tra parmigiano e grana: colesterolo, valori nutrizionali e dieta
- Differenza tra morte clinica, biologica, legale, apparente, improvvisa ed istantanea
- Differenza tra morte corporale e secunda
- Differenza tra morte cerebrale, stato vegetativo e coma
- Differenza tra omicidio volontario, colposo e preterintenzionale
- Differenza tra domicilio, residenza e dimora
- Differenza tra inumazione, tumulazione, cremazione, imbalsamazione e mummificazione
- Differenza tra grassi animali e vegetali
- Differenza tra proteine animali e vegetali: quali sono le migliori?
- Differenza tra grassi ed oli con esempi
- Differenza grassi saturi, monoinsaturi e polinsaturi
- Differenza tra omega 3, omega 6 ed omega 9: quale integratore scegliere?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra elemento, composto e miscuglio con esempi
 Elemento chimico
Elemento chimico
L’elemento chimico è una sostanza che non può essere scomposta in altre sostanze. Nell’elemento gli atomi hanno uguale numero e disposizione di elettroni, ma possono avere massa differente; quando ciò avviene si parla di isotopi e occupano il medesimo posto della tavola periodica. Sono 96 gli elementi naturali presenti sulla Terra, 80 hanno almeno un isotopo stabile, e attualmente ne sono stati creati artificialmente in laboratorio altri 21 , per un totale di 118 elementi. Per ordinarli si utilizza la tavola periodica degli elementi, dove la classificazione avviene in base al numero atomico e al numero di elettroni presenti negli orbitali atomici s, p ed f. Nel 1870 il tedesco Julius Lothar Meyer pubblicò la versione estesa della sua tavola periodica elaborata precedentemente nel 1864. Nel 1869, indipendentemente da Meyes, il professore chimico russo Dmitrij Mendeleev pubblicò la sua prima tavola periodica. In entrambi gli schemi gli elementi sono ordinati in righe e colonne, in peso atomico e si inizia una nuova riga o colonna quando le caratteristiche cominciano a ripetersi. Tuttavia tra le due venne adottata quella di Mendeleev poiché era più precisa: aveva infatti meno spazi vuoti e, in alcuni casi, il professore decise di ignorare l’ordine suggerito dai pesi atomici e scambiando elementi vicini per inserirli nella colonna con le stesse proprietà chimiche.
Esempi di elemento chimico
- Idrogeno,
- elio,
- mercurio,
- alluminio,
- argento,
- carbonio,
- calcio,
- ferro,
- iodio,
- magnesio,
- azoto,
- radio,
- piombo
- sodio.
Composto chimico
Il composto chimico è un sistema omogeneo formato da due o più elementi con un rapporto fisso che ne determina la composizione; ovvero è una sostanza pura costituita da atomi di natura diversa. Il rapporto fisso è determinato da specificità chimiche o fisiche. Ad esempio l’acqua (H2O, questa la sua formula), che è formata da due atomi di idrogeno e uno di ossigeno, è un composto, mentre ottone e cioccolata sono miscugli.
Infine la caratteristica principale del composto è rappresentata dalla sua formula chimica; in essa funziona come una carta d’identità: vi è descritto il rapporto del numero di atomi nella molecola, l’unità minima della sostanza. E’ possibile suddividere i composti chimici in singoli atomi o in composti più semplici attraverso processi ad alta temperatura detta temperatura di decomposizione. Qual è la differenza tra elemento chimico e composto? La risposta più ovvia e immediata è che i primi formano i secondi.
Esempi di composto chimico
- acqua (H2O);
- cloruro di sodio (NaCl);
- ossigeno (O2);
- anidride carbonica (CO2)
- ammoniaca (NH3);
- metano (CH4);
- anidride nitrica (N2O5);
- anidride ipoclorosa (Cl2O);
- monossido di carbonio (CO).
Miscugli o miscele
I miscugli (o miscele) sono materiali formati dalla mescolanza di più sostanze pure e, a differenza di queste ultime, non presentano caratteristiche ben definite. Mentre la composizione degli elementi che formano il composto è fissa e ben determinata dalla natura, nei miscugli invece (sia miscugli omogenei che miscugli eterogenei) la composizione delle sostanze che lo formano non è fissa e determinata. Un miscuglio di acqua e sale presenta per esempio densità diverse a seconda della composizione della miscela. Osservando un corpo, spesso notiamo che esso è formato da sostanze di natura diversa (es. granito) e talvolta tale differenza esiste anche se il fatto non è evidente ai nostri occhi (es. acqua minerale). Ci troviamo di fronte, in questi casi, a una mescolanza di più sostanze, ciascuna delle quali mantiene la propria identità e può, in vario modo, essere separata dalle altre attraverso opportune tecniche di separazione. Mescolanze di questo tipo si chiamano miscugli.
Esempi di miscuglio
L’acqua minerale che beviamo è un esempio di miscuglio: essa contiene piccole quantità di altre sostanze disciolte che sono i sali minerali. La stessa cosa si può dire per tutti i prodotti chimici in uso nel laboratori. Sulle loro confezioni sono sempre riportati i risultati delle analisi che indicano anche la quantità di sostanze indesiderate. A seconda del modo in cui le sostanze si mescolano, i miscugli possono essere classificati in:
- miscugli omogenei;
- miscugli eterogenei.
Leggi anche:
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Differenza tra metafora, similitudine, paragone, allegoria e simbolo con esempi
- Differenza tra metafora, metonimia, sineddoche e personificazione con esempi
- I 5 migliori libri da regalare ad un nerd
- Differenza tra massa e peso in fisica ed in medicina
- Differenza tra monosaccaridi, disaccaridi, polisaccaridi, oligosaccaridi
- Differenza tra pentosi, esosi e triosi: cos’è il fruttosio?
- Differenza tra aldosi e chetosi con esempi
- Differenza tra zuccheri e carboidrati: sono la stessa cosa?
- Differenza tra zuccheri semplici e complessi con esempi
- Differenza tra zuccheri e grassi con esempi
- Differenza tra zuccheri di riserva e di struttura
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra miscuglio omogeneo ed eterogeneo con esempi
 I miscugli (o miscele) sono materiali formati dalla mescolanza di più sostanze pure e, a differenza di queste ultime, non presentano caratteristiche ben definite. A seconda del modo in cui le sostanze si mescolano, i miscugli possono essere classificati in:
I miscugli (o miscele) sono materiali formati dalla mescolanza di più sostanze pure e, a differenza di queste ultime, non presentano caratteristiche ben definite. A seconda del modo in cui le sostanze si mescolano, i miscugli possono essere classificati in:
- miscugli omogenei;
- miscugli eterogenei.
Miscugli omogenei
Un miscuglio è omogeneo quando le sostanze che lo compongono si mescolano in modo uniforme e non sono distinguibili neanche con l’ausilio di un microscopio. Sono formati da una sola fase. I miscugli omogenei hanno le proprietà chimico-fisiche identiche in ogni punto (come per esempio la densità, il punto di fusione, il punto di ebollizione, il colore, il sapore, etc.). Tali miscugli sono chiamati anche soluzioni. I misculi omogenei sono costituiti da un componente presente in maggior quantità chiamato solvente e da un componente (o più) presente in minor quantità chiamato soluto.
Esempi di miscugli omogenei
Sono esempi di miscugli omogenei: la benzina, l’acqua potabile, tutte le leghe metalliche (acciaio, bronzo, ottone, etc.), l’aria, tutte le miscele di gas. Come si può capire dagli esempi riportati i miscugli omogenei possono esistere in tutti e tre gli stati di aggregazione della materia. E’ possibile separare i componenti di un miscuglio eterogeneo mediante opportuni metodi di separazione.
Miscugli eterogenei
I miscugli eterogenei presentano caratteristiche chimico-fisiche diverse nei vari punti (come per esempio la densità, il punto di ebollizione, il colore, il sapore, la trasparenza, lo stato fisico, etc.). Ogni componente della miscela prende il nome di fase.
Esempi di miscugli eterogenei
Sono esempi di miscugli eterogenei: il granito, le rocce, miscela formata da limatura di ferro e polvere di zolfo, miscela formata da acqua e limatura di ferro, il latte, la vernice, le nuvole, il granito. Il latte è un classico esempio di miscuglio che apparentemente è omogeneo ma in realtà è eterogeneo. Osservandolo al microscopio infatti si nota che è formato da piccolissime particelle di grasso immerse in un liquido trasparente. Sono esempi di miscugli eterogenei anche:
- La nebbia, formata da minuscole goccioline di acqua disperse e sospese nell’aria.
- Le emulsioni, miscugli eterogenei tra due o più liquidi immiscibili che agitati vigorosamente si disperdono l’uno nell’altro. Un esempio di emulsione è la maionese ottenuta agitando olio e tuorlo d’uovo. Le emulsioni sono molto usate anche nei prodotti cosmetici: le creme per le mani e le creme solari per esempio, sono emulsioni di speciali oli in acqua.
- Il fumo, formato da particelle di un solido disperse in un gas. Per esempio, il fumo che esce dai camini è formato in maggioranza da particelle finissime di carbone disperse nell’aria.
- La schiuma, formata da un gas disperso in un liquido.
E’ possibile separare i componenti di un miscuglio eterogeneo mediante opportune tecniche di separazione.
Leggi anche:
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Differenza tra monosaccaridi, disaccaridi, polisaccaridi, oligosaccaridi
- Differenza tra pentosi, esosi e triosi: cos’è il fruttosio?
- Differenza tra aldosi e chetosi con esempi
- Differenza tra zuccheri e carboidrati: sono la stessa cosa?
- Differenza tra zuccheri semplici e complessi con esempi
- Differenza tra zuccheri e grassi con esempi
- Differenza tra zuccheri di riserva e di struttura
- Differenza tra metafora, similitudine, paragone, allegoria e simbolo con esempi
- Differenza tra metafora, metonimia, sineddoche e personificazione con esempi
- Differenza tra etica e morale
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra mito, fiaba e favola: esempi e caratteristiche
- Le 12 cose che ogni genitore fa di nascosto dai propri figli
- Differenza tra ateo e agnostico
- Differenza tra abbazia e monastero con esempi
- Differenza tra morte corporale e secunda
- I 5 migliori libri da regalare ad un nerd
- Differenza tra massa e peso in fisica ed in medicina
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Cosa significa idrofobo in italiano ed in chimica
 Nella lingua italiana comune la definizione del termine “idrofobo” è usato per:
Nella lingua italiana comune la definizione del termine “idrofobo” è usato per:
“una sostanza o sistema che presenta repellenza per l’acqua” ed è sinonimo di “idrorepellente”.
Con idrofobo si intende anche “affetto da idrofobia o da rabbia”: ad esempio un cane idrofobo, ma anche riferito a persona quando è molto adirata.
In chimica con il termine idrofobo si intende un composto o un gruppo funzionale che, a causa della sua struttura, non mostra alcuna affinità per l’acqua. Si tratta di composti o gruppi funzionali con una struttura poco o per nulla polarizzata che possono essere sciolti in un opportuno solvente organico ma che, come detto, non possono essere sciolti in acqua. Le sostanze idrofobe sono anche sostanze lipofile, in quanto una sostanza che non può essere sciolta in acqua può invece essere sciolta in un solvente oleoso.
Esempi di sostanze idrofobe
Sono sostanze idrofobe:
- esano C6H14;
- benzene C6H6;
- tetracloruro di carbonio CCl4;
- etere etilico C4H10O;
- solfuro di carbonio CS2;
- iodio I2;
- lipidi.
Leggi anche:
- Cosa significa idrofilo in italiano ed in chimica
- Differenza tra idrofobo ed idrofilo con esempi
- Differenza tra acidi e basi
- Differenza tra aldeidi, chetoni ed alcheni
- Differenza tra sinapsi elettrica e chimica
- Mitosi: spiegazione delle quattro fasi
- Sinapsi chimica ed elettrica: cosa sono ed a che servono?
- Differenza tra neuroni e nervi
- Qual è la differenza tra arteria e vena?
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
- Differenza tra assoni e dendriti
- Differenza tra cellule eucariote e procariote
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- Differenza tra cellula aploide e diploide con esempi
- Riproduzione cellulare e ciclo cellulare
- Meiosi: spiegazione di tutte tappe
- Differenza tra neuroni e gangli
- Barriera ematoencefalica: dove si trova, funzioni, quali sostanze la attraversano
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Dopammina: cos’è ed a che serve?
- Neurotrasmettitori: cosa sono ed a che servono
- Giunzione neuromuscolare (placca motrice) cos’è ed a che serve?
- Capacità massima dello stomaco: si può “mangiare fino a scoppiare”?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
