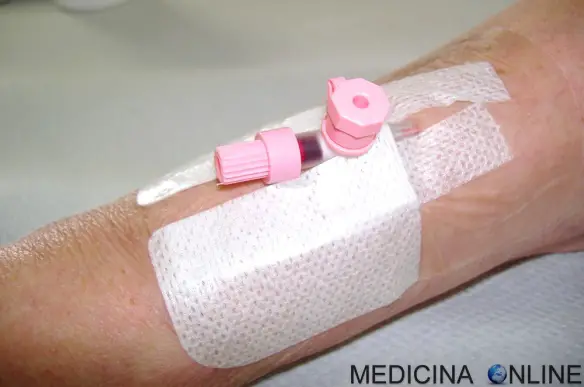
 Il catetere venoso periferico (CVP) è un presidio medico che si inserisce (incannulamento del”ago cannula) in una delle vene periferiche (cefalica, mediana, basilica, radiale, ulnare) o altre vene superficiali del corpo, se il braccio non è accessibile. I CVP comprendono cateteri a impianto periferico (PICC), cateteri non tunnellizzati, cateteri tunnellizzati, cateteri Continua a leggere
Il catetere venoso periferico (CVP) è un presidio medico che si inserisce (incannulamento del”ago cannula) in una delle vene periferiche (cefalica, mediana, basilica, radiale, ulnare) o altre vene superficiali del corpo, se il braccio non è accessibile. I CVP comprendono cateteri a impianto periferico (PICC), cateteri non tunnellizzati, cateteri tunnellizzati, cateteri Continua a leggere
Archivi tag: soluzione
Differenza tra soluzione ipertonica e ipotonica per aerosol e lavaggi nasali
 Quali sono le differenze tra soluzione ipotonica e soluzione ipertonica in medicina? La differenza principale consiste nella diversa concentrazione di sali presenti nel liquido, rispetto alla concentrazione di sali presenti naturalmente nelle cellule del nostro organismo e nei liquidi fisiologici umani, che è di 0,9%.
Quali sono le differenze tra soluzione ipotonica e soluzione ipertonica in medicina? La differenza principale consiste nella diversa concentrazione di sali presenti nel liquido, rispetto alla concentrazione di sali presenti naturalmente nelle cellule del nostro organismo e nei liquidi fisiologici umani, che è di 0,9%.
Ricordiamo che in chimica si possono distinguere tre tipi di soluzione, in base alla concentrazione di soluto:
- soluzioni isotoniche: sono due soluzioni con stessa concentrazione di soluto tra loro;
- soluzione ipertonica: è una soluzione con maggiore concentrazione di soluto rispetto ad un’altra soluzione;
- soluzione ipotonica: è una soluzione con minore concentrazione di soluto rispetto ad un’altra soluzione.
La soluzione ipertonica ha una concentrazione di sali superiore allo 0,9% (si attesta su 2,2-2,4 % ) quindi a quella delle nostre cellule. In genere questa soluzione viene consigliata dal medico per lavaggi nasali o irrigazioni in caso di raffreddore in bambini ed adulti: la soluzione ipertonica farà sì che, per osmosi, le cellule libereranno acqua che favorirà l’espulsione del muco accumulato all’interno delle mucose nasali. In altre parole quando questa soluzione più concentrata di sali entra in contatto con la mucosa nasale richiama per processo osmotico l’acqua che si trova in eccesso nella mucosa nasale e diluisce il muco rendendolo più fluido.
La soluzione ipotonica ha invece una concentrazione di sali inferiore allo 0,9%, quindi più bassa rispetto a quella delle nostre cellule.
La soluzione fisiologica classica, quella che usiamo spesso per l’aerosol, la flebo oppure per fare i lavaggi nasali è una soluzione che contiene lo 0,9% di sali, esattamente la stessa concentrazione delle cellule del nostro corpo, quindi è una soluzione isotonica.
Quale soluzione usare?
- E’ chiaro che per i lavaggi nasali quotidiani e anche per l’aerosol (per diluire il medicinale da nebulizzare), è consigliata la soluzione fisiologica (isotonica) che è efficace per rimuovere impurità, polvere e altri fattori inquinanti dal naso e favorire la decongestione;
- in caso di raffreddore è consigliata una soluzione ipertonica, che favorisce l’espulsione del muco dal naso.
La soluzione isotonica, o fisiologica, può essere usata tranquillamente e in tutta sicurezza, tramite irrigazioni nasali o docce nasali, anche sui neonati: il suo utilizzo serve, infatti, a pulire il naso e liberarlo laddove il bambino è troppo piccolo per sapersi soffiare il naso.
La soluzione ipertonica, che si trova in commercio in flaconcini spray o in flaconcini, può essere usata su adulti e bambini con più di tre anni, svolge un’azione decongestionante. In pratica basta spruzzare un po’ di soluzione ipertonica nel naso quando si è raffreddati per ottenere lo stesso effetto dei vasocostrittori, ma senza andare incontro ai medesimi effetti collaterali.
In genere le soluzioni ipertoniche sono realizzate con acqua osmotizzata e sodio, ma in altri casi sostengono acqua di mare che ne garantisce la giusta concentrazione di sali.
Leggi anche:
- Influenza 2017/2018: sintomi, virus, vaccino, quanto dura e rimedi
- Laringite, asma, sinusite, raffreddore: riduci i sintomi con i suffumigi
- Come fare un aerosol spiegato in modo semplice [GUIDA]
- Raffreddore: rimedi naturali e farmacologici
- Sangue dal naso (epistassi) in bambini e adulti: cause, rimedi naturali, cosa fare e cosa NON fare
- Differenza tra febbre, ipertermia e colpo di calore
- Differenza tra febbre, piressia, stato subfebbrile e febbricola
- Perché quando cambia il tempo fanno male ossa, cicatrici e testa
- Avete sempre freddo? Ecco la dieta che vi riscalda!
- Naso chiuso (congestione nasale): cause, rimedi naturali e farmaci
- Differenza tra febbre ed influenza
- Sinusite: cause, sintomi e cure di una malattia del freddo molto diffusa
- Cos’è l’influenza, chi rischia di “prenderla” e come comportarsi con i bambini?
- Perché si russa e quali sono i rimedi per smettere di russare? I pericoli dell’apnea ostruttiva del sonno
- Cambio di clima: prevenire e combattere gli effetti sulle articolazioni
- Perché quando piove le ferite fanno male?
- Geloni alle mani e ai piedi: sintomi e rimedi naturali
- Raffreddore: rimedi naturali e farmacologici
- I vari tipi di febbre
- Le fasi della febbre
- Differenze tra Paracetamolo, Tachipirina, Ibuprofene, Aspirina, Efferalgan e Co-Efferalgan
- Cosa succede ad una supposta dopo averla inserita? Come funziona?
- Meglio Aspirina o Ibuprofene?
- Broncoscopia polmonare con biopsia: a cosa serve, fa male, è pericolosa?
- Asma bronchiale in bambini e adulti: cause, sintomi e cura
- Perché ci viene la febbre e perché non dobbiamo aver paura di lei
- Come e quando abbassare la febbre? Farmaci e rimedi casalinghi
- Come e quando si misura la febbre?
- Differenza tra raffreddore e influenza: sintomi comuni e diversi
- Febbre alta: quando rivolgersi al medico
- Differenza tra febbre, ipertermia e colpo di calore
- Differenza tra febbre, piressia, stato subfebbrile e febbricola
- Febbre alta nei bambini e neonati: quali farmaci e cosa fare
- Perché viene la tosse e come faccio a farla passare?
- Sinusite: cause, sintomi e cure di una malattia del freddo molto diffusa
- Cos’è l’influenza, chi rischia di “prenderla” e come comportarsi con i bambini?
- Differenza tra acqua distillata e demineralizzata e loro usi
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
 Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
In chimica si possono distinguere tre tipi di soluzione, in base alla concentrazione di soluto:
- soluzioni isotoniche: sono due soluzioni con stessa concentrazione di soluto tra loro;
- soluzione ipertonica: è una soluzione con maggiore concentrazione di soluto rispetto ad un’altra soluzione;
- soluzione ipotonica: è una soluzione con minore concentrazione di soluto rispetto ad un’altra soluzione.
Passaggio di acqua da una soluzione all’altra
Il passaggio dell’acqua attraverso una membrana posta tra due ambienti (ad esempio cellula e spazio extracellulare), dipende dal tipo di ambiente ipertonico, ipotonico o isotonico:
- se la soluzione è isotonica rispetto alla cellula, ci sarà la medesima concentrazione di soluto da entrambe le parti venendosi a creare un equilibrio idrico;
- se la soluzione è ipertonica rispetto alla cellula, l’acqua si muoverà verso l’esterno della cellula che può essere danneggiata dalla disidratazione;
- se la soluzione è ipotonica rispetto alla cellula, l’acqua si muoverà verso l’interno della cellula che si rigonfia e può scoppiare (lisi cellulare).
Leggi anche:
- Differenza tra pressione idrostatica, oncotica ed osmotica
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
Per sopravvivere in un ambiante ipertonico o ipotonico la cellula deve quindi continuamente regolare l’equilibrio idrico, tramite l’osmoregolazione. Le cellule vegetali hanno una parete cellulare che limita il loro volume e ne definisce la forma.
Turgore : pressione interna alla cellula contro la parete cellulare che impedisce l’ingresso di altra acqua.
- se la soluzione è isotonica rispetto alla cellula vegetale, quest’ultima perde il proprio turgore;
- se la soluzione è ipertonica rispetto alla cellula vegetale perde acqua e raggrinzisce e la membrana si stacca dalla parete cellulare mediante un fenomeno detto plasmolisi;
- Se la soluzione è ipotonica rispetto alla cellula vegetale, la cellula è turgida.
Le proteine di trasporto consentono una diffusione facilitata, cioè permettono a una sostanza di attraversare la membrana secondo il gradiente di concentrazione. È un tipo di trasporto passivo, non richiede energia. La diffusione facilitata è utilizzata da zuccheri, amminoacidi, ioni e acqua. Le proteine di trasporto più comuni agiscono da canale per queste sostanze; la proteina da trasporto “ carrier” si lega al proprio passeggero, cambia forma e lo lascia all’altro lato della membrana. Le proteine di trasporto dette acquaporine rendono rapida la diffusione dell’acqua. La proteina di trasporto è specifica per la sostanza di cui facilita il passaggio; più proteine di trasporto ci sono, più rapida è la diffusione.
Leggi anche:
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra densità e viscosità di un fluido con esempi
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra soluzione e miscela in chimica con esempi
 Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità.
- Le soluzioni gassose (gas in gas) vengono normalmente dette miscele gassose.
- Le soluzioni solide (solido in solido) sono dette leghe.
- Le soluzioni liquide in cui un soluto si scioglie in un liquido (soluto in acqua) vengono dette soluzioni acquose.
Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
In chimica si definisce “miscela” un insieme di sostanze diverse mescolate tra loro. A differenza dei composti, che si possono definire come sostanze elettricamente neutre costituite da due o più elementi diversi i cui atomi vi figurano in proporzioni definite, le miscele hanno una composizione variabile. Ad esempio, in un campione del composto acqua vi saranno sempre due atomi di H per ogni O, mentre lo zucchero e la sabbia si possono mescolare in qualsiasi proporzione. Allo stesso modo, mentre le proprietà dei composti sono diverse da quelle dei componenti, quelle delle miscele sono affini alle proprietà dei costituenti. Non di meno, mentre non è possibile separare i componenti di un composto con mezzi fisici, i costituenti di una miscela si possono separare con l’ausilio di tecniche fisiche.
Una miscela può essere eterogenea od omogenea:
- miscela eterogenea: è un tipo particolare di miscela in cui è possibile riconoscerne i vari componenti con un microscopio ottico, o anche ad occhio nudo. È il caso di molte rocce o del latte, ad esempio;
- miscele omogenee (anche chiamate soluzioni): sono un tipo particolare di miscela in cui le molecole o gli ioni sono così intimamente mescolati tra loro tanto che la composizione risulta uniforme ovunque, per piccolo che possa essere il campione esaminato.
In altre parole la soluzione è quel tipo particolare si miscela in cui i due o più componenti sono mescolati in modo omogeneo, in modo che ogni volume di soluzione abbia la medesima composizione degli altri. Tutte le soluzioni sono quindi miscele, ma non tutte le miscele sono necessariamente soluzioni.
Leggi anche:
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra densità e viscosità di un fluido con esempi
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra soluzione e miscuglio in chimica con esempi
 Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità.
- Le soluzioni gassose (gas in gas) vengono normalmente dette miscele gassose.
- Le soluzioni solide (solido in solido) sono dette leghe.
- Le soluzioni liquide in cui un soluto si scioglie in un liquido (soluto in acqua) vengono dette soluzioni acquose.
Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
In chimica si definisce “miscuglio” un insieme di componenti chimici che si combinano tra di loro con rapporti costanti per mantenere particolari proprietà fisiche e chimiche. Un miscuglio può essere:
- omogeneo (o fisico) se i suoi componenti non sono più distinguibili all’osservazione diretta e si presenta in un’unica fase;
- eterogeneo (o meccanico) se è costituito da due o più fasi e i suoi componenti sono facilmente distinguibili.
Se ad esempio versate olio dentro un bicchiere d’acqua, vedi perfettamente che sia acqua che olio saranno distinti: questo è un tipico miscuglio eterogeneo costituito da due fasi, una fase è l’acqua e l’altra fase è l’olio.
Se invece osservate un bicchiere di vino, o di caffè, le parti che compongono la miscela sono perfettamente omogenee, ciò viene detto miscuglio omogeneo e viene chiamato comunemente soluzione. La soluzione è – più precisamente – un miscuglio omogeneo in cui una fase (il solvente) è in netta prevalenza sull’altra fase (il soluto). In altre parole: una soluzione è un tipo particolare di miscuglio omogeneo.
Leggi anche:
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra densità e viscosità di un fluido con esempi
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
- Differenza tra densità e peso specifico
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
Soluzione
Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche.
In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità.
- Le soluzioni gassose (gas in gas) vengono normalmente dette miscele gassose.
- Le soluzioni solide (solido in solido) sono dette leghe.
- Le soluzioni liquide in cui un soluto si scioglie in un liquido (soluto in acqua) vengono dette soluzioni acquose.
Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
Sospensione
Si definisce in chimica “sospensione” una miscela in cui un materiale finemente suddiviso è disperso in un altro materiale in modo tale da non sedimentare in tempo breve. Le sospensioni sono quindi costituite da due componenti:
- un componente minoritario che è allo stato solido ed è finemente disperso all’interno del componente maggioritario.
- un componente maggioritario che è allo stato liquido, che contiene il componente minoritario.
Differenza tra soluzione e sospensione
A differenza della soluzione, in cui le due parti si uniscono intimamente dando origine ad un liquido perfettamente trasparente, nella sospensione la miscela è opaca e torbida, a causa dell’effetto Tyndall, cioè quel particolare fenomeno di diffusione della luce dovuto alla presenza di particelle, di dimensioni comparabili a quelle delle lunghezze d’onda della luce incidente, presenti in sistemi colloidali, nelle sospensioni o nelle emulsioni.
Semplificando: nelle sospensioni il soluto è fisicamente distinguibile dal liquido, mentre nelle sospensioni il soluto ed il solvente sono omogenee e macroscopicamente indistinguibili. In altre parole: nella sospensione il soluto si può riconoscere nel solvente. nella soluzione invece no.
Aerosol ed emulsione
Come abbiamo visto, una sospensione è composta da un solido finemente disperso all’interno del componente maggioritario liquido. Se la sospensione è invece composta da gocce di liquido o da particelle solide disperse in un gas, la sospensione prende il nome di aerosol. Se la sospensione è composta da sostanze lipofile disperse in sostanze idrofile o viceversa, prende invece il nome di emulsione.
Leggi anche:
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra densità e viscosità di un fluido con esempi
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra soluzione e dispersione in chimica con esempi
 Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche. In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità. Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche. In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità. Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
In chimica si definisce con “dispersione” un sistema stabile o instabile costituito da più fasi (di solito due) in cui la prevalente è detta “fase disperdente” e le altre sono dette “fasi disperse”. Caratteristica delle dispersioni è che le varie fasi sono eterogenee e che le fasi disperse hanno dimensioni superiori alle grandezze colloidali (diametro > 1 μm).
In una soluzione i soluti sono quindi disciolti nel solvente nello stesso stato fisico. Una soluzione, dunque, è un sistema omogeneo. Una dispersione, invece, è un sistema eterogeneo, in cui i “soluti” sono appunto “dispersi” nel “solvente”. Un esempio di dispersione è il fumo infatti consiste in una dispersione di un solido in un aeriforme, oppure la nebbia (dispersione di un liquido in un aeriforme).
Una soluzione consiste in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica.
Leggi anche:
- Differenza tra densità e viscosità di un fluido con esempi
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra densità e concentrazione
 La densità di un materiale è il rapporto tra la sua massa ed il suo volume (cioè d = m/ V); l’unità di misura della densità è il kg/m³. Nell’uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Il materiale in esame può essere sia un liquido che un solido o un gas.
La densità di un materiale è il rapporto tra la sua massa ed il suo volume (cioè d = m/ V); l’unità di misura della densità è il kg/m³. Nell’uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Il materiale in esame può essere sia un liquido che un solido o un gas.
La concentrazione di un componente in una miscela è una grandezza che esprime invece il rapporto tra la quantità del componente rispetto alla quantità totale di tutti i componenti della miscela (compreso il suddetto componente). Nel caso specifico di una soluzione, la concentrazione di un determinato soluto nella soluzione esprime il rapporto tra la quantità del soluto rispetto alla quantità totale di soluzione, o, in alcuni modi di esprimerla, del solo solvente (ad esempio molalità).
- la densità si calcola con : d = massa / volume;
- la concentrazione : [ c ] = n° di moli/ volume oppure n° di moli/ massa.
Densità in soluzione
La densità in soluzione pi indica il rapporto tra la massa del soluto mi rispetto al volume V dell’intera soluzione:
pi = mi / V
La densità in soluzione si esprime in kg/m3 (pari a g/L).
Leggi anche:
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità e viscosità di un fluido con esempi
- Differenza tra densità relativa ed assoluta
- Differenza tra densità reale ed assoluta con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra fluido e liquido
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- Differenza tra pressione idrostatica, oncotica ed osmotica
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
