 L’acidosi metabolica è la tendenza alla riduzione del pH ematico, diminuzione dell’HCO3–(bicarbonato) plasmatico e presenza di iperventilazione Continua a leggere
L’acidosi metabolica è la tendenza alla riduzione del pH ematico, diminuzione dell’HCO3–(bicarbonato) plasmatico e presenza di iperventilazione Continua a leggere
Archivi tag: basico
Alterazioni dell’equilibrio acido-base: acidosi ed alcalosi respiratorie e metabolica
 Il pH del sangue arterioso è mantenuto nei limiti normali (7,38-7,42; cioè 7,40 ± 0,02) dal concorso di sistemi tampone. Il più importante tra essi è il sistema bicarbonati-acido carbonico, il cui rapporto è di 20:1. Il mantenimento di tale rapporto dipende in massima parte dalla ventilazione polmonare, la quale regola la tensione di Continua a leggere
Il pH del sangue arterioso è mantenuto nei limiti normali (7,38-7,42; cioè 7,40 ± 0,02) dal concorso di sistemi tampone. Il più importante tra essi è il sistema bicarbonati-acido carbonico, il cui rapporto è di 20:1. Il mantenimento di tale rapporto dipende in massima parte dalla ventilazione polmonare, la quale regola la tensione di Continua a leggere
Differenza tra acidi e basi
 Secondo la teoria di Brønsted-Lowry, un acido è una sostanza capace di cedere ioni H+ a un’altra specie chimica detta base, una base è invece una sostanza capace di acquisire ioni H+ da un’altra specie chimica, detta acido.
Secondo la teoria di Brønsted-Lowry, un acido è una sostanza capace di cedere ioni H+ a un’altra specie chimica detta base, una base è invece una sostanza capace di acquisire ioni H+ da un’altra specie chimica, detta acido.
Secondo la teoria di Lewis, un acido è una sostanza capace di accettare un doppietto elettronico da un’altra specie chimica capace di donarli detta base; una base è invece una sostanza capace di donare un doppietto elettronico a un’altra specie chimica detta acido.
Gli acidi e le basi appartengono a due classi di composti chimici che presentano alcune proprietà completamente opposte.
Gli acidi:
- hanno un sapore prevalentemente aspro;
- conferiscono alle cartine al tornasole una colorazione rossa;
- a contatto con quasi tutti i metalli reagiscono liberando idrogeno allo stato gassoso.
le basi:
- hanno sapore amaro;
- danno al tornasole una colorazione blu;
- sono viscide al tatto.
Le reazioni acido-base sono quelle reazioni chimiche in cui un protone (ione H+) passa da una specie chimica ad un’altra. Fra queste le più comuni, in soluzione acquosa, sono quelle di neutralizzazione. Mescolando soluzioni acquose di un acido e di una base, si sviluppa questo tipo di reazione, che ha la caratteristica di procedere rapidamente producendo un sale e acqua. Ad esempio se facciamo reagire insieme l’acido cloridrico e l’idrossido di sodio avremo una tipica reazione di neutralizzazione:
HCl + NaOH ⇄ H2O + NaCl
Acido cloridrico + idrossido di sodio ⇄ acqua + cloruro di sodio
Misura della forza di un acido ed una base
La forza di un acido o di una base può essere analizzata attraverso la misura della concentrazione degli ioni H3O+ e OH-, che saranno stati prodotti in soluzioni acquose rispettivamente acide o basiche per cessione o sottrazione di protoni. Sulla base di questo criterio, sono state ideate due scale, note come pH e pOH, i cui valori corrispondono rispettivamente al logaritmo, cambiato di segno, della concentrazione dello ione ossonio e dello ione idrossido in soluzione acquosa:
pH = -log [H3O+]
pOH = -log [OH-]
All’acqua pura corrisponde pH uguale a 7,0; l’aggiunta di un acido produce un aumento della concentrazione dello ione ossonio [H3O+] e una conseguente riduzione del valore del pH che fornisce una misura della forza dell’acido in analisi.
Leggi anche:
- Cosa significa idrofilo in italiano ed in chimica
- Cosa significa idrofobo in italiano ed in chimica
- Differenza tra idrofobo ed idrofilo con esempi
- Differenza tra aldeidi, chetoni ed alcheni
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità e viscosità di un fluido con esempi
- Differenza tra densità relativa ed assoluta
- Differenza tra densità e concentrazione
- Differenza tra sinapsi elettrica e chimica
- Mitosi: spiegazione delle quattro fasi
- Sinapsi chimica ed elettrica: cosa sono ed a che servono?
- Differenza tra neuroni e nervi
- Qual è la differenza tra arteria e vena?
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
- Differenza tra assoni e dendriti
- Differenza tra cellule eucariote e procariote
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- Differenza tra cellula aploide e diploide con esempi
- Riproduzione cellulare e ciclo cellulare
- Meiosi: spiegazione di tutte tappe
- Differenza tra neuroni e gangli
- Barriera ematoencefalica: dove si trova, funzioni, quali sostanze la attraversano
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Dopammina: cos’è ed a che serve?
- Neurotrasmettitori: cosa sono ed a che servono
- Giunzione neuromuscolare (placca motrice) cos’è ed a che serve?
- Capacità massima dello stomaco: si può “mangiare fino a scoppiare”?
- Differenza tra acidosi ed alcalosi, metabolica e respiratoria
- Differenza tra polipnea e tachipnea
- Respiro patologico: le alterazioni del ritmo respiratorio normale
- Respiro di Biot ed apnee: caratteristiche e cause patologiche e non patologiche
- Respiro di Cheyne-Stokes: caratteristiche e cause patologiche e non patologiche
- Respiro di Kussmaul: caratteristiche e cause
- Respiro di Falstaff: caratteristiche e cause
- Differenza tra monosaccaridi, disaccaridi, polisaccaridi, oligosaccaridi
- Differenza tra pentosi, esosi e triosi: cos’è il fruttosio?
- Differenza tra aldosi e chetosi con esempi
- Differenza tra zuccheri e carboidrati: sono la stessa cosa?
- Differenza tra zuccheri semplici e complessi con esempi
- Differenza tra zuccheri e grassi con esempi
- Differenza tra zuccheri di riserva e di struttura
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra acidosi ed alcalosi, metabolica e respiratoria
 Con i termini “acidosi” ed “alcalosi”, in fisiologia e patologia, si intende una condizione caratterizzata dall’alterazione del pH del plasma sanguigno, dovuto ad un eccesso di acidità o di basicità.
Con i termini “acidosi” ed “alcalosi”, in fisiologia e patologia, si intende una condizione caratterizzata dall’alterazione del pH del plasma sanguigno, dovuto ad un eccesso di acidità o di basicità.
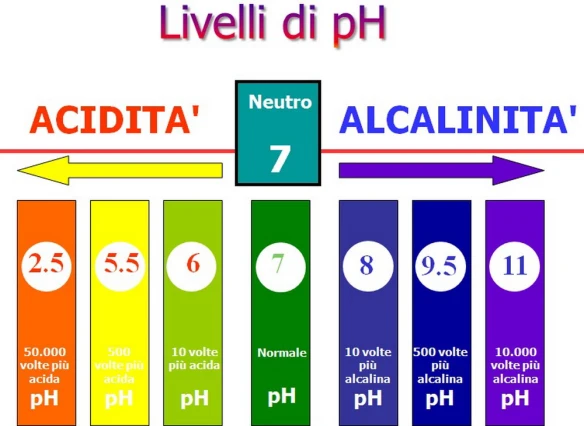
In condizioni normali il pH del sangue del nostro corpo si mantiene entro un ristretto intervallo compreso tra 7.35 e 7.45 per assicurare il funzionamento appropriato dei processi metabolici ed il rilascio del giusto quantitativo di ossigeno ai tessuti. Detto questo, quando il valore del pH è alterato, si possono verificare due situazioni:
- acidosi: consiste in una diminuzione del pH al di sotto del valore di 7.35 (acidemia);
- alcalosi: consiste in un’eccessiva basicità del sangue che provoca l’aumento del pH sopra a 7.45.
Alcuni autori preferiscono indicare con il termine “acidemia” questa condizione e con “acidosi” ogni condizione che tenda ad aggiungere acidi o a rimuovere basi dai fluidi corporei, anche in presenza di un pH ancora normale. In teoria il termine “acidosi” potrebbe essere riferito a qualsiasi liquido corporeo extracellulare; per convenzione – però – accademicamente si applica questo termine al plasma, ritenendolo rappresentativo dell’acqua corporea.
Le cause che possono determinare queste due condizioni sono estremamente varie. Molti disturbi e patologie possono infatti interferire col controllo del pH nell’organismo e far sì che il pH del sangue esca dai limiti di normalità, come ad esempio alcuni tipi di febbre, le encefaliti, le neoplasie, alcuni tipi di alimentazione, traumi, patologie polmonari, gravidanza, farmaci, nevrosi e patologie della tiroide.
Leggi anche:
- Com’è fatto il cuore, a che serve e come funziona?
- Qual è la differenza tra arteria e vena?
- Differenza tra pressione arteriosa e venosa
- Differenza tra pressione massima (sistolica), minima (diastolica) e differenziale
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure
Respiratoria e metabolica
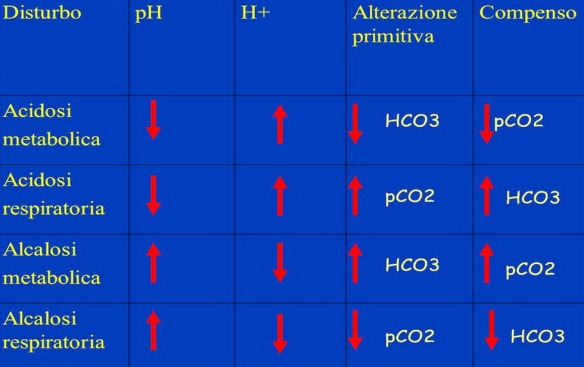
Sia l’acidosi che l’alcalosi possono essere classificate in “respiratoria” e “metabolica” in base alla concentrazione plasmatica di bicarbonato e di anidride carbonica, che valutate insieme forniscono un’indicazione di massima sui principali apparati coinvolti.
In sintesi si parla di:
- acidosi respiratoria quando la riduzione (o la tendenza alla riduzione) del pH del plasma corporeo è legata ad un aumento della anidride carbonica (CO2) disciolta nel sangue;
- acidosi metabolica quando la riduzione (o la tendenza alla riduzione) del pH del plasma corporeo è dovuta ad un accumulo di acidi o da una riduzione dei bicarbonati;
e di:
- alcalosi respiratoria quando l’aumento (o la tendenza all’aumento) del pH del plasma corporeo è causato da diminuzione dell’anidride carbonica (CO2) disciolta nel sangue;
- alcalosi metabolica quando l’aumento (o la tendenza all’aumento) del pH del plasma corporeo è causato da una perdita di acidi o da un accumulo di bicarbonati.
Leggi anche:
- Omeostasi in biologia e fisiologia: significato ed esempi
- Feedback positivo ed omeostasi: spiegazione ed esempi
- Feedback negativo ed omeostasi: spiegazione ed esempi
- Differenza tra feedback positivo e negativo con esempi
Gap anionico
Il calcolo del gap anionico è spesso utile nella diagnosi differenziale dell’acidosi metabolica. Il gap anionico viene calcolato sottraendo la somma delle concentrazioni del Cl– e del HCO3– alla concentrazione plasmatica del Na; un aumento del gap anionico rivela la presenza di un eccesso di equivalenti acidi, acidosi metabolica. Quando è presente un’acidosi metabolica con gap anionico normale, si deve sospettare un’alterazione dell’escrezione renale dello ione H+.
Leggi anche:
- Alterazioni dell’equilibrio acido-base: acidosi ed alcalosi respiratorie e metabolica
- Differenza tra acidosi metabolica con gap anionico normale e aumentato
- Iperventilazione: significato, sintomi, alcalosi e conseguenze
- Saturazione dell’ossigeno: valori normali e patologici in anziani e bambini
- Emogasanalisi arterioso: procedura, interpretazione, è dolorosa?
- Differenza tra ipossiemia e ipercapnia
- Differenza tra ipossiemia, ipossia, anossiemia ed anossia
- Ipossiemia: significato, valori, sintomi, conseguenze, rischi, cure
- Ipossia: valori, conseguenze, sintomi, cure
- Ipercapnia: valori, terapia, conseguenze e trattamento
- Anossia: definizione, cause, sintomi, sinonimo, cure
- Ipocapnia: significato, cause, valori, alcalosi respiratoria
- Ossigenoterapia: uso, controindicazioni, domiciliare, con maschera
- Differenza tra dispnea, apnea e tachipnea
- Differenza tra polipnea e tachipnea
- Gabbia toracica: dove si trova, a che serve e da cosa è composta
- Apnea ostruttiva del sonno: cause, rischi, trattamenti e prevenzione
- Perché si russa e quali sono i rimedi per smettere di russare? I pericoli dell’apnea ostruttiva del sonno
- Differenza apnea statica, dinamica e profonda
- Differenze tra respiro normale e patologico
- Respiro patologico: le alterazioni del ritmo respiratorio normale
- Differenza tra aterosclerosi e arteriosclerosi
- Differenza tra trombo, embolo, coagulo, embolia e trombosi
- Differenza tra arterie, vene, capillari, arteriole e venule
- Differenza tra arteriola afferente ed efferente: struttura e funzioni
- Differenza tra edema infiammatorio, non infiammatorio, essudato, trasudato, idropisìa e idrope
- Cos’è l’Idropisìa?
- Idrope: cause, tipi e terapia
- Cos’è l’edema, come e perché si forma?
- Differenza tra edema localizzato, generalizzato e sistemico
- Shock settico e sepsi: sintomi, terapia, conseguenze, si può guarire
- Differenza tra sepsi e Sindrome da risposta infiammatoria sistemica (SIRS)
- Meningite: contagio, sintomi, vaccino, gravità e profilassi
- Endocardite: cause, sintomi, diagnosi e terapie
- Differenza tra batteri Gram negativi e Gram positivi
- Differenza tra batteri bacilli, cocchi, streptococchi e spirilli
- Triade di Virchow: i tre fattori di rischio per la trombosi
- Chetosi: cos’è, da cosa è causata, sintomi e terapia in adulti e bambini
- Coagulazione intravascolare disseminata: cause e trattamenti
- Sepsi: cause, sintomi, diagnosi e terapie
- Differenza tra sepsi e setticemia
- Sindrome da disfunzione multiorgano: cause, sintomi, stadi e cure
- Coprocoltura feci per salmonella: perché e come si fa
- Batteriemia: cura, segni, sintomi, diagnosi ed antibiotici
- I cinque segni cardinali dell’infiammazione
- Differenza tra infezione ed infiammazione: sono la stessa cosa?
- Infiammazione: le alterazioni dei vasi sanguigni, permeabilità vascolare e migrazione leucocitaria
- Differenza tra infezione acuta e cronica
- Morte cellulare: differenza tra necrosi, apoptosi ed autofagia
- Infestazione: cos’è, da cosa è causata, come si cura
- Differenza tra infezione ed infestazione
- Differenza tra infestazione interna ed esterna
- Differenza tra infiammazione cronica granulomatosa e non granulomatosa
- Differenza tra granulomi asettici (da corpo estraneo) e settici
- Linfonodi: cosa sono, come riconoscerli, quando sono pericolosi
- Linfonodo sentinella: cos’è e perché è importante in caso di cancro
- Biopsia del linfonodo sentinella: a che serve, perché è importante
- Sistema linfatico e linfonodi: anatomia e funzioni in sintesi
- Differenza tra cisti e linfonodo
- Differenza tra cisti, pseudocisti, ascesso ed empiema
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
