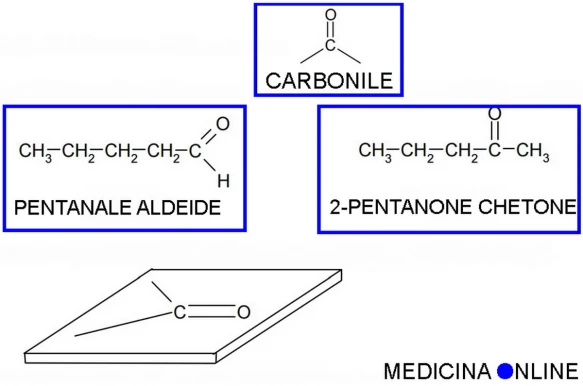
 Sia le aldeidi (aventi formula generale RCHO) che i chetoni (aventi formula generale RCOR) sono composti organici caratterizzati dalla presenza di un gruppo funzionale caratteristico, il CARBONILE:
Sia le aldeidi (aventi formula generale RCHO) che i chetoni (aventi formula generale RCOR) sono composti organici caratterizzati dalla presenza di un gruppo funzionale caratteristico, il CARBONILE:
>C=O
Il carbonile ha una struttura planare perché ha al centro un carbonio con ibridazione sp2. Nel carbonile il carbonio è parzialmente positivo sia per effetto induttivo, a causa dell’elettronegatività dell’ossigeno, sia per risonanza.
La prima differenza sostanziale tra aldeidi e chetoni è che il gruppo carbonile nelle aldeidi si trova in posizione terminale, mentre invece nei chetoni si trova all’interno della catena (vedi figura in alto).
Gli alcheni sono idrocarburi (cioè composti organici costituiti solamente da atomi di carbonio e idrogeno) aciclici contenenti esattamente un doppio legame C=C. Gli alcheni fanno parte della classe delle olefine, alla quale appartengono anche i cicloalcheni e i polieni; hanno formula bruta CnH2n. Il più semplice alchene esistente è l’etilene (o etene), avente formula CH2=CH2, dal quale si ottiene il polietilene attraverso polimerizzazione per addizione. Rispetto agli alcheni che presentano un doppio legame carbonio-carbonio, le aldeidi e i chetoni hanno un maggior momento dipolare D a causa della differenza di elettronegatività tra il carbonio e l’ossigeno.
Le aldeidi e i chetoni hanno quindi punti di ebollizione maggiori rispetto ad alcheni ramificati di peso molecolare paragonabile. La temperatura di ebollizione è influenzata dalla forza dei legami intermolecolari quali le forze di dispersione di van der Waals che sono maggiori quando la molecola è lineare e ha molti elettroni in quanto aumenta la grandezza dei dipoli temporanei presenti. Per tale motivo le temperature di ebollizione aumentano all’aumentare dei numero di atomi di carbonio presenti nella catena a prescindere dal fatto che si tratti di un’aldeide o di un chetone. Oltre alle forze di dispersione, a causa della presenza di un dipolo permanente, si instaurano anche attrazioni tra i dipoli e le molecole vicine con un’attrazione dipolo-dipolo. Le aldeidi e i chetoni hanno temperatura di ebollizione minore degli alcoli che formano anche legami a ponte di idrogeno.
Inoltre la presenza dei doppietti elettronici solitari presenti sull’ossigeno rende le aldeidi e i chetoni accettori di ioni H+ e quindi la loro solubilità in acqua è maggiore rispetto agli idrocarburi. Si riportano in tabella alcuni composti quali alcheni, aldeidi e chetoni onde poterne confrontare le caratteristiche fisiche:
|
Composto |
Peso molecolare |
Temperatura di ebollizione |
Solubilità in acqua |
|
2-metilpropene (CH3)2C=CH2 |
56 |
– 7.0 °C |
0.04 g/100 g |
|
Propanone (CH3)2C=O |
58 |
+ 56.5 °C |
Miscibile in tutte le proporzioni |
|
1-pentene CH3CH2CH2CH=CH2 |
70 |
+ 30.0 °C |
0.03 g/100 g |
|
Butanale CH3CH2CH2CHO |
72 |
+ 76.0 °C |
7 g /100 g |
|
Metilencicloesano C6H10=CH2 |
96 |
+ 103.0 °C |
insolubile |
|
Cicloesanone C6H10=O |
98 |
+ 155.6 °C |
5 g/100 g |
Addizione di acqua
La reazione tipica di aldeidi e chetoni è l’addizione nucleofila al carbonile. Questa può essere meglio compresa esaminando con attenzione il caso più elementare, l’addizione di acqua. L’addizione nucleofila al carbonile è influenzata sia da fattori elettronici che sterici. I fattori elettronici (donazioni di elettroni) influenzano la stabilità del doppio legame carbonio-ossigeno e la quantità di carica positiva presente sul carbonio del carbonile. I fattori sterici (ingombro sterico) condizionano soprattutto la stabilità del prodotto finale nel quale i sostituenti sono più vicini tra loro visto che il carbonio del carbonile da sp2 (120°) diventa sp3 (109°).
La polarità del gruppo carbonilico hae effetti sulla reattività delle aldeidi e dei chetoni rispetto a composti apolari che contengono un doppio legame: infatti mentre l’addizione di acqua al gruppo carbonilico è veloce, l’analoga reazione per gli alcheni è lentissima in assenza di un catalizzatore acido nonostante che l’aspetto termodinamico sia di senso opposto.
Il doppio legame degli alcheni ha un’energia di legame di 146 kcal/mol. Poiché il legame σ carbonio-carbonio ha un’energia di 83 kcal/mol si può ritenere che l’energia del legame π sia di 63 kcal/mol minore rispetto alla precedente; d’altra parte l’energia di legame del gruppo carbonilico varia a seconda del suo intorno come segue:
- H2C=O 170 kcal/mol
- RCH=O 175 kcal/mol
- R2C=O 180 kcal/mol
Poiché il legame σ tra carbonio e ossigeno è di 86 kcal/mol, ad eccezione della formaldeide il gruppo carbonilico di aldeidi e chetoni ha un legame π con energia maggiore rispetto al legame σ. Tale fenomeno suggerisce che le reazioni di addizione al gruppo carbonilico sono termodinamicamente sfavorite come nel caso dell’addizione di acqua.
Sebbene l’addizione di acqua ad un alchene è esotermica e dà, un alcol quale prodotto di reazione che è una specie stabile la reazione è estremamente lenta in assenza di catalizzatore a causa dell’alta energia di attivazione. La disidratazione di un alcol ad alchene che costituisce la reazione inversa rispetto alla precedente è comunque lenta e quindi entrambe le reazioni possono avvenire solo in presenza di un acido forte. Viceversa sia la reazione endotermica di acqua al gruppo carbonilico che l’eliminazione esotermica dell’acqua dal diolo geminale risultano veloci. La polarità del gruppo carbonilico abbassa quindi l’energia dello stato di transizione per entrambe le reazioni con un conseguente aumento della velocità.
Leggi anche:
- Cosa significa idrofilo in italiano ed in chimica
- Cosa significa idrofobo in italiano ed in chimica
- Differenza tra idrofobo ed idrofilo con esempi
- Differenza tra acidi e basi
- Differenza tra sinapsi elettrica e chimica
- Mitosi: spiegazione delle quattro fasi
- Sinapsi chimica ed elettrica: cosa sono ed a che servono?
- Differenza tra neuroni e nervi
- Qual è la differenza tra arteria e vena?
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
- Differenza tra assoni e dendriti
- Differenza tra cellule eucariote e procariote
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- Differenza tra cellula aploide e diploide con esempi
- Riproduzione cellulare e ciclo cellulare
- Meiosi: spiegazione di tutte tappe
- Differenza tra neuroni e gangli
- Barriera ematoencefalica: dove si trova, funzioni, quali sostanze la attraversano
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Dopammina: cos’è ed a che serve?
- Neurotrasmettitori: cosa sono ed a che servono
- Giunzione neuromuscolare (placca motrice) cos’è ed a che serve?
- Capacità massima dello stomaco: si può “mangiare fino a scoppiare”?
- Differenza tra monosaccaridi, disaccaridi, polisaccaridi, oligosaccaridi
- Differenza tra pentosi, esosi e triosi: cos’è il fruttosio?
- Differenza tra aldosi e chetosi con esempi
- Differenza tra zuccheri e carboidrati: sono la stessa cosa?
- Differenza tra zuccheri semplici e complessi con esempi
- Differenza tra zuccheri e grassi con esempi
- Differenza tra zuccheri di riserva e di struttura
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
