 Diversi test di screening neuropsicologico vengono utilizzati per la diagnostica nei casi di Alzheimer. I test valutano diverse funzioni e competenze cognitive, come il saper copiare disegni simili a quelli mostrati nella foto, ricordare parole, leggere e sottrarre numeri in serie.
Diversi test di screening neuropsicologico vengono utilizzati per la diagnostica nei casi di Alzheimer. I test valutano diverse funzioni e competenze cognitive, come il saper copiare disegni simili a quelli mostrati nella foto, ricordare parole, leggere e sottrarre numeri in serie.
Leggi anche:
- Morbo di Parkinson: cause, sintomi, decorso, terapie
- Morbo di Alzheimer: cause, sintomi, decorso, terapie
- Demenza senile: cause, sintomi, decorso e cure
- Morbo di Alzheimer: sintomi delle fasi iniziali e tardive
- Morbo di Alzheimer: le cause della malattia
- Intervento psicosociale e cognitivo nel paziente con morbo di Alzheimer
- Morbo di Alzheimer: cura farmacologica
Test neuropsicologici come il Mini Mental State Examination (MMSE), sono ampiamente utilizzati per valutare i disturbi cognitivi che vengono considerati per la formulazione della diagnosi. Una batteria di test più completa è necessaria per garantire la massima affidabilità dei risultati, in particolare nelle prime fasi della malattia. L’esame neurologico nelle prime fasi della malattia solitamente presenta risultati normali, fatta eccezione per evidenti deficit cognitivi che non differiscono però da quello derivanti da altre malattie di tipo demenziale.
Ulteriori esami neurologici sono cruciali nella diagnosi differenziale di Alzheimer dalle altre malattie. Colloqui con gli altri membri della famiglia sono inoltre utilizzate nella valutazione funzionale della malattia. I caregiver possono, infatti, fornire importanti informazioni sulla capacità di vita quotidiana, così come la diminuzione, nel tempo, della funzione mentale della persona. Il punto di vista di chi assiste il malato è particolarmente importante, dato che una persona con Alzheimer è spesso inconsapevole del suo deficit. A volte le famiglie hanno difficoltà nella rilevazione esatta dei primi sintomi di demenza nelle sue fasi iniziali, e per questo non riescono sempre a comunicare informazioni accurate al medico.
Un altro indicatore oggettivo delle prime fasi della malattia è l’analisi del liquido cerebrospinale per la ricerca di beta-amiloide o di proteine tau. La ricerca di queste proteine è in grado di prevedere l’insorgenza della malattia di Alzheimer con una sensibilità compresa tra il 94% e il 100%. Quando è utilizzata in combinazione con le tecniche di neuroimaging esistenti, i medici sono grado di identificare i pazienti che stanno già sviluppando la malattia. Gli esami del liquido cerebrospinale sono disponibili più facilmente, a differenza delle tecnologie di neuroimaging più moderne.
Altri test clinici supplementari forniscono informazioni aggiuntive su alcune caratteristiche della malattia, o vengono utilizzati per escludere altre diagnosi. È comune eseguire test di funzionalità tiroidea, valutare i livelli di vitamina B12, escludere la sifilide, escludere problemi metabolici (tra cui test per la funzione renale, i livelli di elettroliti e per il diabete), valutare i livelli di metalli pesanti (ad esempio il piombo e il mercurio) e l’anemia. È anche necessario escludere la presenza di sintomatologia psichiatrica, come deliri, disturbi dell’umore, disturbi del pensiero di natura psichiatrica, o pseudodemenze depressive. In particolare vengono utilizzati test psicologici per la rilevazione della depressione, dal momento che la depressione può essere concomitante con l’Alzheimer, essere un segno precoce di deficit cognitivo, o esserne addirittura la causa.
Leggi anche:
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Differenza tra morbo di Alzheimer, demenza senile, vascolare e reversibile
- Differenza tra morbo di Alzheimer e morbo di Parkinson: sintomi comuni e diversi
- Cervelletto: anatomia esterna ed interna
- Cervelletto: le lesioni cerebellari più comuni
- Le funzioni del cervelletto: apprendimento e correzione dei movimenti del corpo
Imaging diagnostico
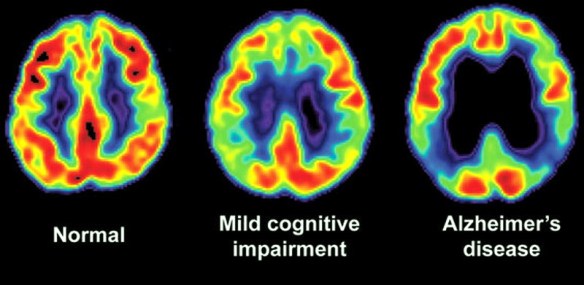
La Tomografia a emissione di fotone singolo (SPECT) e la Tomografia a emissione di positroni (PET), possono essere utilizzati per la conferma di una diagnosi di Alzheimer in associazione con le valutazioni dello stato mentale. In una persona già affetta da demenza, la SPECT sembra essere superiore nel differenziare la malattia di Alzheimer da altre possibili cause, rispetto all’analisi della storia familiare e all’osservazione del paziente. I progressi hanno portato alla proposta di nuovi criteri diagnostici di imaging biomedico.
Una nuova tecnica nota come PiB-PET è stata sviluppata per visualizzare direttamente e chiaramente immagini di depositi di beta-amiloide in vivo, utilizzando un radiotracciante che si lega selettivamente ai depositi A-beta.
La PiB-PET utilizza il carbonio-11 per la scansione PET. Studi recenti suggeriscono che la PiB-PET è precisa all’86% nel predire quali persone, già affette da decadimento cognitivo lieve, svilupperanno la malattia di Alzheimer entro due anni, e al 92% in grado di escludere la probabilità di sviluppare il malattia di Alzheimer.
Un radiofarmaco per PET chiamato (E)-4-(2-(6-(2-(2-(2-([18F]-fluoroethoxy) ethoxy) ethoxy) pyridin-3-yl) vinyl)-N-methyl benzenamine, o 18F AV-45, o florbetapir-fluorine-18, o semplicemente florbetapir, contenente il più duraturo radionuclide fluoro-18, è stato recentemente realizzato e testato come possibile supporto diagnostico nella malattia di Alzheimer. Il florbetapir, come il PiB, si lega alla beta-amiloide, ma grazie all’uso del fluoro-18 ha un’emivita di 110 minuti, in rapporto al tempo di dimezzamento radioattivo PiB che è di 20 minuti. La maggior durata permette di accumulare maggior tracciante nel cervello di persone con malattia di Alzheimer, in particolare nelle regioni note per essere associate a depositi di beta-amiloide.
La risonanza magnetica volumetrica è in grado di rilevare cambiamenti nella dimensione delle regioni del cervello. L’atrofia di queste regioni si sta mostrando come un indicatore diagnostico della malattia. Essa può risultare meno costosa di altre tecniche di imaging attualmente in fase di studio.
Leggi anche:
- Demenza da corpi di Lewy: cause, decorso, Parkinson, aspettativa di vita
- Sistema nervoso simpatico: funzioni
- Sistema nervoso parasimpatico: funzioni
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Cervello maschile e femminile: quali sono le differenze?
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!

 Nel paziente con morbo di Alzheimer, oltre al trattamento farmacologico, esistono interventi comportamentali, di supporto psicosociale e di training cognitivo che possono aiutare il soggetto. Tali misure sono solitamente integrate in maniera complementare con il trattamento farmacologico, e hanno dimostrato una loro efficacia positiva nella gestione clinica complessiva del paziente.
Nel paziente con morbo di Alzheimer, oltre al trattamento farmacologico, esistono interventi comportamentali, di supporto psicosociale e di training cognitivo che possono aiutare il soggetto. Tali misure sono solitamente integrate in maniera complementare con il trattamento farmacologico, e hanno dimostrato una loro efficacia positiva nella gestione clinica complessiva del paziente.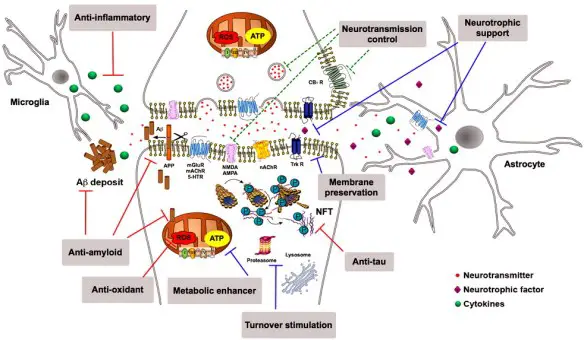 Anche se al momento non esiste una cura efficace, sono state proposte diverse strategie terapeutiche per tentare di influenzare clinicamente il decorso del morbo di Alzheimer; tali strategie puntano a modulare farmacologicamente alcuni dei meccanismi patologici che ne stanno alla base.
Anche se al momento non esiste una cura efficace, sono state proposte diverse strategie terapeutiche per tentare di influenzare clinicamente il decorso del morbo di Alzheimer; tali strategie puntano a modulare farmacologicamente alcuni dei meccanismi patologici che ne stanno alla base.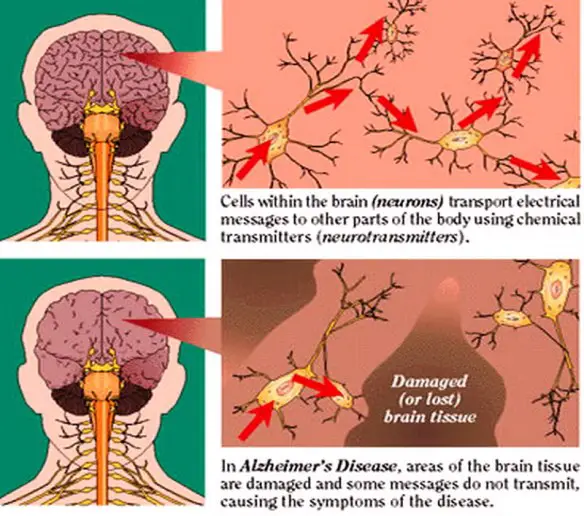 La causa per la maggior parte dei casi di Alzheimer è ancora in gran parte sconosciuta, ad eccezione che per casi dall’1% al 5% in cui sono state individuate le differenze genetiche esistenti.
La causa per la maggior parte dei casi di Alzheimer è ancora in gran parte sconosciuta, ad eccezione che per casi dall’1% al 5% in cui sono state individuate le differenze genetiche esistenti. Il decorso del morbo di Alzheimer è diviso in quattro fasi, contraddistinte da sintomi diversi:
Il decorso del morbo di Alzheimer è diviso in quattro fasi, contraddistinte da sintomi diversi: I muscoli e i nervi che controllano la digestione possono essere influenzati dalla malattia, con conseguente costipazione e gastroparesi (il cibo rimane nello stomaco per un periodo di tempo più lungo del normale). Una alimentazione equilibrata, sulla base di periodiche valutazioni nutrizionali, è consigliata e deve essere finalizzata ad evitare la perdita o il guadagno di peso e a ridurre al minimo le conseguenze delle disfunzioni gastrointestinali.
I muscoli e i nervi che controllano la digestione possono essere influenzati dalla malattia, con conseguente costipazione e gastroparesi (il cibo rimane nello stomaco per un periodo di tempo più lungo del normale). Una alimentazione equilibrata, sulla base di periodiche valutazioni nutrizionali, è consigliata e deve essere finalizzata ad evitare la perdita o il guadagno di peso e a ridurre al minimo le conseguenze delle disfunzioni gastrointestinali. Il morbo di Parkinson può essere diagnosticato partendo dalla storia clinica e da un esame neurologico. Non esiste attualmente un test che identifichi chiaramente la malattia, ma scansioni tomografiche cerebrali sono a volte utilizzate per escludere patologie che potrebbero dare luogo a sintomi simili. L’osservazione di corpi di Lewy nel mesencefalo, in sede di autopsia, è solitamente considerata la prova che il paziente soffriva della malattia di Parkinson. Le linee guida consigliano di valutare periodicamente la diagnosi, poiché la progressione della malattia può far cambiare opinione su di essa.
Il morbo di Parkinson può essere diagnosticato partendo dalla storia clinica e da un esame neurologico. Non esiste attualmente un test che identifichi chiaramente la malattia, ma scansioni tomografiche cerebrali sono a volte utilizzate per escludere patologie che potrebbero dare luogo a sintomi simili. L’osservazione di corpi di Lewy nel mesencefalo, in sede di autopsia, è solitamente considerata la prova che il paziente soffriva della malattia di Parkinson. Le linee guida consigliano di valutare periodicamente la diagnosi, poiché la progressione della malattia può far cambiare opinione su di essa. Molti fattori di rischio e molti fattori protettivi sono stati proposti, a volte in relazione alle teorie riguardanti i possibili meccanismi della malattia, ma nessuno è stato definitivamente individuato da prove certe. Quando gli studi epidemiologici sono stati condotti per verificare la relazione tra un dato fattore e la malattia di Parkinson, spesso i risultati sono apparsi contraddittori.
Molti fattori di rischio e molti fattori protettivi sono stati proposti, a volte in relazione alle teorie riguardanti i possibili meccanismi della malattia, ma nessuno è stato definitivamente individuato da prove certe. Quando gli studi epidemiologici sono stati condotti per verificare la relazione tra un dato fattore e la malattia di Parkinson, spesso i risultati sono apparsi contraddittori.