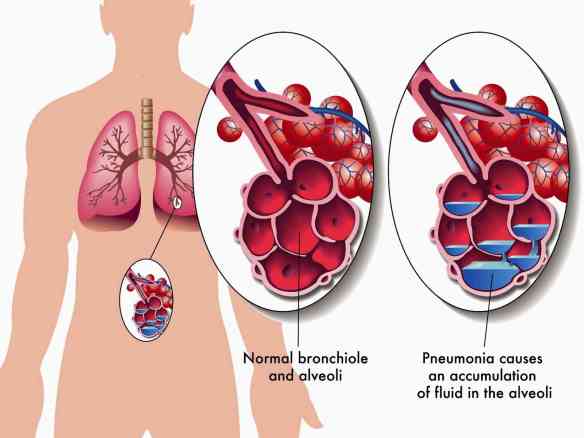
 L’edema polmonare è una condizione caratterizzata da un aumento dei liquidi nello spazio extravascolare (interstizio e alveoli) a livello del parenchima dei polmoni. L’edema polmonare acuto può essere secondario ad un aumento della pressione idrostatica nei capillari polmonari (insufficienza cardiaca o scompenso cardiaco acuto in lingua inglese acute heart failure, AHF), stenosi mitralica o ad un’alterazione delle membrane alveolocapillari (inalazione di sostanze irritanti, processi infettivi). Accumulandosi all’interno degli alveoli, le strutture in cui avvengono gli scambi di ossigeno tra l’aria e il sangue, i fluidi causano problemi respiratori.
L’edema polmonare è una condizione caratterizzata da un aumento dei liquidi nello spazio extravascolare (interstizio e alveoli) a livello del parenchima dei polmoni. L’edema polmonare acuto può essere secondario ad un aumento della pressione idrostatica nei capillari polmonari (insufficienza cardiaca o scompenso cardiaco acuto in lingua inglese acute heart failure, AHF), stenosi mitralica o ad un’alterazione delle membrane alveolocapillari (inalazione di sostanze irritanti, processi infettivi). Accumulandosi all’interno degli alveoli, le strutture in cui avvengono gli scambi di ossigeno tra l’aria e il sangue, i fluidi causano problemi respiratori.
I rischi dell’edema polmonare
L’accumulo di fluidi nei polmoni alla base dell’edema polmonare richiede un intervento immediato per evitare gravi complicazioni. Se non trattato può infatti portare all’aumento della pressione nell’arteria polmonare e, in alcuni casi, a una sofferenza del ventricolo destro del cuore. L’aumento di pressione si ripercuote sull’atrio destro e, di conseguenza, su diverse parti del corpo, portando a gonfiori addominali e a livello delle gambe, accumulo di liquidi intorno ai polmoni e congestione e gonfiori del fegato.
Leggi anche:
- Apparato respiratorio: anatomia in sintesi, struttura e funzioni
- Spirometria diretta ed indiretta: come si esegue ed a cosa serve
- Pneumotorace spontaneo primario, secondario ed iperteso: cause, sintomi, terapie
Quali sono le cause dell’edema polmonare?
Nella maggior parte dei casi l’edema polmonare è causato da problemi cardiaci, ad esempio malattie coronariche, cardiomiopatie, problemi alle valvole cardiache e ipertensione. I liquidi possono però accumularsi anche a causa di infezioni ai polmoni, malattie renali, inalazione di fumi chimici, farmaci, uno scampato annegamento e sindrome da stress respiratorio acuto. Le cause esatte dell’edema polmonare da alta quota – una forma che In genere colpisce al di sopra dei 2.400 metri di altitudine o chi pratica sport in quota senza prima essersi acclimatato – non sono note, ma sembra che si tratti di un problema associato all’aumento della pressione causato dalla costrizione dei capillari polmonari.
Edema polmonare da squilibrio delle forze di Starling
L’edema polmonare può essere conseguente ad uno squilibrio delle forze di Starling che trattengono i liquidi plasmatici all’interno del letto capillare o ad un’alterazione delle membrane alveolocapillari:
- Aumento della pressione capillare polmonare (insufficienza cardiaca, stenosi mitralica, edema da iperafflusso);
- Diminuzione della pressione oncotica del plasma (iponchia);
- Diminuzione della pressione interstiziale polmonare (rapida espansione di polmone collassato a causa di pneumotorace);
- Eccessiva diminuzione della pressione endopleurica (aumento del volume di fine espirazione in corso di asma).
Edema polmonare acuto da insufficienza cardiaca
L’edema polmonare acuto cardiogeno (secondario ad una grave insufficienza cardiaca ad esempio da infarto del miocardio o da severe bradiaritmia) è dovuto alla disfunzione di pompa ventricolare conseguente a lesioni acute o croniche a livello delle strutture cardiache. Il deficit di pompa si traduce in un accumulo di liquidi a monte del ventricolo insufficiente, con aumento della pressione idrostatica nei distretti venosi che drenano i tessuti; in tal caso, l’aumento della pressione di deflusso venoso si ripercuote a livello dei capillari polmonari: in questa sede, l’incremento della pressione vascolare porta ad uno stravaso dei liquidi a livello dell’interstizio polmonare. Questa situazione viene definita “edema interstiziale”. A questo punto, un ulteriore innalzamento della pressione capillare può portare alla rottura della giunzioni occludenti degli alveoli polmonari con inondazione degli stessi. Questa situazione è definita “edema alveolare”.
Leggi anche:
- Aritmia cardiaca: cause e fattori di rischio, sintomi, diagnosi e cura
- Bradicardia: sintomi, conseguenze, rimedi, notturna e grave
- Bradiaritmia: tipi, cause, sintomi, prevenzione e trattamenti
- Astori, l’autopsia: “Morto per bradiaritmia, cuore rallentato fino a fermarsi”
- Edema polmonare acuto, cardiogeno, cause, sintomi e terapie
Quali sono i sintomi dell’edema polmonare?
L’edema polmonare improvviso si manifesta con respiro molto corto e difficoltà respiratorie che si aggravano sdraiandosi, un senso di soffocamento, rantoli o sibili, ansia e preoccupazione, sudorazione eccessiva, tosse (a volte con sangue), cute pallida, palpitazioni e, in alcuni casi, dolore al petto. L’edema polmonare cronico è invece caratterizzato da mancanza di respiro e difficoltà respiratorie mentre si pratica attività fisica, sibili, risvegli notturni per la mancanza di fiato, perdita dell’appetito, gambe e caviglie gonfie, stanchezza e, in caso di insufficienza cardiaca, un rapido aumento di peso. I sintomi dell’edema da alta quota sono mal di testa, insonnia, ritenzione idrica, tosse e fiato corto.
Come prevenire l’edema polmonare?
Spesso l’edema polmonare non è prevenibile, ma uno stile di vita mirato alla prevenzione delle malattie cardiovascolari aiuta anche a ridurne la probabilità. Per questo è importante tenere sotto controllo lo stress, la pressione sanguigna e i livelli di colesterolo, praticare un’attività fisica regolare, mantenere un peso salutare, seguire un’alimentazione ricca di frutta fresca, verdure e latticini a basso contenuto di grassi, limitare il consumo di sale e di alcol e non fumare.
Diagnosi
La diagnosi di edema polmonare richiede una visita medica e una radiografia al torace.
È possibile che vengano valutati i livelli di ossigeno e di anidride carbonica nel sangue e la concentrazione di peptide natriuretico di tipo B, che può indicare la presenza di problemi cardiaci.
Altri possibili esami sono:
- ecografia cardiaca con colordoppler;
- test per la funzionalità renale;
- esami del sangue;
- esami per escludere la possibilità di infarto;
- elettrocardiogramma;
- ecocardiogramma transesofageo;
- cateterismo dell’arteria polmonare;
- cateterismo cardiaco.
Trattamenti
Il trattamento immediato dell’edema polmonare prevede la somministrazione di ossigeno. In alcuni casi può essere necessaria la ventilazione assistita.
A seconda della situazione è possibile che vengano somministrati:
- farmaci per la riduzione del precarico;
- morfina per ridurre l’ansia e l’affanno respiratorio;
- farmaci per la riduzione del postcarico;
- antipertensivi.
Leggi anche:
- Morte cardiaca improvvisa: cause, sintomi premonitori e cure
- Sindrome del QT lungo: valorie, cause, cura, farmaci, sportivi
- A che serve l’osso ioide e dove si trova? Cos’è il pomo d’Adamo?
- Apnea ostruttiva del sonno: cause, rischi, trattamenti e prevenzione
- Perché si russa e quali sono i rimedi per smettere di russare? I pericoli dell’apnea ostruttiva del sonno
- Differenza tra ventilazione polmonare e alveolare: spazio morto anatomico e fisiologico
- Differenza tra edema infiammatorio, non infiammatorio, essudato, trasudato, idropisìa e idrope
- Edema infiammatorio e vasi sanguigni nell’infiammazione
- Com’è fatto il cuore, a che serve e come funziona?
- Differenza tra pressione arteriosa e venosa
- Differenza tra pressione massima (sistolica), minima (diastolica) e differenziale
- Pressione arteriosa: valori normali e patologici
- Differenze tra respiro normale e patologico
- Trachea: anatomia e funzioni in sintesi
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Differenza tra inspirazione e espirazione: l’atto respiratorio
- Respiro patologico: le alterazioni del ritmo respiratorio normale
- Respiro di Biot ed apnee: caratteristiche e cause patologiche e non patologiche
- Respiro di Cheyne-Stokes: caratteristiche e cause patologiche e non patologiche
- Respiro di Kussmaul: caratteristiche e cause
- Respiro di Falstaff: caratteristiche e cause
- Parametri della spirometria: capacità, volumi, rapporti e flussi
- Broncoscopia polmonare con biopsia: a cosa serve, fa male, è pericolosa?
- Asma bronchiale in bambini e adulti: cause, sintomi e cura
Lo Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!

 La causa per la maggior parte dei casi di Alzheimer è ancora in gran parte sconosciuta, ad eccezione che per casi dall’1% al 5% in cui sono state individuate le differenze genetiche esistenti.
La causa per la maggior parte dei casi di Alzheimer è ancora in gran parte sconosciuta, ad eccezione che per casi dall’1% al 5% in cui sono state individuate le differenze genetiche esistenti. I campi elettromagnetici sono porzioni di spazio dove si propagano onde elettriche e magnetiche. Un campo elettrico è dato da una differenza di potenziale (o tensione) tra particelle cariche, mentre un campo magnetico si genera col movimento di flussi di elettroni, cioè col passaggio di corrente elettrica. I campi elettromagnetici sono presenti in qualsiasi punto dell’ambiente e sono generati da sorgenti naturali (come elettricità nell’atmosfera e campo magnetico terrestre) e da sorgenti artificiali (come smartphone, elettrodomestici, radio, televisioni…).
I campi elettromagnetici sono porzioni di spazio dove si propagano onde elettriche e magnetiche. Un campo elettrico è dato da una differenza di potenziale (o tensione) tra particelle cariche, mentre un campo magnetico si genera col movimento di flussi di elettroni, cioè col passaggio di corrente elettrica. I campi elettromagnetici sono presenti in qualsiasi punto dell’ambiente e sono generati da sorgenti naturali (come elettricità nell’atmosfera e campo magnetico terrestre) e da sorgenti artificiali (come smartphone, elettrodomestici, radio, televisioni…).