 Il test di Mantoux o Tubercolin skin test è una prova di screening utile per saggiare la presenza in un individuo di una infezione anche latente da Mycobacterium tuberculosis, il micobatterio della tubercolosi. L’esecuzione del test consiste nell’iniezione intradermica, ovvero tra gli strati del derma della faccia volare dell’avambraccio, di 5 UI di PPD-S oppure 1-2 UI di PPD-RT23, che sono derivati proteici purificati della tubercolina (PPD, Purified Protein Derivative), per valutare la reazione locale dell’organismo a distanza di alcuni giorni.
Il test di Mantoux o Tubercolin skin test è una prova di screening utile per saggiare la presenza in un individuo di una infezione anche latente da Mycobacterium tuberculosis, il micobatterio della tubercolosi. L’esecuzione del test consiste nell’iniezione intradermica, ovvero tra gli strati del derma della faccia volare dell’avambraccio, di 5 UI di PPD-S oppure 1-2 UI di PPD-RT23, che sono derivati proteici purificati della tubercolina (PPD, Purified Protein Derivative), per valutare la reazione locale dell’organismo a distanza di alcuni giorni.
Si tratta di un test economico e facile da effettuare, ma presenta vari svantaggi, tra cui il periodo ben definito per la lettura del risultato e una quota significativa sia di falsi positivi che negativi. È uno dei principali test per la tubercolina utilizzato in tutto il mondo, in larga misura sostituendo test multipli di punture, come il tine test . Il test Heaf, una forma di tine test, è stato utilizzato fino al 2005 nel Regno Unito, quando è stato sostituito dal test Mantoux. Il test Mantoux è approvato dalla American Thoracic Society e dai centri per il controllo e la prevenzione delle malattie. È stato utilizzato anche nell’URSS e ora è utilizzato nella maggior parte degli stati post-sovietici.
Procedura
Una dose standard di 5 unità tubercolina (UI – 0,1 ml), secondo il CDC o 2 UI di tubercolina RT23 dello Statens Serum Institute (SSI) in soluzione da 0,1 ml, secondo l’NHS viene iniettata intradermicamente (tra gli strati del derma) . Questa iniezione intradermica è definita la tecnica Mantoux. Una persona che è stata esposta ai batteri dovrebbe innescare una risposta immunitaria nella pelle contenente le proteine batteriche.
Per approfondire:
- Tubercolosi: trasmissione, sintomi, diagnosi e cure in sintesi
- Tubercolosi: cause e patogenesi della malattia
- Mycobacterium tuberculosis: il batterio che causa la tubercolosi
- Sintomi della tubercolosi polmonare ed extrapolmonare
- Come si trasmette la tubercolosi?
Risultato
Il paziente viene rivalutato dopo 48-72 ore, e il test viene considerato positivo se il tessuto in cui è stata iniettata la tubercolina PPD sviluppa un rigonfiamento piuttosto duro con un diametro che superi il valore soglia, che può essere di 5, 10 o 15 mm a seconda della classe di rischio a cui appartiene il paziente: più a rischio è il paziente, minore sarà il diametro soglia della reazione. Si sviluppa in questo caso una reazione di ipersensibilità ritardata (o DTH). Il test viene solitamente considerato negativo nei casi in cui la risposta sia al di sotto dei 5 mm di diametro.
Questo tipo di reazione è dovuto al fisiologico accumulo di liquidi, molecole e cellule caratteristico della risposta immunitaria; il fatto che questa sia apprezzabile in tempi relativamente brevi (due o tre giorni) indica una reazione di tipo secondario e quindi più rapida ed intensa da parte del sistema immunitario: ciò è dovuto ad un pregresso, e nel caso della Tubercolosi ancora in atto, incontro del soggetto con l’antigene in questione che ha permesso lo sviluppo di cellule memoria (ad esempio i linfociti di memoria). In questo caso, quindi, è riconosciuta la presenza di una ITL, infezione tubercolare latente.
Una positività al test è indice di un contatto pregresso del paziente col batterio della tubercolosi o con la tossina iniettata, ma non prova lo stato della malattia. Per questo motivo, i soggetti positivi al test di Mantoux, soprattutto se a rischio come bambini, anziani, immunodepressi od operatori sanitari, vengono sottoposti ad ulteriori test diagnostici discriminanti la presenza o meno della malattia, tra cui test immunologici o anche radiologici.
La positività al test di Mantoux per un paziente con infezione in corso si verifica invece dopo 8 settimane dal contagio (cosiddetto periodo finestra). In casi di sospetto contagio, seppur in presenza di test negativo, è quindi necessario ripeterlo dopo 8-10 settimane.
Classificazione della reazione tubercolina
I risultati di questo test devono essere interpretati con attenzione. I fattori di rischio medico determinano in che misura il rigonfiamento (5 mm, 10 mm o 15 mm) è considerato positivo. Un risultato positivo indica l’esposizione al TB:
- 5 mm o più è positivo :
-Una persona HIV-positiva
-Persone con contatti recenti con un paziente di TB
-Persone con cambiamenti nodulari o fibrotici ai raggi X del torace coerenti con una datata TB guarita
-Pazienti con trapianti di organi e altri pazienti immunosoppressi
- 10 mm o più è positivo
-Arrivi recenti (meno di cinque anni) dai paesi ad alta prevalenza
-Utilizzatori di droga iniettabile
-residenti in ambienti ad alto rischio (quali prigioni, case di cura, ospedali, rifugi senza tetto, ecc.)
-Personale di laboratorio che lavorano con il Micobatterio
-Persone con condizioni cliniche che li predispone a rischio elevato (ad es. Diabete, terapia prolungata di corticosteroidi, leucemia, malattia renale dello stadio finale, sindromi di malassorbimento cronico, peso corporeo basso)
-Bambini minori di quattro anni, o bambini e adolescenti esposti ad adulti in categorie ad alto rischio
- 15 mm o più è positivo
-Persone che non presentano fattori di rischio conosciuti per TB
È necessario tener conto che i programmi di test della pelle mirati devono essere condotti solo nei gruppi ad alto rischio.
Una conversione della prova tubercolina è definita come un aumento di 10 mm o più in un periodo di due giorni, indipendentemente dall’età. I criteri alternativi includono gli aumenti di 6, 12, 15 o 18 mm.
Leggi anche:
- Tubercolosi: diagnosi e progressione della malattia
- Trattamento farmacologico per la tubercolosi
- Trattamento della tubercolosi resistente ai farmaci
- Tubercolosi: prognosi, vaccino e strategie di prevenzione
Falsi positivi e falsi negativi
Falso positivo
Un soggetto Mantoux positivo potrebbe essere stato effettivamente infettato dal mycobacterium tuberculosis, oppure da uno degli altri micobatteri (quindi non tubercolari) che hanno reazione positiva al test di Mantoux, o ancora potrebbe essere stato vaccinato in passato contro la tubercolosi con BCG (mycobacterium bovis). TST (test della pelle tubercolina) positivo è determinato dalla dimensione del rigonfiamento. La dimensione è calcolata considerando soprattutto i fattori di rischio : un paziente a basso rischio deve avere una maggiore rigonfiamento per un risultato positivo di un paziente ad alto rischio. I gruppi ad alto rischio comprendono contatti recenti con soggetti con TBC, HIV+, soggetti con radiografie del torace con alterazioni fibrotiche, riceventi del trapianto di organi e quelli con immunosoppressione.
Secondo il Dipartimento di Salute dell’Ohio e il Dipartimento di Salute degli Stati Uniti, il vaccino Bacillus Calmette-Guérin (BCG) non protegge contro l’infezione da TB. Esso, tuttavia, dà nell’80% dei casi protezione ai bambini contro la meningite tubercolare e la tubercolosi miliare. Pertanto, un TST / PPD positivo in una persona che ha ricevuto il vaccino BCG è interpretato come infezione latente( LTBI). A causa della bassa specificità della prova, la maggior parte delle reazioni positive nei bambini e negli adolescenti a basso rischio sono falsi positivi. Positivi falsi possono anche verificarsi quando l’area iniettata viene toccata, causando gonfiore e prurito. Un’altra fonte di risultati falsi positivi può essere la reazione allergica o un’ipersensibilità. Sebbene rari, (circa 0,08 reazioni riportate per milione di dosi di tubercolina), queste reazioni possono essere pericolose e si devono prendere precauzioni avendo disponibile l’epinefrina.
Falso negativo
Al contrario, un paziente Mantoux negativo potrebbe anche essere abbastanza immunodeficiente o immunodepresso da non poter scatenare la reazione infiammatoria, oppure aver contratto il micobatterio più recentemente rispetto al periodo finestra della malattia. Da un rapporto del 2008 sui casi di tubercolosi in Italia, si è visto che il test può risultare negativo in un’alta percentuale dei contagiati per cui è utilizzato. Inoltre la reazione al test PPD viene alterato nelle seguenti condizioni:
- Mononucleosi infettiva
- Vaccino da virus vivo – Il test non deve essere effettuato entro 3 settimane dalla vaccinazione dal virus vivo (ad esempio vaccino MPR o vaccino Sabin).
- sarcoidosi
- Malattia di Hodgkin
- Corticosteroide terapia / uso steroide
- Malnutrizione
Questo perché il sistema immunitario deve essere funzionale per montare una risposta al derivato proteico iniettato sotto la pelle. Un falso risultato negativo può verificarsi in una persona che è stata recentemente infetta da TB, ma il cui sistema immunitario non ha ancora reagito ai batteri.
Test alternativi
Per superarne i limiti di specificità e sensibilità del test di Mantoux sono state studiate varie alternative in vitro per l’individuazione di infezioni tubercolari, tra cui il Test Interferon Gamma (TIG) o Interferon-Gamma Releasing Assay (IGRA) con Quantiferon GOLD TB o T-SPOT.TB. Tali test utilizzano le proteine ESAT-6 (early secretory antigen target-6) e CFP-10 (culture filtrate protein-10), specificamente codificate dalla regione RD1 del mycobacterium tuberculosis, per stimolare i linfociti T effettori circolanti a produrre interferone gamma (IFNγ). La positività del test è quindi legata ad una reazione immunitaria specifica agli antigeni del micobatterio della tubercolosi, escludendola quindi in quei pazienti che siano stati in realtà vaccinati contro la TB o che infettati da agenti patogeni diversi ma comunque reattivi al test di Mantoux.
Leggi anche:
- Differenza tra virus e batteri: chi è più pericoloso? Diagnosi, sintomi e terapia
- Il virus più pericoloso del mondo è più vicino a te di quanto pensi
- Qual è il virus che ha ucciso più persone in assoluto?
- Qual è il virus più letale al mondo?
- Un oggetto che tocchi 150 volte al giorno ha più batteri della tavoletta del wc. Di cosa si tratta e come difendersi
- Quante persone uccide ogni anno il virus HIV che causa l’AIDS?
- L’insospettabile influenza ogni anno uccide più persone dell’Ebola
- Il virus che uccide mezzo milione di bambini ogni anno
- Febbre gialla, dengue ed altre malattie trasmesse dalle zanzare
- Febbre dengue: sintomi, trasmissione, diagnosi, terapia e prevenzione
- Virus mortali: ecco gli 11 più pericolosi al mondo
- Meningite: contagio, sintomi, vaccino, gravità e profilassi
- Endocardite: cause, sintomi, diagnosi e terapie
- Differenza tra batteri Gram negativi e Gram positivi
- Differenza tra batteri bacilli, cocchi, streptococchi e spirilli
- Coprocoltura feci per salmonella: perché e come si fa
- Batteriemia: cura, segni, sintomi, diagnosi ed antibiotici
- I cinque segni cardinali dell’infiammazione
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- Differenza tra cellula aploide e diploide con esempi
- Riproduzione cellulare e ciclo cellulare
- Differenza tra coronarografia ed angioplastica
- Differenza tra tumore benigno, maligno, neoplasia, cancro e metastasi
- HIV: sintomi iniziali in donne e uomini
- Differenza tra HIV e AIDS: sono uguali?
- Shock settico e sepsi: sintomi, terapia, conseguenze, si può guarire
- Differenza tra sepsi e Sindrome da risposta infiammatoria sistemica (SIRS)
- Differenza tra infezione ed infiammazione: sono la stessa cosa?
- Differenza tra infiammazione cronica granulomatosa e non granulomatosa
- Differenza tra granulomi asettici (da corpo estraneo) e settici
- Si muore di AIDS? Qual è l’aspettativa di vita?
- Sistema immunitario, immunità innata e specifica: riassunto, schema e spiegazione
- Immunodeficienza primaria e secondaria: sintomi, cause e terapie
- Differenza tra adenocarcinoma e carcinoma con esempi
- Differenza tra cancro e carcinoma con esempi
- Stomie: cosa sono, a che servono, quanti tipi esistono?
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Ipertrofia muscolare: cosa significa e come si raggiunge
- Cosa sono le metastasi? Tutti i tumori danno metastasi?
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Come prevenire i tumori ed il cancro? I 10 cambiamenti consigliati
- Differenza tra ipertrofia ed iperplasia con esempi
- Differenza tra iperplasia e neoplasia
- Differenze tra ileostomia, colostomia e urostomia
- Differenza tra atrofia, distrofia ed aplasia con esempi
- Differenza tra organismi aerobi ed anaerobi con esempi
- Ciclo di Krebs e respirazione cellulare: spiegazione facile e schema
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!

 Il Mycobacterium tuberculosis anche chiamato Bacillo di Koch appartenente alla famiglia delle Mycobacteriacee, famiglia di batteri gram-variabili. È il bacillo responsabile della tubercolosi nell’uomo. Sono bacilli immobili, non sporigeni, aerobi obbligati, delle dimensioni di 0,2-0,6 x 1-10 µm, caratterizzati dalla lenta crescita, da una parete ricca di acidi micolici e da un DNA con elevato contenuto di guanina e citosina (60-70%). Il nome deriva dal dr. Robert Koch che lo scoprì nel 1882.
Il Mycobacterium tuberculosis anche chiamato Bacillo di Koch appartenente alla famiglia delle Mycobacteriacee, famiglia di batteri gram-variabili. È il bacillo responsabile della tubercolosi nell’uomo. Sono bacilli immobili, non sporigeni, aerobi obbligati, delle dimensioni di 0,2-0,6 x 1-10 µm, caratterizzati dalla lenta crescita, da una parete ricca di acidi micolici e da un DNA con elevato contenuto di guanina e citosina (60-70%). Il nome deriva dal dr. Robert Koch che lo scoprì nel 1882.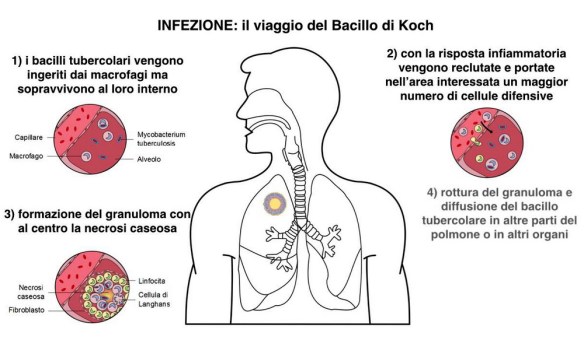 In molti pensavano che la tubercolosi fosse una malattia infettiva ormai “superata”, ed invece la TBC non è affatto scomparsa, anzi. La tubercolosi (anche chiamata tisi o poriformalicosi) è molto più diffusa di quanto si pensi e solo in Italia fa registrare 10 nuovi casi al giorno. La malattia infettiva causata dal Mycobacterium tuberculosis (chiamato anche Bacillo di Koch) rappresenta nuovamente una emergenza globale, come indicato dal nuovo rapporto dell’Organizzazione mondiale della sanità (Oms), dal titolo emblematico: “Azioni globali e investimenti cadono molto al di sotto di quel che serve per far finire l’epidemia globale di Tbc”.
In molti pensavano che la tubercolosi fosse una malattia infettiva ormai “superata”, ed invece la TBC non è affatto scomparsa, anzi. La tubercolosi (anche chiamata tisi o poriformalicosi) è molto più diffusa di quanto si pensi e solo in Italia fa registrare 10 nuovi casi al giorno. La malattia infettiva causata dal Mycobacterium tuberculosis (chiamato anche Bacillo di Koch) rappresenta nuovamente una emergenza globale, come indicato dal nuovo rapporto dell’Organizzazione mondiale della sanità (Oms), dal titolo emblematico: “Azioni globali e investimenti cadono molto al di sotto di quel che serve per far finire l’epidemia globale di Tbc”.