 La terapia della fibrillazione atriale deve essere praticata d’urgenza in caso di presenza di sintomi. Si articola in procedimenti distinti che devono essere selezionati e attuati contemporaneamente o anche in rapida successione a seconda delle condizioni cliniche del paziente.
La terapia della fibrillazione atriale deve essere praticata d’urgenza in caso di presenza di sintomi. Si articola in procedimenti distinti che devono essere selezionati e attuati contemporaneamente o anche in rapida successione a seconda delle condizioni cliniche del paziente.
La terapia della fibrillazione atriale può mirare al ripristino del ritmo sinusale normale (cardioversione) oppure a ridurre la frequenza cardiaca (controllo della frequenza cardiaca) e deve essere indirizzata a proteggere il paziente dalle conseguenze più gravi: ictus cerebrale e insufficienza cardiaca.
I procedimenti terapeutici per la fibrillazione atriale sono i seguenti:
- Terapia di ripristino del ritmo sinusale in acuto
- Terapia di controllo della frequenza cardiaca in acuto
- Terapia di prevenzione del rischio tromboembolico (soprattutto ictus)
- Terapia di controllo del ritmo a lungo termine
- Terapia di controllo della frequenza cardiaca a lungo termine
Ripristino del ritmo sinusale o controllo della frequenza cardiaca?
Un importante studio condotto in Canada (Tsadok et al., 2012) ha messo a confronto le due strategie terapeutiche di ripristino del ritmo sinusale e del controllo della frequenza cardiaca nella fibrillazione atriale. I risultati hanno mostrato un numero di pazienti con ictus notevolmente minore nei pazienti con controllo del ritmo rispetto a quelli con controllo della frequenza cardiaca. Altri studi (Hohnloser et al., 2000; Roy et al., 2008) hanno però dimostrato che il controllo del ritmo e il controllo della frequenza non portano a sostanziali modificazioni dei rischi di ictus, scompenso cardiaco, mortalità.
Nei pazienti con fibrillazione atriale ed instabilità emodinamica e quindi a rischio di scompenso cardiaco acuto, deve essere considerata la cardioversione urgente.
Terapia di ripristino del ritmo sinusale in acuto
Il ripristino del ritmo sinusale e il suo mantenimento sono gli obiettivi della terapia della fibrillazione atriale.
La terapia di ripristino del ritmo sinusale o cardioversione può essere effettuata con farmaci (cardioversione farmacologica con farmaci antiaritmici) oppure con corrente elettrica (cardioversione elettrica).
In aggiunta alla cardioversione in acuto e necessario comunque curare le cause della fibrillazione atriale, i fattori di rischio e le patologie concomitanti.
I pazienti che sono sottoposti a cardioversione dovrebbero iniziare la terapia anticoagulante precocemente.
I pazienti con fibrillazione atriale che dura da meno di 48 ore possono essere sottoposti a cardioversione senza terapia anticoagulante che deve essere iniziata precocemente.
I pazienti in cui la fibrillazione atriale dura da più di 48 ore devono assumere la terapia anticoagulante per tre settimane prima della cardioversione e continuare per quattro settimane, sempre che non necessitino di proseguire la terapia anticoagulante a lungo termine.
In caso di cardioversione precoce si può eseguire ecocardiogramma transesofageo per escludere trombi in atrio sinistro.
La cardioversione farmacologica può mantenere il ritmo sinusale il doppio rispetto a nessuna terapia (Lafuente-Lafuente et al., 2012).
La cardioversione farmacologica in acuto non richiede sedazione e non necessita di digiuno.
Farmaci per la cardioversione farmacologica sono:
- Dofetilide – pericolo di torsione di punta (aritmia ventricolare che mette in pericolo la vita)
- Flecainide – uso limitato in malattie strutturali cardiache
- Propafenone – uso limitato in malattie strutturali cardiache
- Ibutilide – rischio di torsione di punta
- Vernakalant – utile nei pazienti con insufficienza cardiaca lieve e media, nei pazienti con ischemia miocardica purché non presentino ipotensione (pressione arteriosa bassa) o stenosi aortica grave
- Amiodarone – può essere utilizzato in pazienti con ischemia miocardica e in pazienti con scompenso cardiaco
- Sotalolo
“Pill in the Pocket” (pillola in tasca): pazienti selezionati possono assumere la terapia per la conversione a ritmo sinusale autonomamente in caso di crisi di fibrillazione atriale.
I farmaci antiaritmici da utilizzare come “Pill in the Pocket” (pillola in tasca) sono flecainide e propafenone.
I farmaci antiaritmici devono essere stati somministrati in precedenza in ospedale e devono avere dimostrato di essere efficaci nel ripristino del ritmo sinusale.
La cardioversione elettrica sincronizzata con corrente diretta si utilizza in caso di pazienti con compromissione emodinamica perché può ripristinare il ritmo sinusale in un tempo più breve rispetto alla cardioversione farmacologica (Gitt et al., 2013). Richiede sedazione e digiuno e può provocare ustioni della cute.
La cardioversione elettrica è controindicata nell’intossicazione da digitale.
Leggi anche:
Terapia di controllo del ritmo a lungo termine
La scelta di sostenere la terapia antiaritmica a lungo termine deve essere effettuata dal medico in accordo con il paziente che deve essere adeguatamente informato riguardo ai vantaggi ed agli effetti collaterali.
Le Linee guida 2010 e 2016 ESC (European Society of Cardiology) riportano le seguenti osservazioni (European Heart Rhythm Association et al., 2010; Kirchhof et al., 2016):
- Obiettivo della terapia antiaritmica è di migliorare i sintomi della fibrillazione atriale
- I farmaci antiaritmici non sono in grado di mantenere costantemente il ritmo sinusale
- I farmaci antiaritmici riducono e non eliminano le crisi di fibrillazione atriale
- I farmaci antiaritmici possono ridurre la frequenza ventricolare durante le crisi di fibrillazione atriale
- Se il farmaco antiaritmico prescelto non è efficace può essere sostituito con un altro farmaco antiaritmico
- I farmaci antiaritmici possono indurre altre aritmie anche gravi (effetto proaritmico) e possono avere effetti collaterali extracardiaci
- La scelta del farmaco antiaritmico deve essere guidata da criteri di sicurezza piuttosto che di efficacia
- I pazienti che assumono terapia antiaritmica conservano il ritmo sinusale il doppio rispetto a quelli che non la assumono
- Non ci sono apprezzabili riduzioni della mortalità e delle complicazioni cardiovascolari nei pazienti che assumono terapia antiaritmica
- Nei pazienti che assumono terapia antiaritmica dimunuisce il rischio di ospedalizzazione.
Per ridurre i rischi della terapia antiaritmica si può adottare il trattamento breve, ad esempio flecainide per quattro settimane dopo cardioversione; tale trattamento riduce le ricorrenze di fibrillazione atriale dell’80% rispetto alla terapia a lungo termine (ad esempio, flecainide per 6 settimane) (Kirchhof et al., 2012).
La terapia a breve termine è usata anche dopo ablazione transcatetere (trattamento chirurgico della fibrillazione atriale), nei pazienti con effetti collaterali da terapia antiaritmica e nei pazienti con basso rischio di ricadute.
Farmaci antiaritmici per il controllo del ritmo a lungo termine.
La scelta del farmaco antiaritmico nella terapia a lungo termine del paziente con fibrillazione atriale per il controllo delle ricadute, deve essere fatta con grande attenzione dal medico e deve essere condivisa dal paziente.
Il medico deve valutare (Al-Khatib et al., 2014):
a) la presenza di malattie cardiovascolari ed extracardiache concomitanti
b) il rischio cardiovascolare soprattutto in relazione al potenziale proaritmico (torsione di punta o altre aritmie pericolose per la vita) dei farmaci antiaritmici
c) gli effetti tossici extracardiaci
d) il peso dei sintomi
Prima di iniziare la terapia con i farmaci antiaritmici è necessario eseguire (Linee Guida ESC 2016) (Kirchhof et al., 2016):
a) un elettrocardiogramma per valutare se sono presenti alterazioni dell’attività elettrica cardiaca
b) ripetere l’elettrocardiogramma nei primi giorni di terapia per valutarne i risultati e gli effetti negativi
c) eseguire periodicamente un elettrocardiogramma per valutare il rischio proaritmico
d) effettuare un monitoraggio elettrocardiografico protratto da uno a tre giorni nei pazienti che assumono flecainide, propafenone o sotalolo
I farmaci antiaritmici per la terapia di controllo del ritmo cardiaco a lungo termine sono:
L’amiodarone è raccomandato per la prevenzione delle ricadute di fibrillazione atriale nei pazienti con scompenso cardiaco; è un farmaco molto efficace ma presenta spesso effetti collaterali extracardiaci, pertanto altri farmaci devono essere considerati per primi (Chevalier et al., 2003; Khan et al., 2003).
Il dronedarone è un farmaco raccomandato per la terapia di controllo del ritmo nei pazienti con normale funzione ventricolare sinistra, senza ipertrofia ventricolare sinistra patologica, nei pazienti con coronaropatia stabile e senza scompenso cardiaco (Singh et al., 2007; Hohnloser et al., 2009). È controindicato nello scompenso cardiaco (Kober et al., 2008).
Flecainide e propafenone sono farmaci raccomandati per la terapia di controllo del ritmo nei pazienti con normale funzione ventricolare sinistra senza ipertrofia ventricolare sinistra patologica. Sono controindicati nei pazienti con cardiopatia ischemica o con scompenso cardiaco significativi per il rischio di aritmie minacciose per la vita (NEJM, 1989).
Il sotalolo è un farmaco raccomandato per la terapia di controllo del ritmo nei pazienti con normale funzione ventricolare sinistra senza ipertrofia ventricolare sinistra patologica. Per il rischio di torsione di punta le Linee guida ESC 2016 suggeriscono di limitare l’uso a situazioni specifiche (Waldo et al., 1996).
Chinidina e disopiramide sono farmaci largamente utilizzati in passato per la terapia del controllo del ritmo: sono gravati da alta mortalità probabilmente per aritmie ventricolari gravi (torsione di punta) (Lafuente-Lafuente et al., 2012; Freemantle et al., 2011). La disopiramide può essere utile nella fibrillazione atriale mediata dal vago (fibrillazione atriale che si presenta negli atleti o durante il sonno). Le Linee guida ESC 2016 suggeriscono di limitare l’uso di questi farmaci a situazioni specifiche.
Dofetilide è un farmaco utile per la terapia di controllo del ritmo nei pazienti con insufficienza cardiaca (Pedersen et al., 2001); le Linee guida ESC 2016 suggeriscono di limitarne l’uso a situazioni specifiche.
Effetti antiaritmici di farmaci non antiaritmici
Sono stati eseguiti e sono in corso studi per valutare l’efficacia di farmaci non antiaritmici per la prevenzione della fibrillazione atriale. I farmaci studiati sono ACE-inibitori (inibitori dell’enzima di conversione dell’angiotensina) e ARB (antagonisti recettoriali dell’angiotensina), antagonisti dell’aldosterone, statine, omega tre. Questi farmaci aldilà delle altre indicazioni d’impiego non hanno mostrato con sicurezza effetti antiaritmici.
Le Linee guida sul trattamanto della fibrillazione atriale raccomandano (Linee guida ESC 2010 e 2016) (European Heart Rhythm Association et al., 2010; Kirchhof et al., 2016):
a) ACE inibitori o ARB e betabloccanti dovrebbero essere considerati nella prevenzione della fibrillazione atriale di prima insorgenza nei pazienti con insufficienza cardiaca e ridotta frazione di eiezione ventricolare (la frazione di eiezione è la quantità di sangue espulsa dal ventricolo sinistro ad ogni battito cardiaco)
b) ACE inibitori e ARB dovrebbero essere considerati nella prevenzione della fibrillazione atriale di prima insorgenza nei pazienti con ipertensione in particolare se presente ipertrofia ventricolare sinistra
c) Il pre-trattamento con ACE-inibitori o ARB può essere considerato nei pazienti con fibrillazione atriale ricorrente che hanno in programma cardioversione elettrica e ricevono terapia antiaritmica
d) ACE-inibitori e ARB non sono raccomandati nella prevenzione secondaria della fibrillazione atriale parossistica in pazienti con non evidente patologia cardiaca.
Leggi anche:
- Differenza tra fibrillazione ventricolare ed arresto cardiaco
- Arresto cardiaco: conseguenze, cause, coma, terapia, cosa fare
- Fibrillazione ventricolare: cos’è, terapia, cause scatenanti, frequenza
- Tachicardia improvvisa: cosa fare, ansia, rimedi, valori, dopo i pasti
Terapia di controllo della frequenza cardiaca
La terapia di controllo della frequenza cardiaca nella fibrillazione atriale ha come obiettivo quello di ridurre la frequenza ventricolare elevata che da sola può comportare la presenza di sintomi e di instabilità emodinamica.
La riduzione della frequenza cardiaca nella fibrillazione atriale ad elevata frequenza ventricolare è spesso sufficiente a migliorare i sintomi.
Può essere considerata valida la riduzione della frequenza cardiaca nella fibrillazione atriale a circa 80 battiti per minuto a riposo e circa 110 battiti per minuto durante attività fisica moderata (Vaa Groenveld et al., 2010)
Il medico deve prendere altre decisioni terapeutiche nel paziente con fibrillazione atriale, deve valutare la presenza di patologie scatenanti che devono essere trattate con le terapie specifiche (infezioni, tireotossicosi, anemia, embolia polmonare, oltre che patologie cardiovascolari).
La terapia per il controllo della frequenza cardiaca nella fibrillazione atriale a lungo termine, in alternativa alla terapia di controllo del ritmo, deve essere decisa di comune accordo tra il medico e il paziente adeguatamente informato. Ambedue devono rinunciare alla terapia di controllo del ritmo, ma tale terapia può essere impostata qualora le successive valutazioni cliniche lo richiedessero (Linee guida ESC 2016) (Kirchhof et al., 2016).
Farmaci per il controllo della frequenza cardiaca in acuto
I farmaci per il controllo della frequenza cardiaca nella fibrillazione atriale in acuto sono:
Farmaci iniettabili endovena
- Betabloccanti: metoprololo ed esmololo
Vantaggi: rapidità di azione ed efficacia sul tono simpatico rispetto alla digoxina.
Svantaggi: controindicati nello scompenso cardiaco acuto e nel broncospasmo grave.
- Calcioantagonisti non diidropiridinici: diltiazem e verapamil
Vantaggi: rapidità di azione ed efficacia sul tono simpatico rispetto alla digoxina.
Svantaggi: possibili effetti negativi nei pazienti con insufficienza cardiaca (con frazione di eiezione 40%).
- Digitale: digoxina e digitossina
Vantaggi: può essere utilizzata nello scompenso cardiaco.
Svantaggi: controindicata nei pazienti con vie accessorie (vie anomale di conduzione atrio ventricolare – preeccitazione ventricolare) e cardiomiopatia ipertrofica e con ostruzione nel tratto di efflusso del ventricolo sinistro.
Vantaggi: può essere utilizzato in pazienti con grave insufficienza cardiaca.
Per ridurre la frequenza cardiaca nei pazienti con fibrillazione atriale al di sotto di 110 battiti per minuto si può valutare l’associazione di basse dosi di betabloccanti alla digoxina in caso di scompenso cardiaco congestizio con frazione di eiezione inferiore al 40%; in caso di scompenso cardiaco con frazione di eiezione superiore al 40% si possono associare betabloccanti o calcioantagonisti non diidropiridinici alla digoxina; in ambedue i casi esiste pericolo di bradicardia eccessiva (rallentamento eccessivo della frequenza cardiaca).
Farmaci per il controllo della frequenza cardiaca a lungo termine
I farmaci per il controllo della frequenza cardiaca nella fibrillazione atriale a lungo termine (linee guida ESC 2010-2016) sono (European Heart Rhythm Association et al., 2010; Kirchhof et al., 2016):
- Betabloccanti – I farmaci betabloccanti indicati dalle Linee guida ESC 2016 sono: bisoprololo, carvedilololo, metoprololo, nebivololo (sono disponibili altri farmaci betabloccanti, ma non sono raccomandati per il controllo della frequenza cardiaca nella fibrillazione atriale)
Vantaggi: a) riducono la frequenza cardiaca con conseguente riduzione dei sintomi e miglioramento funzionale; b) sono ben tollerati; c) non arrecano danni sia nei pazienti con ritmo sinusale che nei pazienti con fibrillazione atriale.
Svantaggi: a) sono controindicati nello scompenso cardiaco acuto; b) sono controindicati nel grave broncospasmo (asma bronchiale).
- Calcioantagonisti non diidropiridinici: diltiazem e verapamil
Vantaggi: riducono la frequenza cardiaca con conseguente riduzione dei sintomi e miglioramento funzionale.
Svantaggi: sono controindicati nei pazienti con scompenso cardiaco con ridotta frazione di eiezione per il loro effetto negativo sulla contrazione del muscolo cardiaco (effetto inotropo negativo).
- Digitale: digoxina e digitossina (farmaci usati da circa due secoli)
Vantaggi: sono utili nello scompenso cardiaco.
Svantaggi: alti livelli plasmatici sono a rischio di mortalità; è necessario adattare la dose nei pazienti con insufficienza renale.
Vantaggi: utile nei pazienti con vie accessorie (vie anomale di conduzione atrio-ventricolare o preeccitazione ventricolare) associata a fibrillazione atriale o ad anamnesi di fibrillazione atriale; è il farmaco da privilegiare per il controllo della frequenza cardiaca con il propafenone.
Svantaggi: numerosi effetti avversi extracardiaci (ultima risorsa per il controllo a lungo termine della fibrillazione atriale).
Vantaggi: utile nei pazienti con vie accessorie (vie anomale di conduzione atrio-ventricolare o preeccitazione ventricolare) associata a fibrillazione atriale o ad anamnesi di fibrillazione atriale è il farmaco da privilegiare per il controllo della frequenza cardiaca con l’amiodarone.
Terapia della fibrillazione atriale a frequenza ventricolare bassa: è una condizione clinica particolare che caratterizza malattie degenerative delle vie di conduzione elettrica del cuore, ma anche tossicità da farmaci. Una volta individuate le cause ne consegue la terapia
a) atropina endovena
b) Cardiostimolazione temporanea alla quale può fare seguito applicazione di pacemaker
L’ablazione del nodo atrio-ventricolare e l’impianto di pacemaker a frequenza tra 70 e 90 battiti per minuto può essere presa in considerazione in caso di fallimento della terapia di controllo del ritmo e della frequenza cardiaca.
Terapia di prevenzione del rischio tromboembolico a lungo termine
La prevenzione dell’ictus è tra i principali obiettivi della terapia nei pazienti con fibrillazione atriale (Linee guida ESC 2016). La terapia con anticoagulanti orali consente di ridurre notevolmente il rischio di ictus nei pazienti con fibrillazione atriale e tale terapia è utilizzata in tutte le forme di fibrillazione atriale.
Molti studi scientifici hanno avvalorato nel tempo e avvalorano l’impiego della terapia anticoagulante nel trattamento dei pazienti con fibrillazione atriale (Hart et al., 2007; Ruff et al., 2014). Dal confronto tra pazienti con fibrillazione atriale trattati con anticoagulanti orali, pazienti non trattati con anticoagulanti orali e pazienti trattati con acido acetilsalicilico (aspirina), è emerso che il rischio di ictus è ridotto in misura significativamente maggiore nei pazienti con fibrillazione atriale trattati con anticoagulanti orali rispetto agli altri due gruppi. La terapia con anticoagulanti orali non è scevra da rischi di sanguinamento, così come quella con acido acetilsalicilico, ma quest’ultimo non è in grado di prevenire l’ictus nei pazienti con fibrillazione atriale se confrontato con gli anticoagulanti orali.
Nonostante le evidenze scientifiche, la terapia con anticoagulanti orali è sottoutilizzata. Ciò è dovuto al timore di sanguinamento sia da parte del medico sia da parte del paziente, nonostante il rischio di ictus superi il rischio di emorragie, e alla necessità di frequenti esami del sangue per ottimizzare la terapia con anticoagulanti orali (mantenimento del valore dell’indice INR, International Normalized Ratio, nell’intervallo raccomandato, tra 2,0 e 3,0). A queste considerazioni si aggiunge la difficoltà da parte del paziente con fibrillazione atriale ad accettare terapie croniche, potenzialmente gravate da rischi, per evitare un rischio non presente, ma che si può verificare nel tempo nel corso della vita.
I pazienti con fibrillazione atriale maggiormente esposti al rischio di ictus dovrebbero essere sottoposti a terapia antitrombotica che protegge anche dal rischio trombo-embolico sistemico e dall’infarto del miocardio. Per l’individuazione dei pazienti con fibrillazione atriale maggiormente esposti a rischio di ictus le Linee guida ESC 2016 raccomandano di utilizzare il punteggio di rischio elaborato a seguito di grandi studi scientifici.
Per il calcolo del rischio di ictus nella fibrillazione atriale si utilizza il modello CHA2DS2-VASC.
CHA2DS2-VASC (Cardiac failure, Hypertension, Age ≥75 (doubled), Diabetes, Stroke (doubled), Vascular disease, Age 65-74, and Sex Category (female)) è l’acronimo in lingua inglese che sintetizza le condizioni cliniche, definite anche “fattori di rischio”, che pongono il paziente con fibrillazione atriale a rischio di ictus. Ad ogni fattore di rischio viene attribuito un punteggio come di seguito esposto:
a) Scompenso cardiaco evidenziato dai sintomi o dal riscontro di ridotta frazione di eiezione ventricolare sinistra (punteggio 1)
b) Ipertensione arteriosa con valori di pressione superiori a 140/90 o in terapia (punteggio 1)
c) Età oltre i 75 anni (punteggio 2)
d) Diabete identificato dalla glicemia a digiuno e superiore a 125 mg/ml o diabete in terapia (punteggio 1)
e) Precedente ictus cerebrale o attacco ischemico transitorio cerebrale (TIA) o tromboembolismo (punteggio 2)
f) Malattia vascolare, precedente infarto acuto del miocardio, arteriopatia periferica, placca aortica (punteggio 1)
g) Età 65-74 anni (punteggio 1)
h) Sesso femminile (punteggio 1)
I pazienti con fibrillazione atriale senza fattori di rischio di ictus non hanno bisogno di terapia antitrombotica.
I pazienti con fibrillazione atriale di sesso maschile con punteggio =/> 1 e le pazienti con fibrillazione atriale di sesso femminile con punteggio =/> 2 possono trarre vantaggio dalla terapia con anticoagulanti orali.
Sono in corso studi per valutare se sono utilizzabili marcatori biologici come la troponina ad alta sensibilità e il peptide natriuretico per definire ulteriormente il rischio di ictus e di emorragia nei pazienti con fibrillazione atriale.
Prima di prescrivere gli anticoagulanti orali nella fibrillazione atriale il medico deve calcolare anche il rischio emorragico oltre al rischio di ictus.
Gli anticoagulanti orali rendono il sangue meno coagulabile, di conseguenza riducono il rischio di formazione di trombi nel cuore e nei vasi sanguigni (arterie e vene).
La medicina dispone di due categorie di anticoagulanti orali ambedue efficaci per la prevenzione dell’ictus nella Fibrillazione atriale (Ruff et al., 2014)
- Antagonisti della vitamina K, in uso da molti anni (anticoagulanti orali o OAC, oral anticoagulants)
- Non antagonisti della vitamina K, di recente introduzione (anticoagulanti orali non vitamina K antagonisti o NOAC, new oral anticoagulants).
I NOAC ad alti dosaggi confrontati con il warfarin(principale anticoagulante antagonista della vitamina K) hanno dato i seguenti risultati:
a) riduzione significativa di ictus ed embolia sistemica del 19% a confronto con warfarin principalmente per riduzione di ictus emorragico
b) mortalità ridotta del 10%
c) emorragia intracranica dimezzata
d) sanguinamenti gastrointestinali più frequenti
Anticoagulanti antagonisti della Vitamina K
La vitamina K è introdotta nell’organismo con gli alimenti e in piccola parte viene prodotta dall’intestino. La vitamina K è necessaria per attivare alcuni fattori della coagulazione. Se la vitamina K viene antagonizzata i fattori della coagulazione da essa dipendenti non si attivano e il sangue diventa meno coagulabile.
Gli anticoagulanti orali antagonisti della vitamina K sono in uso da molto tempo per ridurre il rischio di ictus nei pazienti con fibrillazione atriale. Confrontati con l’acido acetilsalicilico (aspirina) (Hart et al., 2007a) riducono il rischio di ictus di due terzi e di mortalità di un quarto e analoghi risultati si ottengono rispetto ai controlli senza terapia.
Gli antagonisti della vitamina K sono i dicumarolici:
La riduzione della coagulabilità dipende dalla dose di farmaco ed è diversa da individuo a individuo. Se la dose e troppo bassa permane il rischio di formazione di trombi. Se la dose è troppo alta il rischio è l’emorragia.
La corretta anticoagulazione si valuta con il dosaggio nel sangue del tempo di protrombina o meglio dell’INR (International Normalized Ratio o rapporto internazionale normalizzato). L’INR è una tecnica che permette di standardizzare i risultati indipendentemente dal laboratorio che li ha eseguiti. Il valore di INR nella terapia con antagonisti della vitamina K nei pazienti con la fibrillazione atriale deve essere mantenuto tra 2 e 3; nei pazienti con fibrillazione atriale e protesi valvolari meccaniche deve essere mantenuto tra 2,5 e 3,5.
Gli antagonisti della vitamina K sono gli anticoagulanti di scelta nei pazienti con fibrillazione atriale valvolare o con protesi valvolare (Eikelboom et al., 2013).
Sono necessari frequenti esami del sangue per mantenere l’INR nei limiti terapeutici.
In caso di emorragie gravi e in caso di dosaggio eccessivo l’assunzione di vitamina K antagonizza gli anticoagulanti orali vitamina K dipendenti. Anche una dieta ricca di vitamina K esplica un effetto inibitorio sull’azione degli anticoagulanti orali vitamina K dipendenti. Gli alimenti ricchi di vitamina K comprendono: alghe, avocado, bietole, broccoli e cavoli, ceci, cime di rapa, crescione, erba cipollina, fegato, indivia, kiwi, lattuga, lenticchie, maionese, olii di colza di oliva e di soia, pesce sott’olio, prezzemolo, senape, soia, spinaci, tè nero e verde, verza.
Il paziente che assume anticoagulanti orali vitamina K dipendenti deve chiedere consiglio al medico e al farmacista prima di assumere altri medicinali e medicinali e preparati a base di erbe.
Anticoagulanti non antagonisti della vitamina K
I farmaci anticoagulanti non antagonisti della vitamina K comprendono:
- Dabigratan – inibitore diretto della trombina
- Apibaxan, Edobaxan e Rivarobaxan – inibitori del fattore di coagulazione Xa
I farmaci anticoagulanti non antagonisti della vitamina K sono idonei alla prevenzione dell’ictus nei pazienti con fibrillazione atriale perché hanno mostrato la non inferiorità se non addirittura vantaggi rispetto agli anticoagulanti antagonisti della vitamina K. I farmaci anticoagulanti non antagonisti della vitamina K riducono il rischio di ictus e di embolia sistemica insieme con la riduzione delle emorragie gravi, soprattutto intracraniche, come risulta dagli studi in cui sono stati confrontati con i farmaci anticoagulanti antagonisti della vitamina K (Linee guida ESC 2016) (Kirchhof et al., 2016).
Tutti i farmaci anticoagulanti non vitamina K antagonisti hanno il vantaggio di avere un effetto anticoagulante prevedibile e pertanto non necessitano di un regolare monitoraggio dell’anticoagulazione. In pratica il paziente con fibrillazione atriale che assume anticoagulanti non vitamina K antagonisti non avrà la necessità di sottoporsi a continui prelievi per il controllo della coagulazione (controllo dell’indice INR).
Inoltre tali farmaci non sono influenzati da altri medicinali, da alcol e alimenti; è importante però tenere sotto controllo la funzionalità renale ed è necessario adeguare la dose secondo la funzionalità renale.
Per il Dabigratan è disponibile l’antidoto Idarucizumab.
La terapia antiaggregante piastrinica (acido acetilsalicilico) e la doppia terapia antiaggregante piastrinica (acido acetilsalicilico+clopidogrel), come alternativa all’anticoagulazione, non sono raccomandate per la prevenzione dell’ictus nella fibrillazione atriale (Linee guida ESC 2016) per i seguenti motivi:
a) i vantaggi (prevenzione dell’ictus, dell’embolia sistemica, dell’infarto acuto del mio cardio, della morte vascolare) sono più elevati con gli anticoagulanti orali rispetto alla singola o alla doppia terapia antiaggregante piastrinica;
b) il rischio di sanguinamento è simile a quello con la terapia anticoagulante orale ed è ancora più evidente con la doppia antiaggregazione
Rischio di sanguinamento nei pazienti con fibrillazione atriale che devono assumere terapia anticoagulante orale
I pazienti con fibrillazione atriale che assumono la terapia anticoagulante orale hanno una prognosi migliore.
Il rischio di sanguinamento nel paziente con fibrillazione atriale deve essere considerato prima di prescrivere la terapia anticoagulante orale (TAO), insieme alla valutazione del rischio di ictus cerebrale.
Il rischio di sanguinamento può allontanare il medico e il paziente con fibrillazione atriale dal corretto utilizzo della terapia anticoagulante orale. La valutazione dei fattori di rischio di sanguinamento nel paziente con fibrillazione atriale, è pertanto utile sia per il paziente che per il medico, anche in considerazione del fatto che molti fattori di rischio di sanguinamento possono essere modificati. Modificare i fattori di rischio emorragico con opportune terapie o con la sostituzione di alcune terapie che interferiscono con la coagulazione consente al medico di prescrivere con maggiore sicurezza la terapia anticoagulante orale.
Per queste ragioni le linee guida 2016 per il trattamento della fibrillazione atriale, dopo aver analizzato numerosi studi scientifici, raccomandano di utilizzare uno schema che suddivide i fattori di rischio di sanguinamento in “modificabili” e “non modificabili”.
Rischi modificabili:
a) Ipertensione arteriosa non controllata con valori di pressione sistolica (massima) superiore a 160 mmHg
b) difficoltà a mantenere l’indice INR nei valori terapeutici (2-3)
c) Assunzione di terapia antiaggregante piastrinica e di FANS (farmaci anti infiammatori non steroidei)
d) Eccessivo uso di bevande alcoliche (superiore a otto bicchieri a settimana; l’alcol interferisce con il metabolismo epatico dei farmaci anticoagulanti orali rallentandone l’eliminazione)
Rischi potenzialmente modificabili:
a) Anemia
b) Insufficienza renale
c) Insufficienza epatica
d) Riduzione del numero e della funzione delle piastrine.
Rischi non modificabili:
a) Età
b) Storia clinica di sanguinamenti maggiori
c) Precedente ictus emorragico
d) Dialisi o trapianto renale
e) Cirrosi epatica
f) Tumori maligni
g) Fattori genetici
La vautazione dei fattori di rischio di sanguinamento può essere supportata dal dosaggio nel sangue di alcuni marcatori biologici:
a) troponina ad alta sensibilità (la troponina da molti anni viene dosata nel sangue per la diagnosi precoce di infarto del miocardio essendo il marcatore più specifico e quello che dura più a lungo. L’esame della troponina ad alta sensibilità misura la stessa proteina e ne rileva una quantità molto bassa)
b) GDF-15 (fattore di differenziazione della crescita) (citochina rilasciata in caso di ischemia o aumento di pressione intracardiaca)
c) creatinina serica e clearance della creatinina (esami che consentono lo studio della funzionalità renale)
d) peptide natriuretico (in corso di studio)
Sono da considerare anche tra i fattori di rischio di sanguinamento l’eccessivo rischio di traumi e le malattie neuropsichiatriche.
Raccomandazioni per limitare il sanguinamento in pazienti con fibrillazione atriale in terapia anticoagulante orale:
a) Sospensione della terapia anticoagulante orale in corso di grave emorragia in atto fino a che non si risolvono le cause del sanguinamento
b) Adeguare o iniziare la terapia dell’ipertensione arteriosa
c) Se si usa il dabigratan come anticoagulante orale si può ridurre la dose nei pazienti con più di 75 anni
d) Nei pazienti ad alto rischio di sanguinamento gastrointestinale, anticoagulanti vitamina K dipendenti o altro anticoagulante non vitamina K dipendente dovrebbe essere preferito al dabigratan, al rivaroxabane all’edoxaban
e) Consigli e trattamento per evitare l’eccesso di alcol devono essere considerati in tutti pazienti con fibrillazione atriale in terapia con anticoagulanti orali
f) Raccomandazioni dietetiche nei pazienti che assumono anticoagulanti vitamina K dipendenti (alcuni alimenti possono influenzare l’attività anticoagulante di questo tipo di farmaci)
g) Valutazione di farmaci per patologie intercorrenti da parte del medico
h) Dopo sanguinamento, in tutti i pazienti dovrebbe essere presa in considerazione la ripresa della terapia anticoagulante orale da un team di medici esperti multidisciplinare.
i) La maggior parte degli interventi cardiovascolari (coronarografia o impianto di pacemaker) può essere eseguita con sicurezza in corso di terapia anticoagulante orale
l) L’interruzione della terapia anticoagulante orale e la sostituzione temporanea con eparina (bridging) è utile nei pazienti con fibrillazione atriale e protesi valvolare
m) L’interruzione della terapia anticoagulante orale deve essere minimizzata per prevenire l’ictus
Terapia combinata di anticoagulanti orali e antiaggreganti piastrinici in pazienti selezionati:
a) La combinazione di queste terapie deve essere effettuata da specialisti
b) Può essere utilizzata per un mese la tripla terapia con acido acetilsalicilico, clopidogrel e anticoagulanti orali nei pazienti con fibrillazione atriale dopo stent coronarico (dispositivo meccanico dilatatore delle coronarie) per prevenire ictus e attacchi ischemici transitori (TIA, transient ischemic attack)
c) Dopo sindrome coronarica acuta con impianto di stent, la tripla terapia può essere considerata per periodi fino a sei mesi
d) Dopo sindrome coronarica acuta senza stent la doppia terapia anticoagulante – anticoagulanti orali più acido acetilsalicilico oppure anticoagulanti orali più clopidogrel – dovrebbe essere continuata fino a 12 mesi
e) La doppia e la tripla terapia devono essere limitati a brevi periodi dopo valutazione di rischi e benefici
Per ridurre il rischio di emorragia le Linee guida ESC 2016 suggeriscono i seguenti trattamenti in tutti i pazienti con emorragia in atto (Kirchhof et al., 2016):
a) Tamponare l’emorragia meccanicamente quando possibile
b) Valutare e mettere sotto controllo lo stato emodinamico, la pressione arteriosa, i parametri della coagulazione, l’emocromo, la funzione renale
c) Nelle emorragie gravi valutare la somministrazione di antidoti e, se non disponibili, somministrare concentrati del complesso protrombinico o plasma fresco o piastrine se necessario, fluidoterapia, trasfusione di sangue e trattare le cause (es. gastroscopia)
d) Valutare la ripresa della terapia anticoagulante da parte di specialisti esperti
Chirurgia della fibrillazione atriale
Il trattamento chirurgico della fibrillazione atriale si attua tramite l’ablazione, tecnica interventistica che mira a isolare, inattivare e/o distruggere le fibre situate tra l’atrio sinistro e l’interno delle vene polmonari dotate di attività elettrica anomala, rapida e irregolare, che innescano la fibrillazione atriale. La tecnica prevede il riscaldamento o il raffreddamento delle fibre anomale raggiunte da un catetere o tramite intervento cardiochirurgico. Si procede ad ablazione con corrente alternata ad alta frequenza per il riscaldamento o ad ablazione con palloncino (cryoballoon) per la refrigerazione.
L’ablazione con catetere nella fibrillazione atriale è utilizzata per il ripristino e il mantenimento del ritmo sinusale. La decisione di intervenire con l’ablazione dipende dal tipo di fibrillazione atriale e viene valutata in centri specializzati.
Pazienti selezionati possono trarre vantaggio dall’ablazione del nodo atrio-ventricolare o del fascio di His, per ottenere il controllo della frequenza cardiaca. L’intervento è definitivo ed è preceduto dall’impianto di un pacemaker; si utilizza più frequentemente l’ablazione transcatetere con radiofrequenza come fonte di energia (Linee guida ESC 2010) (European Heart Rhythm Association et al., 2010). Con questa tecnica vengono bloccati gli impulsi elettrici a frequenza elevata che provengono dagli atri mentre i ventricoli continuano a contrarsi (anche dai ventricoli si possono generare impulsi efficienti, la cui frequenza però è troppo bassa). Per consentire una frequenza ventricolare valida deve essere impiantato in precedenza un pacemaker. La procedura è irreversibile.
L’escissione chirurgica e l’occlusione chirurgica per via transfemorale sono interventi orientati a proteggere il paziente con fibrillazione atriale che non può assumere anticoagulanti orali per la protezione dall’ictus e i pazienti che hanno presentato ictus nonostante la terapia anticoagulante.
Questi interventi devono essere ulteriormente studiati perché potrebbero aumentare il rischio di ictus per incompleta chiusura dell’auricola sinistra (piccola struttura di forma variabile che comunica con l’atrio sinistro da cui possono originare trombi causa di ictus in pazienti con fibrillazione atriale) (Linee guida ESC 2016) (Kirchhof et al., 2016).
Pazienti particolari con fibrillazione atriale
I pazienti con sindrome di Wolff-Parkinson-White e con altre forme di preeccittazione ventricolare presentano vie accessorie anomale di conduzione elettrica. In questi pazienti sono controindicati i farmaci digoxina, verapamil e diltiazem (Manolis, Estes, 1987) e deve essere usato con cautela l’amiodarone endovena per la possibilità di ritmi accelerati e fibrillazione ventricolare (Simonian et al., 2010).
Possono essere utilizzati endovena procainamide, propafenone e ajmalina per ridurre la frequenza cardiaca ventricolare (Boahene et al, 1990; O’Nunain et al., 1991).
Nei pazienti con via accessoria si raccomanda l’ablazione transcatetere della via accessoria quando documentabile (Tischenko et al., 2008).
Altre situazioni specifiche quali pazienti anziani, pazienti con una cardiomiopatia ipertrofica, canalopatie, cardiomiopatia aritmogena del ventricolo destro, sportivi, donne in gravidanza, pazienti che hanno subito o devono subire interventi chirurgici, pazienti con cardiopatie congenite, pazienti con insufficienza respiratoria, con insufficienza renale, devono essere esaminati in centri specializzati per le loro specificità.
Farmaci nella fibrillazione atriale
Anticoagulanti orali antagonisti della vitamina K
- Acenocumarolo (Sintrom)
- Warfarin (Coumadin)
Anticoagulanti orali non antagonisti della vitamina K
- Apixaban (Eliquis)
- Dabigratan etexilato (Pradaxa)
- Edoxaban (Lixiana)
- Rivaroxaban (Xarelto)
Antidoti
- Antidoto anticoagulanti orali vitamina K dipendenti (Vitamina K)
- Antidoto Dabigratan: Idarucizumab (Praxbind)
Antiaritmici
- Amiodarone (Amiodarone, Amiodar, Cordarone)
- Idrochinidina (Idrochinidina Lirca, Idrochinidina Ritardo Lircaps)
- Disopiramide (Ritmodan)
- Dofetilide (Tikosyn)
- Dronedarone (Multaq)
- Flecainide (Almarytm, Flecainide, Fleiderina, Frequil)
- Ibutilide (Corvert)
- Procainamide (Procainamide Cloridrato)
- Propafenone (Propafenone, Rytmonorm)
- Vernakalant (Brinavess)
Betabloccanti
- Bisoprololo (Bisoprololo, Cardicor, Concor, Congescor, Lodoz, Pluscor, Sequacor)
- Carvedilolo (Acarden, Caravel, Carvedilolo, Carvipress, Colver, Curcix, Dilatrend, Omeria, Trakor)
- Esmololo (Brevibloc, Brevinti)
- Metoprololo (Lopresor, Metoprololo, Seloken)
- Nebivololo (Lobivon, Nebilox, Nebiscon, Nebivololo, Nobistar)
Calcio antagonisti non diidropiridinici
- Diltiazem (Altiazem, Angizem, Diladel, diltiazem, Dilzene, Tildiem)
- Verapamil (Verapamil, Isoptin)
Digitalici
- Digossina o digoxina (Eudigox, Lanoxin)
- Metildigossina (Lanitop)
Altri
FONTE Pharmamedix
Leggi anche:
- Differenza tra tachicardia, aritmia, bradicardia e alloritmia
- Differenza tra cardioversione spontanea, elettrica e farmacologica
- Il defibrillatore non funziona: muore a 51 anni per un infarto
- Ritmo sinusale ECG: normofrequente, tachicardico, valori, ai limiti della norma
- Pugno precordiale sul petto: significato, quando farlo, linee guida
- Defibrillatore: cos’è, come funziona, prezzo, voltaggio, manuale ed esterno
- Bradicardia: sintomi, conseguenze, rimedi, notturna e grave
- Fibrillazione atriale: terapia, rischi, cosa fare, ECG, quando preoccuparsi
- Fibrillazione atriale: parossistica, persistente e cronica
- Respirazione artificiale bocca a bocca: quando farla e come farla
- Massaggio cardiaco: quando farlo e come farlo [LINEE GUIDA]
- Massaggio cardiaco: quante compressioni al minuto?
- Il massaggio cardiaco si esegue in assenza di…
- Aritmia cardiaca: cause e fattori di rischio, sintomi, diagnosi e cura
- Elettrocardiogramma (ECG) a riposo e sotto sforzo: cos’è ed a che serve?
- Com’è fatto il cuore, a che serve e come funziona?
- ECG: cosa indicano le onde P, T, U, il complesso QRS ed il segmento ST
- Come si muove l’impulso elettrico cardiaco nel cuore?
- Perché il cuore si trova a sinistra e non a destra nel torace?
- Malattie cardiovascolari: i 10 comandamenti del cuore in salute
- Quanto pesa e quanto sangue contiene un cuore?
- Differenza tra pressione arteriosa e venosa
- Differenza tra pressione massima (sistolica), minima (diastolica) e differenziale
- Differenza tra sintomo e segno con esempi
- Cos’è un infarto e quanti tipi di infarto conosci?
- Differenza tra attacco di cuore (infarto del miocardio) ed arresto cardiaco
- Differenza tra infarto cardiaco, infarto miocardico e attacco di cuore
- Pressione arteriosa: valori normali e patologici
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure
- Perché la pressione arteriosa alta (ipertensione) è pericolosa?
- Ecocolordoppler: cos’è, a che serve e come funziona?
- Ecocolordoppler arterioso e venoso degli arti inferiori e superiori
- Effetto Doppler: cos’è e come viene usato in campo medico?
- Ecocardiogramma per via transesofagea: preparazione, è doloroso?
- Differenza tra ecocardiografia ed elettrocardiogramma
- Ecocardiogramma da stress (ecostress) fisico e farmacologico: come si svolge, è pericoloso?
- Endocardite batterica: profilassi in bambini ed adulti
- Riduzione della riserva coronarica: cos’è e come si studia
- Ecocolordoppler dei tronchi sovraortici: come si effettua e quali patologie studia
- Doppler transcranico: a che serve, è pericoloso o doloroso?
- Ipertensione: cibi consigliati e da evitare per abbassare la pressione sanguigna
- Qual è la differenza tra arteria e vena?
- Come si muove il sangue all’interno del cuore?
- Fattori di rischio cardiovascolare modificabili e non modificabili
- Sistole e diastole nel ciclo cardiaco: fasi durata e spiegazione
- Che differenza c’è tra sistole e diastole?
- Insufficienza della valvola mitralica lieve, moderata, severa: sintomi, diagnosi e terapia
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Condividi questo articolo:
 Con cardioversione si intende è una particolare procedura che si esegue in campo medico quando un soggetto ha una aritmia, cioè una alterazione del ritmo cardiaco normale (ritmo sinusale), al fine di ripristinarlo evitando pericolose complicazioni che possono portare anche a decesso del paziente. La cardioversione può essere:
Con cardioversione si intende è una particolare procedura che si esegue in campo medico quando un soggetto ha una aritmia, cioè una alterazione del ritmo cardiaco normale (ritmo sinusale), al fine di ripristinarlo evitando pericolose complicazioni che possono portare anche a decesso del paziente. La cardioversione può essere:
 La Sindrome di Wolff Parkinson White (WPW, in lingua inglese “Wolff–Parkinson–White Syndrome”) è una patologia caratterizzata da anomala conduzione dell’impulso elettrico cardiaco e determinata dalla presenza di uno o più fasci atrio-ventricolari accessori, che possono dare origine ad episodi di tachicardia sporadica. La malattia, ad eziologia ancora non del tutto chiara, colpisce una persona su 450; nel 70% dei casi interessa i maschi, specie in giovane età, e può presentarsi sia in forma sporadica che famigliare ed essere silente dal punto di vista sintomatico. I neonati da genitori con la sindrome di WPW possono essere a maggior rischio di sviluppare la malattia come pure i neonati con altri difetti cardiaci congeniti.
La Sindrome di Wolff Parkinson White (WPW, in lingua inglese “Wolff–Parkinson–White Syndrome”) è una patologia caratterizzata da anomala conduzione dell’impulso elettrico cardiaco e determinata dalla presenza di uno o più fasci atrio-ventricolari accessori, che possono dare origine ad episodi di tachicardia sporadica. La malattia, ad eziologia ancora non del tutto chiara, colpisce una persona su 450; nel 70% dei casi interessa i maschi, specie in giovane età, e può presentarsi sia in forma sporadica che famigliare ed essere silente dal punto di vista sintomatico. I neonati da genitori con la sindrome di WPW possono essere a maggior rischio di sviluppare la malattia come pure i neonati con altri difetti cardiaci congeniti. La terapia della fibrillazione atriale deve essere praticata d’urgenza in caso di presenza di sintomi. Si articola in procedimenti distinti che devono essere selezionati e attuati contemporaneamente o anche in rapida successione a seconda delle condizioni cliniche del paziente.
La terapia della fibrillazione atriale deve essere praticata d’urgenza in caso di presenza di sintomi. Si articola in procedimenti distinti che devono essere selezionati e attuati contemporaneamente o anche in rapida successione a seconda delle condizioni cliniche del paziente. La tachicardia è una aritmia caratterizzata da aumento della frequenza dei battiti cardiaci e pulsazioni sopra i 100 battiti al minuto quando il soggetto è a riposo. La tachicardia non indica necessariamente la presenza
La tachicardia è una aritmia caratterizzata da aumento della frequenza dei battiti cardiaci e pulsazioni sopra i 100 battiti al minuto quando il soggetto è a riposo. La tachicardia non indica necessariamente la presenza  La contrazione perfettamente sincronizzata delle varie parti del cuore e la corretta frequenza cardiaca, sono determinate da un impulso elettrico che nasce in un dato punto del cuore e si propaga all’interno di esso in modo da contrarre atri e ventricoli in modo adeguato. Tale impulso nasce dal nodo del seno (o senoatriale), il pacemaker naturale del cuore, localizzato in prossimità dello sbocco della vena cava nell’atrio destro, una parte del corpo il cui malfunzionamento determina aritmia e – in alcuni casi – rende necessario l’impianto di un pacemaker artificiale.
La contrazione perfettamente sincronizzata delle varie parti del cuore e la corretta frequenza cardiaca, sono determinate da un impulso elettrico che nasce in un dato punto del cuore e si propaga all’interno di esso in modo da contrarre atri e ventricoli in modo adeguato. Tale impulso nasce dal nodo del seno (o senoatriale), il pacemaker naturale del cuore, localizzato in prossimità dello sbocco della vena cava nell’atrio destro, una parte del corpo il cui malfunzionamento determina aritmia e – in alcuni casi – rende necessario l’impianto di un pacemaker artificiale.
 I farmaci antiaritmici sono farmaci utilizzati per prevenire o per correggere le aritmie, cioè quelle condizioni in cui è alterato il normale ritmo cardiaco.
I farmaci antiaritmici sono farmaci utilizzati per prevenire o per correggere le aritmie, cioè quelle condizioni in cui è alterato il normale ritmo cardiaco.
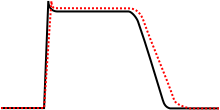
 L’effetto dei farmaci della classe IA sul potenziale d’azione
L’effetto dei farmaci della classe IA sul potenziale d’azione L’effetto dei farmaci della classe IB sul potenziale d’azione
L’effetto dei farmaci della classe IB sul potenziale d’azione
 La manovra di Valsalva è una manovra di compensazione forzata dell’orecchio medio, utilizzata principalmente in medicina, specialmente in campo otorinolaringoiatrico e cardiologico, ma anche in campo subacqueo, nei casi in cui si desideri aprire forzatamente la
La manovra di Valsalva è una manovra di compensazione forzata dell’orecchio medio, utilizzata principalmente in medicina, specialmente in campo otorinolaringoiatrico e cardiologico, ma anche in campo subacqueo, nei casi in cui si desideri aprire forzatamente la  Il cuore è un muscolo che ha come compito fondamentale quello di far circolare il sangue in tutto il corpo. In esso è presente un circuito elettrico, detto sistema eccito-conduzione, che attiva e regola la contrazione cardiaca. Normalmente la frequenza cardiaca varia tra i 60 e i 100 battiti al minuto e le contrazioni si susseguono in modo regolare e ritmico, con solo leggere variazioni fisiologiche legate alla respirazione (i battiti tendono a rallentare durante una espirazione profonda).
Il cuore è un muscolo che ha come compito fondamentale quello di far circolare il sangue in tutto il corpo. In esso è presente un circuito elettrico, detto sistema eccito-conduzione, che attiva e regola la contrazione cardiaca. Normalmente la frequenza cardiaca varia tra i 60 e i 100 battiti al minuto e le contrazioni si susseguono in modo regolare e ritmico, con solo leggere variazioni fisiologiche legate alla respirazione (i battiti tendono a rallentare durante una espirazione profonda).