 Con “fluido” in chimica si definisce un materiale (generalmente costituito da una sostanza o da una miscela di più sostanze) che si deforma illimitatamente (fluisce) se sottoposto a uno sforzo di taglio, indipendentemente dall’entità di quest’ultimo. Il fluido è un particolare stato della materia che comprende
Con “fluido” in chimica si definisce un materiale (generalmente costituito da una sostanza o da una miscela di più sostanze) che si deforma illimitatamente (fluisce) se sottoposto a uno sforzo di taglio, indipendentemente dall’entità di quest’ultimo. Il fluido è un particolare stato della materia che comprende
- i liquidi;
- gli aeriformi (i gas);
- il plasma;
- alcuni solidi plastici.
Con “liquido” in chimica si indica uno degli stati della materia, insieme a “solido” ed aeriforme (gas). Le sue proprietà principali sono: fluidità, elasticità ed incomprimibilità. Generalmente, una sostanza allo stato liquido è meno densa che allo stato solido, ma un’importante eccezione è costituita dall’acqua.
Da quanto detto appare chiaro che i liquidi fanno parte della grande famiglia dei fluidi: tutti i liquidi sono fluidi, ma non tutti i fluidi sono dei liquidi.
Consideriamo ad esempio un tipo particolare fluido: un gas. Il gas è un fluido, tuttavia non è un liquido, bensì è allo stato aeriforme. Immesso in un dato contenitore, il gas lo occupa tutto mentre invece, un altro particolare fluido, un liquido, ne occupa solo una parte, perché i liquidi mantengono il loro volume, i gas invece no.
Sinteticamente si può concludere dicendo che i liquidi sono quei particolari fluidi che mantengono il loro volume.
Leggi anche:
- Differenza tra densità e viscosità di un fluido con esempi
- Liquido in chimica: definizione e caratteristiche fisiche
- Differenza tra liquidi volatili e non volatili in chimica
- Differenza tra fluido newtoniano e non newtoniano con esempi
- Differenza tra fluido ideale e reale
- Differenza tra soluzione ipertonica, ipotonica ed isotonica in chimica
- Differenza tra soluzione, sospensione aerosol ed emulsione in chimica
- Differenza tra soluzione e miscuglio in chimica con esempi
- Differenza tra soluzione e miscela in chimica con esempi
- Differenza tra miscela omogenea ed eterogenea
- Differenza tra soluzione e dispersione in chimica con esempi
- Cos’è la densità in chimica? Densità di acqua ed aria a varie temperature
- Massa e peso di un corpo sulla Luna rispetto alla Terra
- Massa e peso sui vari pianeti del Sistema Solare rispetto alla Terra
- Differenza tra densità e peso specifico
- Differenza tra densità reale ed assoluta con esempi
- Differenza tra elemento, composto e miscuglio con esempi
- Differenza tra miscuglio omogeneo ed eterogeneo con esempi
- Differenza tra aldosi e chetosi con esempi
- Esempio di esercizio svolto sul calcolo della densità
- Differenza tra densità e concentrazione
- Differenza tra massa e peso in fisica ed in medicina
- Quanto pesa un litro di acqua liquida o ghiacciata?
- Differenza tra acqua distillata e demineralizzata e loro usi
- E’ più difficile e pesante nuotare a mare o in piscina?
- Perché l’acqua di mare non si può bere?
- Differenza tra pressione idrostatica, oncotica ed osmotica
- Differenza tra orbita ed orbitale (in chimica ed astronomia)
- Differenza tra elettrone, fotone, protone e ione
- Differenza tra acidi e basi
- Differenza tra stella, pianeta e satellite con esempi
- Perché l’acqua di mare è salata?
- Quante volte l’uomo è stato sulla Luna?
- Perché si verificano le maree?
- Perché la luna ci rivolge sempre la stessa faccia? Com’è il lato oscuro?
- Cos’è una eclissi solare? Come e quando si verifica?
- Vi spiego come far entrare sette miliardi di persone nello spazio di una palla da tennis
- Quante persone vivono a Roma, in Italia, in Europa e nel mondo?
- Teoria del Tempo Fantasma: 297 anni di storia non sono mai esistiti, ora siamo nel 1717
- Cosa sono e qual è la differenza tra massa magra e massa grassa? Tutte le percentuali di grasso, ossa e muscoli
- Un atomo si può dividere? Cosa succede se si divide?
- Differenza tra atomo e molecola con esempi
- Differenza tra atomi e ioni e regola dell’ottetto
- Differenza tra atomo e elemento
- Differenza tra atomo e nucleo
- Differenza tra anfipatica ed anfotera
- Differenze tra H2O e H2S in chimica
- Differenze e punti in comune tra chimica e fisica
- Differenza tra fisica classica e quantistica
- Differenza tra fisica classica e meccanica quantistica
- Differenza tra microscopio ottico ed elettronico
- Differenza tra microscopio elettronico a scansione e a trasmissione
- Differenza tra raggi x e gamma
- L’uomo più grasso del mondo pesa 368 kg
- Lina Medina è la mamma più giovane al mondo: ha partorito il suo primo figlio a 5 anni
- La persona più intelligente al mondo mai esistita nella storia dell’uomo
- Jon Brower Minnoch: quanto è arrivato a pesare l’uomo più grasso del mondo?
- Le 20 droghe più potenti e pericolose al mondo
- Lo scivolo trasparente più alto e pauroso del mondo
- Valeria Levitina pesa 25 kg: è la ragazza più anoressica del mondo [VIDEO]
- Differenza tra eclissi solare e lunare (spiegazione semplice)
- Differenza tra eclissi totale, parziale, anulare e penombrale
- Com’è fatta la tuta degli astronauti?
- Cos’è una galassia? Di cosa è fatta?
- Cos’è e dove si trova la Stella Polare? Come individuarla?
- Cos’è una eclissi lunare? Come e quando si verifica?
- Perché la notte di San Lorenzo cadono le stelle? Cos’è una stella cadente?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
 Si risolva il seguente esercizio:
Si risolva il seguente esercizio: La densità di un materiale è il rapporto tra la sua massa ed il suo volume (cioè massa diviso volume); l’unità di misura della densità è il kg/m³. Nell’uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³.
La densità di un materiale è il rapporto tra la sua massa ed il suo volume (cioè massa diviso volume); l’unità di misura della densità è il kg/m³. Nell’uso comune si utilizza talvolta il kg/litro (kg/dm³), che corrisponde esattamente al g/cm³. Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche. In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità. Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
Si definisce “soluzione” in chimica una miscela omogenea in cui una o più sostanze sono contenute in una fase liquida o solida o gassosa; una soluzione contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri. La misura della quantità di soluto rispetto alla quantità di soluzione è detta concentrazione e viene misurata sia tramite unità fisiche che tramite unità chimiche. In una soluzione viene denominato solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità. Una soluzione consiste quindi in una miscela di due o più componenti che formano una dispersione molecolare omogenea in una sola fase fisica. Ricordiamo che la “fase” in chimica indica una porzione di materia che, ad occhio nudo o al microscopio ottico, presenta in ogni suo punto le medesime proprietà fisiche e chimiche.
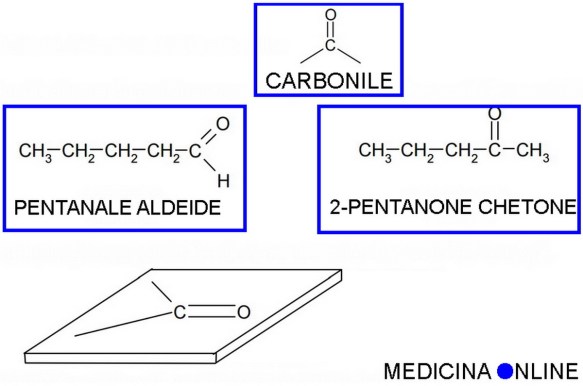 Sia le aldeidi (aventi formula generale RCHO) che i chetoni (aventi formula generale RCOR) sono composti organici caratterizzati dalla presenza di un gruppo funzionale caratteristico, il CARBONILE:
Sia le aldeidi (aventi formula generale RCHO) che i chetoni (aventi formula generale RCOR) sono composti organici caratterizzati dalla presenza di un gruppo funzionale caratteristico, il CARBONILE: