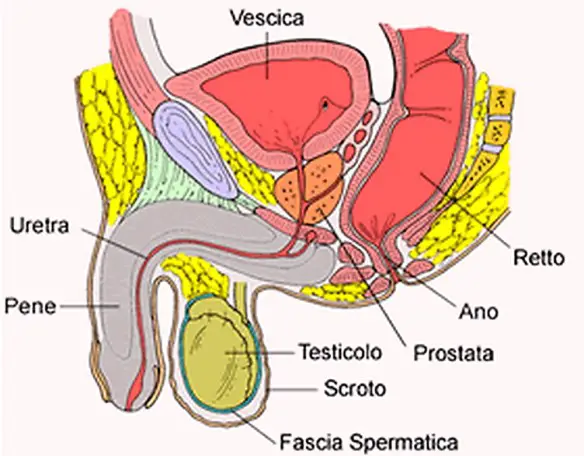
 Per carcinoma della prostata si intende una categoria diagnostica che annovera le neoplasie maligne che si originano dalle cellule epiteliali della prostata, una ghiandola dell’apparato genitale maschile. Questa neoplasia può dare luogo a metastasi, con predilezione per le ossa e i linfonodi loco-regionali. Il tumore alla prostata può causare dolore, difficoltà alla minzione, disfunzione erettile e altri sintomi.
Per carcinoma della prostata si intende una categoria diagnostica che annovera le neoplasie maligne che si originano dalle cellule epiteliali della prostata, una ghiandola dell’apparato genitale maschile. Questa neoplasia può dare luogo a metastasi, con predilezione per le ossa e i linfonodi loco-regionali. Il tumore alla prostata può causare dolore, difficoltà alla minzione, disfunzione erettile e altri sintomi.
Eiaculazioni frequenti e cancro alla prostata
Uno studio del 2003 indica che eiaculazioni regolari possono avere un ruolo nella prevenzione del tumore della prostata. Altri studi, tuttavia: non rilevano un’associazione significativa tra i due fattori. Questi risultati hanno comunque contraddetto precedenti studi i quali suggerivano che aver avuto numerosi partner sessuali o comunque un’elevata attività sessuale incrementerebbe il rischio di carcinoma prostatico del 40%. Una differenza chiave può essere che questi precedenti studi definivano l’attività sessuale come il rapporto sessuale, mentre quelli più recenti si sono concentrati più sul numero di eiaculazioni avvenute con o senza rapporti sessuali. Un ulteriore studio risalente al 2004 riporta che: “La maggior parte delle categorie di persone con una elevata frequenza di eiaculazione si sono dimostrate non correlate al rischio di cancro alla prostata. Tuttavia, la frequenza di eiaculazione alta è correlata a diminuzione del rischio totale di cancro alla prostata”. L’abstract della relazione ha concluso che: “I nostri risultati suggeriscono che la frequenza di eiaculazione non è correlata a un aumento del rischio di cancro alla prostata”.
Leggi anche:
Cause
Le cause specifiche del cancro alla prostata rimangono ancora sconosciute. I primi fattori di rischio sono comunque l’età e la storia familiare. Il cancro alla prostata è molto raro negli uomini sotto i 45 anni, ma diventa più frequente all’aumentare dell’età. L’età media dei pazienti al momento della diagnosi è di 70 anni. Comunque molti uomini non vengono mai a conoscenza di avere questo tipo di tumore. Gli esami autoptici effettuati su uomini cinesi, tedeschi, israeliani, giamaicani, svedesi e ugandesi, morti per cause differenti, hanno evidenziato la presenza di un cancro alla prostata nel 30% dei casi sotto i 50 anni e nell’80% sopra i 70. Gli uomini che hanno un familiare di primo grado che ha avuto questo tipo di tumore, hanno il doppio del rischio di svilupparlo rispetto agli uomini che non hanno avuto malati in famiglia. Il rischio appare maggiore per gli uomini che hanno un fratello con questo cancro rispetto a quelli che hanno solo il padre.
Sintomi
Un carcinoma della prostata in fase precoce di solito non dà luogo a sintomi. Spesso viene diagnosticato in seguito al riscontro di un livello elevato di PSA durante un controllo di routine. Talvolta, tuttavia, il carcinoma causa dei problemi, spesso simili a quelli che intervengono nella ipertrofia prostatica benigna; essi includono pollachiuria, nicturia, difficoltà a iniziare la minzione e a mantenere un getto costante, ematuria, stranguria. Può anche causare problemi nella funzione sessuale, come difficoltà a raggiungere l’erezione, e eiaculazione dolorosa. In stadio avanzato può causare sintomi addizionali quando si diffonde ad altre parti del corpo. Il sintomo più comune è il dolore osseo, spesso localizzato alle vertebre, alla pelvi o alle costole, e causato da metastasi in queste sedi. La localizzazione vertebrale può indurre compressione al midollo spinale, causando debolezza alle gambe e incontinenza urinaria e fecale.
Screening
Lo screening oncologico è un metodo per scoprire tumori non diagnosticati. I test di screening possono indurre a ricorrere a esami più specifici, come la biopsia. Le scelte diagnostiche di screening nel caso del tumore della prostata comprendono l’esame rettale e il dosaggio del PSA. È controversa la validità degli esami di screening, poiché non è chiaro se i benefici che ne derivano sopravanzino i rischi degli esami diagnostici successivi e della terapia antitumorale. Il tumore della prostata è un tumore a crescita lenta, molto comune fra gli uomini anziani. Infatti in maggioranza i tumori della prostata non crescono abbastanza per dare luogo a sintomi, e i pazienti muoiono per cause diverse. Il dosaggio del PSA può svelare questi piccoli tumori che non avrebbero altrimenti avuto modo di manifestarsi; uno screening del genere può quindi condurre a un numero eccessivo di diagnosi, con la relativa sequela di test ulteriori e di terapie. La biopsia può causare dolore, sanguinamento e infezioni; le terapie possono causare incontinenza urinaria e disfunzioni erettili. Dunque è essenziale che vengano considerati i rischi e i benefici prima di intraprendere uno screening utilizzando il dosaggio del PSA. In genere gli screening iniziano dopo i 50 anni di età, ma possono essere proposti prima negli uomini di colore e in quelli con una forte storia familiare di tumori alla prostata
Esame rettale
L’esame rettale digitale è una procedura in cui l’esaminatore inserisce un dito guantato e lubrificato nel retto del paziente, allo scopo di valutare le dimensioni, la forma e la consistenza della prostata: zone irregolari, dure o bozzolute devono essere sottoposte a ulteriori valutazioni, perché potrebbero essere indicative di tumore. L’esame rettale è in grado di valutare solo la parte posteriore della prostata, ma fortunatamente l’85% dei tumori ha origine proprio in questa parte. In genere dà modo di apprezzare tumori già in stadio avanzato. Non è mai stato dimostrato che, come unico test di screening, l’esame rettale sia in grado di ridurre il tasso di mortalità.
Leggi anche:
Dosaggio del PSA
Il dosaggio del PSA misura il livello ematico di un enzima prodotto dalla prostata. Livelli di PSA sotto 4 ng/mL (nanogrammi per millilitro) sono generalmente considerati normali, mentre livelli sopra i 4 ng/mL sono considerati anormali (sebbene negli uomini oltre i 65 anni livelli fino a 6,5 ng/mL possono essere accettabili, in dipendenza dai parametri di riferimento di ciascun laboratorio). Livelli di PSA tra 4 e 10 ng/mL indicano un rischio di tumore più alto del normale, ma il rischio stesso non sembra direttamente proporzionale al livello. Quando il PSA è sopra i 10 ng/mL, l’associazione col tumore diventa più forte, tuttavia quello del PSA non è un test perfetto.
La valutazione del PSA può essere effettuata anche a casa, usando un test pratico ed affidabile come quello consigliato dal nostro Staff medico: http://amzn.to/2nV1m4h
Alcuni uomini con tumore prostatico in atto non hanno livelli elevati di PSA, e la maggioranza di uomini con un elevato PSA non ha un tumore. Oggi è possibile dosare un ulteriore marcatore per il carcinoma prostatico, il PCA3 (prostate cancer gene 3); l’iperespressione di questo gene (valutabile mediante dosaggio del mRNA nelle urine) è strettamente associata alla trasformazione maligna delle cellule della prostata. Il dosaggio è quindi particolarmente utile nei pazienti già sottoposti a biopsia, per predire l’evoluzione del tumore. Per approfondire leggi anche: PSA totale e free alto: capire i risultati dell’esame e rischio di tumore alla prostata
Cistoscopia e biopsia
Quando si sospetta un carcinoma prostatico, o un esame di screening è indicativo di un rischio aumentato, si prospetta una valutazione più invasiva. L’unico esame in grado di confermare pienamente la diagnosi è la biopsia, ossia l’asportazione di piccoli frammenti di tessuto per l’esame al microscopio. Tuttavia, prima che alla biopsia, si può ricorrere a metodiche meno invasive per raccogliere informazioni riguardo alla prostata e al tratto urinario: la cistoscopia mostra il tratto urinario a partire dall’interno della vescica usando un piccolo endoscopio inserito nell’uretra; l’ecografia transrettale disegna un’immagine della prostata tramite gli ultrasuoni emessi da una sonda inserita nel retto. Se si sospetta un tumore si ricorre alla biopsia. Con essa si ottengono campioni di tessuto dalla prostata tramite il retto: una pistola da biopsia inserisce e quindi rimuove speciali aghi a punta cava (di solito da tre a sei per ogni lato della prostata) in meno di un secondo. I campioni di tessuto vengono quindi esaminati al microscopio per determinare la presenza di tumore, valutarne gli aspetti istomorfologici (grading secondo il Gleason score system). In genere le biopsie prostatiche vengono eseguite ambulatorialmente e di rado richiedono l’ospedalizzazione. Il 55% degli uomini riferisce malessere durante la procedura. Uno studio portato a termine nel 2003 dall’Istituto scientifico universitario San Raffaele ha dimostrato l’efficacia dell’utilizzo della tomografia a emissione di positroni (PET) con il tracciante C-Colina, come esame per individuare recidive del tumore alla prostata. Questo esame è consigliato nei pazienti che hanno già subito un trattamento radicale del tumore e a cui si è rilevato un valore del marcatore PSA tale da far pensare a una ripresa della malattia. Grazie alla PET è possibile, inoltre, differenziare una diagnosi di cancro alla prostata da una iperplasia benigna, da una prostatite cronica e da un tessuto prostatico sano.
Stadiazione
Una parte importante della valutazione diagnostica è la stadiazione, ossia il determinare le strutture e gli organi interessati dal tumore. Determinare lo stadio aiuta a definire la prognosi e a selezionare le terapie. Il sistema più comune è il sistema a quattro stadi TNM (abbreviazione da Tumore/LinfoNodi/Metastasi), che prevede di considerare le dimensioni del tumore, il numero di linfonodi coinvolti e la presenza di metastasi.
La distinzione più importante operata da qualsiasi sistema di stadiazione è se il tumore è o meno confinato alla prostata. Diversi esami sono disponibili per evidenziare una valutazione in questo senso, e includono la TAC per valutare la diffusione nella pelvi, la scintigrafia per le ossa, e la risonanza magnetica per valutare la capsula prostatica e le vescicole seminali.
I risultati possono poi essere classificati grazie alla stadiazione TNM o di Whitmore-Jewett:
Classificazione TNM
| Stadio |
Descrizione |
| T1a |
tumore in meno del 5% del parenchima (corrisponde allo stadio A1 di WJ). |
| T1b |
tumore in più del 5% del parenchima. |
| T1c |
come 1b + PSA elevato (questi 2 stadi corrispondono allo stadio A2 di WJ) |
|
| T2a |
coinvolge 1 lobo (comprende gli stadi B1 e B2 di WJ) |
| T2b |
coinvolge entrambi i lobi (stadio B3 di WJ) |
|
| T3a |
oltrepassa la capsula prostatica da un solo lobo (stadio C1 di WJ) |
| T3b |
oltrepassa la capsula da entrambi i lobi |
| T3c |
invade le vescichette seminali (stadio C2 di WJ) |
|
| T4 |
invade organi adiacenti (stadio D di WJ, diviso in ormono-sensibile e insensibile) |
|
| N1a |
metastasi linfonodali non rilevabili |
| N1b |
una sola minore o uguale a 2 cm |
| N1c |
una sola fra 2 e 5 cm |
| N2a |
oltre 5 cm o multiple |
|
| MX |
metastasi a distanza non rilevabili |
| M0 |
assenza di metastasi a distanza |
| M1a |
linfonodi extraregionali |
| M1b |
scheletro |
| M1c |
altri siti |
Dopo una biopsia prostatica, un patologo esamina il campione al microscopio. Se è presente un tumore il patologo ne indica il grado; questo indica quanto il tessuto tumorale differisce dal normale tessuto prostatico, e suggerisce quanto velocemente il tumore stia crescendo. Il grado di Gleason assegna un punteggio da 2 a 10, dove 10 indica le anormalità più marcate; il patologo assegna un numero da 1 a 5 alle formazioni maggiormente rappresentate, poi fa lo stesso con le formazioni immediatamente meno comuni; la somma dei due numeri costituisce il punteggio finale. Il tumore è definito ben differenziato se il punteggio è fino 4, mediamente differenziato se 5 o 6, scarsamento differenziato se maggiore di 6.
Sistema di gradi secondo Gleason
| Grado |
Descrizione |
| Grado 1: |
altamente differenziato |
| Grado 2: |
ben differenziato: |
| Grado 3: |
moderatamente differenziato |
| Grado 4: |
scarsamente differenziato |
| Grado 5: |
altamente indifferenziato (cellule infiltranti) |
Un’appropriata definizione del grado di malignità del tumore è di importanza fondamentale, in quanto uno dei fattori utilizzati per guidare le scelte terapeutiche.
Terapia
La terapia del carcinoma prostatico può comprendere: l’osservazione in assenza di trattamento, la chirurgia, la radioterapia, gli ultrasuoni focalizzati ad alta intensità HIFU, la chemioterapia, la criochirurgia, la terapia ormonale, o una combinazione di queste. La scelta dell’opzione migliore dipende dallo stadio della malattia, dal punteggio secondo la scala Gleason, e dai livelli di PSA. Altri fattori importanti sono l’età del paziente, il suo stato generale, e il suo pensiero riguardo alla terapia proposta e agli eventuali effetti collaterali. Poiché tutte le terapie possono indurre significativi effetti collaterali, come le disfunzione erettile e l’incontinenza urinaria, discutere col paziente circa la possibile terapia spesso aiuta a bilanciare gli obiettivi terapeutici coi rischi di alterazione dello stile di vita.
Se il tumore si è diffuso esternamente alla prostata, le opzioni terapeutiche cambiano. La terapia ormonale e la chemioterapia sono spesso riservate ai casi in cui la malattia si è estesa esternamente alla prostata; tuttavia esistono delle eccezioni: la radioterapia può essere impiegata per alcuni tumori in fase avanzata, e la terapia ormonale per alcuni in fase precoce. La crioterapia, la terapia ormonale e la chemioterapia possono inoltre essere utilizzate se il trattamento iniziale fallisce e il tumore progredisce.
Integratori alimentari efficaci nel migliorare il benessere della prostata
Qui di seguito trovate una lista di integratori alimentari acquistabili senza ricetta, potenzialmente in grado di diminuire infiammazioni e bruciori e migliorare la salute della prostata. Ogni prodotto viene periodicamente aggiornato ed è caratterizzato dal miglior rapporto qualità prezzo e dalla maggior efficacia possibile, oltre ad essere stato selezionato e testato ripetutamente dal nostro Staff di esperti:
Osservazione
L’osservazione, una “sorveglianza attiva”, prevede il regolare monitoraggio della malattia in assenza di un trattamento invasivo. Spesso vi si ricorre quando si riscontra, in pazienti anziani, un tumore in stadio precoce e a crescita lenta. Può essere consigliabile anche quando i rischi connessi alla chirurgia, alla radioterapia, o alla terapia ormonale sopravanzino i possibili benefici. Si possono intraprendere gli altri trattamenti se si manifestano sintomi, o se appaiono indizi di un’accelerazione nella crescita del tumore. La maggioranza degli uomini che optano per l’osservazione di tumori in stadi precoci vanno incontro alla possibilità di manifestare segni di progressione del tumore, ed entro tre anni hanno necessità di intraprendere una terapia. Sebbene tale scelta eviti i rischi connessi alla chirurgia e alle radiazioni, il rischio di metastasi si può innalzare. I problemi di salute connessi all’avanzare dell’età durante il periodo di osservazione possono anch’essi complicare la chirurgia e la radioterapia.
Chirurgia
La rimozione chirurgica della prostata, o prostatectomia, è un trattamento comune sia per i tumori prostatici in stadi precoci, sia per i tumori non rispondenti alla radioterapia. Il tipo più comune è la prostatectomia retropubica radicale, in cui si rimuove la prostata tramite un’incisione addominale. Un altro tipo è la prostatectomia perineale radicale, in cui l’incisione è praticata a livello del perineo, la regione fra lo scroto e l’ano. La prostatectomia può risolvere, a cinque anni, circa il 70% dei casi di tumore della prostata; tassi di sopravvivenza più alti si sono trovati con un Gleason score inferiore a 3.
La prostatectomia radicale è stata tradizionalmente usata come unico trattamento per un tumore di piccole dimensioni. Tuttavia cicli di terapia ormonale prima della chirurgia possono migliorare le percentuali di successo, e sono correntemente oggetto di studio. La chirurgia può essere intrapresa anche quando il tumore non risponde alla radioterapia, tuttavia, poiché le radiazioni causano modifiche dei tessuti, in questa situazione aumentano i rischi di complicazioni.
Da uno studio comparativo condotto nel 2009 su un totale di 8.837 interventi di chirurgia radicali per tumore alla prostata, l’incidenza dell’incontinenza urinaria e impotenza, ha evidenziato che:
- Chirurgia con robot/laparoscopia:
- 15,9% di incontinenza urinaria
- 26,8% di impotenza e disfunzioni erettili.
- Chirurgia classica-tradizionale a “cielo aperto”:
- 12,2% di incontinenza urinaria
- 19,2% di impotenza e disfunzioni erettili.
La resezione transuretrale della prostata è una procedura chirurgica messa in atto quando l’uretra è ostruita a causa dell’ingrossamento prostatico; generalmente è riservata alle malattie prostatiche benigne e non è intesa come trattamento definitivo del tumore. Consiste nell’inserimento nell’uretra di un piccolo endoscopio, tramite il quale, con apposito strumento, si taglia via la parte di prostata che occlude il lume.
Prostatectomia radicale, nervi e disfunzione erettile
La prostatectomia radicale è molto efficace per i tumori limitati alla prostata, tuttavia può causare danni ai nervi in grado di alterare significativamente la qualità della vita dei pazienti. I nervi deputati all’erezione e alla minzione sono immediatamente adiacenti con la prostata, per cui le complicazioni più importanti sono l’incontinenza urinaria e l’impotenza. Circa il 40% degli uomini residuano incontinenza urinaria, di solito sotto forma di perdite quando starnutiscono, tossiscono o ridono. L’impotenza è anch’essa un problema comune: sebbene la sensibilità sul pene e la capacità di raggiungere l’orgasmo rimangano intatte, l’erezione e l’eiaculazione sono spesso compromesse; farmaci come il sildenafil (Viagra), il tadalafil (Cialis), o il vardenafil (Levitra) possono ristabilire un certo grado di potenza. In alcuni uomini con tumori più piccoli, una tecnica chirurgica meno invasiva può essere d’aiuto per evitare queste complicazioni.
Leggi anche:
Cure palliative
Una cura palliativa per i tumori prostatici in fase avanzata è rivolta al migliorare la qualità della vita attenuando i sintomi delle metastasi. La chemioterapia può utilizzarsi per ridurre la progressione della malattia e procrastinarne i sintomi. Il regime terapeutico usato più di frequente combina il chemioterapico docetaxel con un corticosteroide come il prednisone. I bifosfonati come l’acido zoledronico si sono dimostrati in grado di posticipare le complicazioni a carico dello scheletro come le fratture inoltre inibiscono direttamente la crescita delle cellule neoplastiche. L’utilizzo della radioterapia in pazienti con metastasi di carcinoma prostatico refrattarie alla terapia ormonale. Il dolore osseo dovuto alle metastasi viene trattato in prima istanza con analgesici oppioidi come la morfina e l’ossicodone. La radioterapia a fascio esterno diretta sulle metastasi ossee assicura una diminuzione del dolore ed è indicata in caso di lesioni isolate, mentre la terapia radiometabolica è impiegabile nella palliazione della malattia ossea secondaria più diffusa.
Prognosi
Nelle società occidentali i tassi di tumori della prostata sono più elevati, e le prognosi più sfavorevoli che nel resto del mondo. Molti dei fattori di rischio sono maggiormente presenti in Occidente, tra cui la maggior durata di vita e il consumo di grassi animali. Inoltre, dove sono più accessibili i programmi di screening, v’è un maggior tasso di diagnosi. Il tumore della prostata è il nono più frequente tumore nel mondo, e il primo, a parte i tumori cutanei, negli Stati Uniti per quanto riguarda gli uomini, dove nel 2005 ha colpito il 18% degli uomini, e causa di morte per il 3%. In Giappone, il tasso di morte per tumore della prostata era da un quinto alla metà rispetto agli Stati Uniti e all’Europa negli anni novanta; in India nello stesso periodo metà delle persone con tumore della prostata non invasivo morivano entro dieci anni. Gli afroamericani contraggono il tumore e ne muoiono 50-60 volte più frequentemente rispetto agli uomini di Shanghai, Cina. In Nigeria il 2% degli uomini sviluppano tumore prostatico e il 64% di essi muoiono entro due anni. Nei pazienti sottoposti a trattamento gli indicatori prognostici più importanti sono lo stadio di malattia, i livelli pre-terapia di PSA e l’indice di Gleason. In generale maggiore il grado e lo stadio peggiore è la prognosi. Si può ricorrere ad algoritmi per calcolare il rischio stimato in un determinato paziente. Le predizioni sono basate sull’esperienza su ampi gruppi di pazienti affetti da tumori in vari stadi.
Leggi anche:
- Due eiaculazioni consecutive sono possibili? Come funziona una eiaculazione?
- Prostata: ogni quanto tempo fare il controllo del PSA?
- Come aumentare il testosterone per migliorare muscoli e rapporti sessuali
- Cos’è il perineo maschile e femminile, dove si trova ed a cosa serve? Perché è così importante per la donna, specie in gravidanza?
- Vescica: dove si trova, anatomia, funzioni e patologie frequenti in sintesi
- Urodinamica: cos’è, a che serve e come funziona
- Finasteride per ipertrofia prostatica ed alopecia androgenetica
- Finasteride e disfunzione erettile: la Sindrome post finasteride
- Propecia (Finasteride): collaterali e foglietto illustrativo
- Minzione: come funziona l’emissione di urina e come si controlla
- Uretra maschile e femminile: anatomia, funzioni e patologie in sintesi
- Uretere: dove si trova, anatomia, funzioni e patologie in sintesi
- Testicoli e scroto: dimensioni, anatomia e funzioni in sintesi Punto G maschile: trovare e stimolare il punto L per provare orgasmi più intensi ed aumentare la forza dell’eiaculazione
- Quanto deve durare un rapporto sessuale prima che si parli di eiaculazione precoce?
- Masturbazione compulsiva e dipendenza dalla pornografia online causano impotenza anche nei giovani: colpa dell’effetto Coolidge
- Cosa accade e cosa si prova quando si frattura il pene?
- Priapismo: quando l’erezione dura più di quattro ore
- Presenza di sangue nello sperma: cause e terapie dell’ematospermia
- Cancro del testicolo: prevenzione, diagnosi, stadiazione, cure
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Condividi questo articolo:
 Con “carcinoma” in campo medico si intende un tumore maligno che prende origine dalle cellule che compongono il tessuto epiteliale di un organo e che può dare origine a metastasi. Un carcinoma può colpire diversi organi: polmoni, prostata, esofago, utero, ovaie, vescica, intestino e apparato urinario sono tra questi. Esempi tipici di carcinoma sono quindi:
Con “carcinoma” in campo medico si intende un tumore maligno che prende origine dalle cellule che compongono il tessuto epiteliale di un organo e che può dare origine a metastasi. Un carcinoma può colpire diversi organi: polmoni, prostata, esofago, utero, ovaie, vescica, intestino e apparato urinario sono tra questi. Esempi tipici di carcinoma sono quindi:
 Per carcinoma della prostata si intende una categoria diagnostica che annovera le neoplasie maligne che si originano dalle cellule epiteliali della prostata, una ghiandola dell’apparato genitale maschile. Questa neoplasia può dare luogo a metastasi, con predilezione per le ossa e i linfonodi loco-regionali. Il tumore alla prostata può causare dolore, difficoltà alla minzione, disfunzione erettile e altri sintomi.
Per carcinoma della prostata si intende una categoria diagnostica che annovera le neoplasie maligne che si originano dalle cellule epiteliali della prostata, una ghiandola dell’apparato genitale maschile. Questa neoplasia può dare luogo a metastasi, con predilezione per le ossa e i linfonodi loco-regionali. Il tumore alla prostata può causare dolore, difficoltà alla minzione, disfunzione erettile e altri sintomi.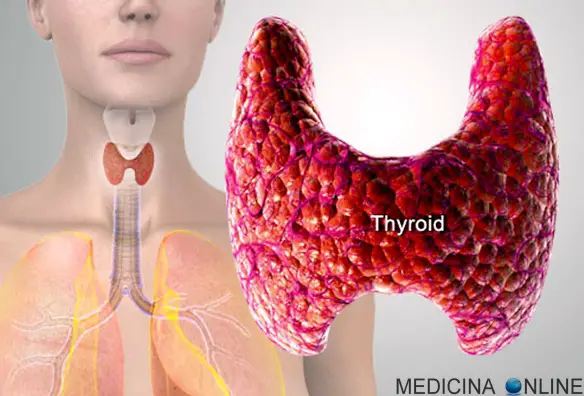 Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.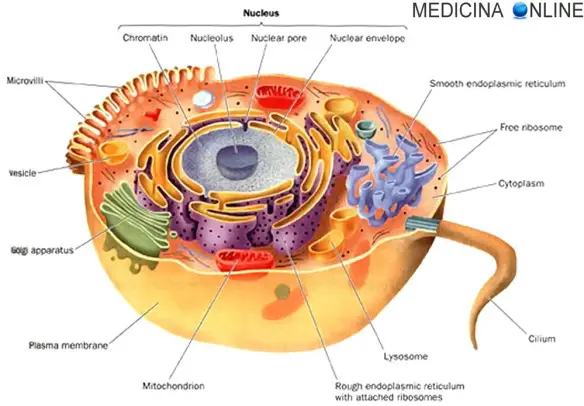 Tessuto normale
Tessuto normale Cancro e tumore sono usati spesso come sinonimi, ma non sono due parole necessariamente equivalenti. Il discorso si complica con l’aggiunta di una
Cancro e tumore sono usati spesso come sinonimi, ma non sono due parole necessariamente equivalenti. Il discorso si complica con l’aggiunta di una  Prima di soffermarmi sull’esame mammografico, mi sembra doveroso fare un accenno al carcinoma mammario che nei Paesi industrializzati è, per incidenza e mortalità, al primo posto tra i tumori maligni della popolazione femminile. In Italia ogni anno il
Prima di soffermarmi sull’esame mammografico, mi sembra doveroso fare un accenno al carcinoma mammario che nei Paesi industrializzati è, per incidenza e mortalità, al primo posto tra i tumori maligni della popolazione femminile. In Italia ogni anno il