 Il torcicollo comune o acquisito (ben distinto dal torcicollo miogeno congenito ed il torcicollo spastico) può manifestarsi in modo episodico, oppure tornare a disturbare la tua quotidianità con una certa frequenza. In alcuni rari casi, diventa addirittura cronico. L’origine del disturbo è di natura muscolare/osteoarticolare: può insorgere per contratture muscolari, processi infiammatori che interessano il tratto cervicale o traumi.
Il torcicollo comune o acquisito (ben distinto dal torcicollo miogeno congenito ed il torcicollo spastico) può manifestarsi in modo episodico, oppure tornare a disturbare la tua quotidianità con una certa frequenza. In alcuni rari casi, diventa addirittura cronico. L’origine del disturbo è di natura muscolare/osteoarticolare: può insorgere per contratture muscolari, processi infiammatori che interessano il tratto cervicale o traumi.
Cause e fattori di rischio
Nella maggior parte dei casi, il torcicollo è connesso a una cattiva postura, dunque ad atteggiamenti viziati che assumiamo sia mentre lavoriamo, sia mentre dormiamo. Sì, perché anche di notte dovremmo aver cura della nostra postura. Come? Scegliendo un cuscino adatto (tra poco ti darò indicazioni più specifiche) e cercando di evitare la posizione prona. Dormire a pancia in giù, in effetti, affatica il collo. Altri fattori che possono portare al torcicollo sono banalmente il freddo e l’umidità, che causano contrattura. Non dimentichiamo, inoltre:
- gli strappi muscolari dovuti a infortuni sportivi o a sforzi importanti;
- lo stress, da cui può originare un’eccessiva tensione muscolare.
Sintomi e segni
Il paziente colpito da torcicollo lamenta una marcata difficoltà a flettere, roteare od allungare il collo; ogni minimo movimento di questa zona produce un dolore locale acuto, penetrante ed insopportabile.
Il quadro clinico del torcicollo comune si contraddistingue per:
- brachialgia: condizione dolorosa del collo che si può irradiare anche al muscolo trapezio, alla spalla ed a livello del braccio;
- cervicalgia: generico dolore al collo di natura muscolo-scheletrica;
- rigidità dei muscoli cervicali;
- incapacità/impossibilità di muovere, spostare o roteare il collo.
Leggi anche: Come viene effettuata una ecografia articolare (muscolo tendinea) ed a cosa serve?
Quanto dura un torcicollo?
Il torcicollo ha un decorso che può essere più o meno breve: può durare da alcune ore ad alcuni giorni. La maggioranza dei torcicollo, tuttavia, scompare o comunque diminuisce di intensità al secondo giorno dopo l’insorgenza dei sintomi.
Terapia
Spesso non c’è bisogno di terapia, ma se il disturbo diventa limitante, il medico potrebbe prescriverti una cura farmacologica a base di antinfiammatori e miorilassanti o anche l’uso di un collare cervicale morbido o semirigido. Ricorda, però, che le terapie possono sì alleviare i sintomi e portare a una risoluzione del disturbo, ma se continui a mantenere abitudini scorrette, soprattutto dal punto di vista posturale, il torcicollo sarà sempre lì ad attenderti dietro l’angolo. Alcune cose importanti da sapere:
- se il torcicollo compare dopo un trauma, come una caduta o un tamponamento automobilistico, oppure se è accompagnato da febbre alta, mal di testa, nausea, è consigliabile andare subito al pronto soccorso;
- se il torcicollo torna a farti visita con frequenza, o se i sintomi si protraggono per più di una settimana, è bene consultare il tuo medico per escludere patologie della colonna cervicale.
Leggi anche: Differenza tra distorsione, lussazione, sublussazione e strappo muscolare
Terapia farmacologica
Il trattamento per il torcicollo dev’essere stabilito in funzione della causa scatenante. Normalmente, il dolore al collo è risolvibile mediante una semplice terapia con farmaci analgesici ed antinfiammatori. I più utilizzati a tale scopo sono:
- antinfiammatori non steroidei (come l’ibuprofene e l’acido acetilsalicilico);
- rilassanti muscolari (diazepam, ciclobenzaprina);
- corticosteroidi (come prednisone e metilprednisolone).
Talvolta, il dolore percepito a livello del rachide cervicale è particolarmente intenso, pertanto, il paziente necessita di un collare ortopedico per velocizzare la guarigione ed attenuarne i sintomi.
Discorso differente dev’essere posto per il torcicollo conseguente a lesioni gravi, dipendente per esempio da un’erniazione cervicale. In simili circostanze, l’unica possibilità per allontanare il torcicollo è curare la l’ernia sottostante mediante un intervento chirurgico mirato (discectomia) od un’ulteriore trattamento specifico stabilito dal medico.
Leggi anche: Rottura della cuffia dei rotatori: dolore alla spalla, deficit di forza, diagnosi e cura
Rimedi non farmacologici
Non sempre è necessario ricorrere ai farmaci per curare il torcicollo. Talvolta, il dolore al collo di lieve entità può essere presto risolto mettendo in pratica semplici accorgimenti. Com’è possibile attenuare il dolore provocato dal torcicollo?
- Gli impacchi caldi sul collo dolente conferiscono un immediato sollievo, in particolar modo quando il torcicollo dipende da una contrattura dei muscoli cervicali.
- Il torcicollo dipendente da un’infiammazione può essere temporaneamente alleggerito mediante la crioterapia, ovvero la terapia del freddo. A tale scopo, si consiglia di appoggiare sul collo indolenzito una borsa del ghiaccio avvolta in un panno morbido. Per ottenere la massima efficacia terapeutica del ghiaccio, si raccomanda di rimuovere le borsa fredda ogni 15-20 minuti, intervallando con pause di ugual durata.
- Evitare il riposo eccessivo. Contrariamente a quanto si possa pensare, un eccesso di riposo favorisce la rigidità delle articolazioni e dei muscoli, già di per sé indeboliti dal torcicollo. Si consiglia, piuttosto, di assumere una posizione riposante per 30 minuti; dopodiché è bene cimentarsi in una camminata o svolgere un esercizio fisioterapico leggero, specifico per il torcicollo.
- Riposare su un materasso adeguato, che non deve essere troppo morbido.
Correggere eventuali abitudini di vita scorrette, come ad esempio le postura errata - Rilassarsi. Lo stress e l’ansia possono acutizzare il torcicollo, dato che le tensioni vengono scaricate sul rachide.
- Preferire sedie solide, in modo che il collo e il dorso siano sostenuti.
- Eseguire correttamente gli esercizi per il dolore cervicale, allo scopo di mobilizzare le vertebre cervicali e sciogliere le tensioni accumulate durante la giornata.
Leggi anche: Pubalgia acuta e cronica: sintomi, esercizi e rimedi
Consigli e prodotti consigliati per prevenire il torcicollo
Chiudo questo approfondimento con alcuni semplici accorgimenti da osservare per prevenire la comparsa del torcicollo:
- preferisci un cuscino basso e ortopedico, anziché alto e rigido, come questo che vi consiglio: https://amzn.to/3zYsUI7
- scegli un materasso di qualità;
- asciuga bene i capelli, poiché l’umidità nella zona del collo può portare cervicalgia nei soggetti predisposti;
- fai ginnastica posturale e attività sportiva adeguata, facendo particolare attenzione allo stretching;
- se lavori in ufficio, procurati una sedia ergonomica come questa: https://amzn.to/3odxL5Q;
- se hai gli occhi spesso puntati verso un computer, regola la distanza dello schermo ad almeno 50-70 cm dagli occhi;
- se stai spesso seduto, utilizza una pedana poggiapiedi obliqua, che aiuta a mantenere una buona postura. Vi consiglio questa: https://amzn.to/40bKFi3.
Leggi anche:
- Torcicollo miogeno congenito: sintomi, diagnosi e trattamenti
- Caviglia slogata (distorsione) e gonfia: cosa fare? Fasciatura ed altri rimedi
- Ernia del disco e mal di schiena: sintomi, diagnosi e cura
- Sindrome del piriforme: sintomi, esercizi, cura e recupero
- Lussazione della spalla: cause, tipi, sintomi e cosa fare per guarire
- Pubalgia in gravidanza: cause e rimedi del dolore all’osso pubico
- Differenza tra pube ed osso iliaco: anatomia e funzioni
- Differenza tra pube e inguine
- Quante ossa ci sono nella mano e come si chiamano?
- Quante ossa ha il piede e come si chiamano
- Sindrome del tunnel carpale: prevenzione, diagnosi e cura di una dolorosa patologia
- Si rompe il femore a 109 anni: “Ora voglio andare a bere il caffè al bar”
- Differenza tra costola incrinata e rotta
- Frattura costale multipla, volet costale e pneumotorace
- Cos’è una costa? Differenza tra costole e coste
- Gabbia toracica: dove si trova, a che serve e da cosa è composta
- Costola incrinata: sintomi, terapia e tempi di recupero
- Differenza tra costole e vertebre
- Muscoli respiratori volontari ed involontari
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su Mastodon, su YouTube, su LinkedIn, su Tumblr e su Pinterest, grazie!

 Con “torcicollo miogeno congenito” o “miotenogeno” si intende una contrattura unilaterale del muscolo sternocleidomastoideo, presente alla nascita, che determina una deformità asimmetrica del capo e del collo con il capo ruotato e inclinato verso il lato della lesione e il mento inclinato verso il lato opposto.
Con “torcicollo miogeno congenito” o “miotenogeno” si intende una contrattura unilaterale del muscolo sternocleidomastoideo, presente alla nascita, che determina una deformità asimmetrica del capo e del collo con il capo ruotato e inclinato verso il lato della lesione e il mento inclinato verso il lato opposto.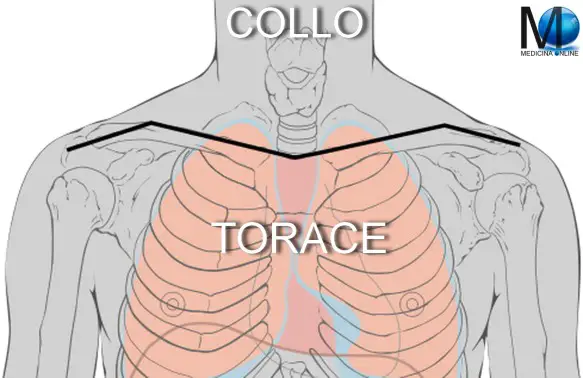 Il limite superiore del torace, che divide quest’ultimo dal collo, è descritto da una linea immaginaria, denominata “linea cervico-toracica”, che, nell’uomo, origina dall’incisura giugulare dello sterno, prosegue lungo il margine superiore delle clavicole fino all’acromion della scapola e prosegue fino al processo spinoso della settima vertebra cervicale.
Il limite superiore del torace, che divide quest’ultimo dal collo, è descritto da una linea immaginaria, denominata “linea cervico-toracica”, che, nell’uomo, origina dall’incisura giugulare dello sterno, prosegue lungo il margine superiore delle clavicole fino all’acromion della scapola e prosegue fino al processo spinoso della settima vertebra cervicale.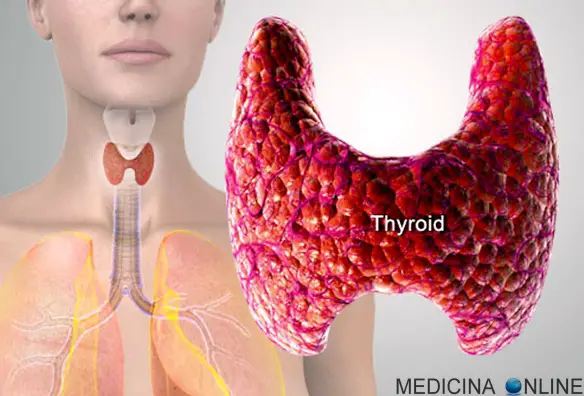 Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
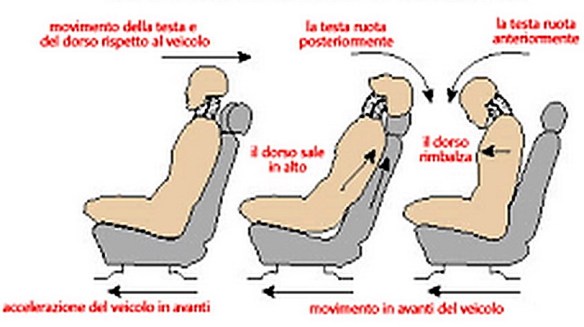 Con l’espressione “colpo di frusta” (in inglese “whiplash”) si intende un semplice movimento articolare del rachide cervicale nei tre piani dello spazio a seguito di un’accelerazione o decelerazione, tipici di un incidente stradale con tamponamento antero-posteriore tra due autovetture, ma anche di alcuni traumi sportivi.
Con l’espressione “colpo di frusta” (in inglese “whiplash”) si intende un semplice movimento articolare del rachide cervicale nei tre piani dello spazio a seguito di un’accelerazione o decelerazione, tipici di un incidente stradale con tamponamento antero-posteriore tra due autovetture, ma anche di alcuni traumi sportivi.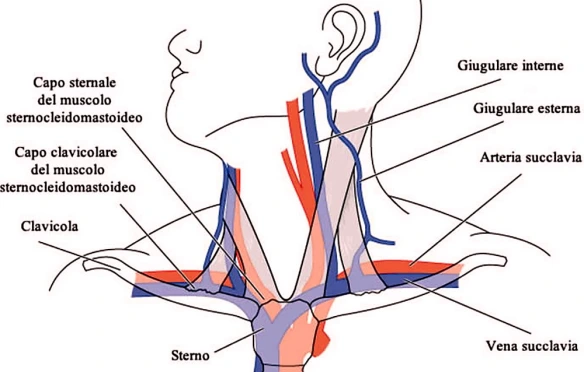 Le vene giugulari (jugular vein in inglese) sono importanti vene che riportano il sangue carico di anidride carbonica dalla testa al cuore attraverso la vena cava superiore. La pressione della vena giugulare viene misurata indirettamente e può essere utile per individuare disfunzioni del cuore o dei polmoni. Nel nostro corpo vi sono vene giugulari interne, esterne ed anteriori:
Le vene giugulari (jugular vein in inglese) sono importanti vene che riportano il sangue carico di anidride carbonica dalla testa al cuore attraverso la vena cava superiore. La pressione della vena giugulare viene misurata indirettamente e può essere utile per individuare disfunzioni del cuore o dei polmoni. Nel nostro corpo vi sono vene giugulari interne, esterne ed anteriori: Nella cultura popolare e nelle scene violente dei film d’azione la vena giugulare viene spesso confusa con la carotide o con le arterie che irrorano la parte centrale del collo e viene identificata come la causa dei forti spruzzi di sangue fuoriuscenti dalle vittime di sgozzamenti o gravi ferite sulla parte centrale del collo, nei pressi del pomo d’Adamo. In realtà carotide e giugulare, pur essendo entrambi vasi sanguigni, e pur essendo anatomicamente vicine, sono due cose profondamente diverse che hanno differenti compiti nel nostro corpo.
Nella cultura popolare e nelle scene violente dei film d’azione la vena giugulare viene spesso confusa con la carotide o con le arterie che irrorano la parte centrale del collo e viene identificata come la causa dei forti spruzzi di sangue fuoriuscenti dalle vittime di sgozzamenti o gravi ferite sulla parte centrale del collo, nei pressi del pomo d’Adamo. In realtà carotide e giugulare, pur essendo entrambi vasi sanguigni, e pur essendo anatomicamente vicine, sono due cose profondamente diverse che hanno differenti compiti nel nostro corpo.