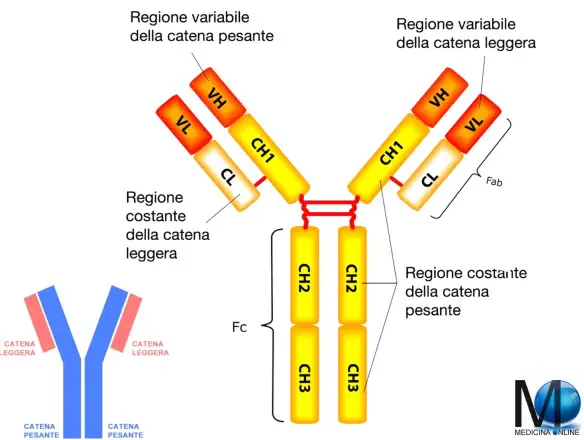
La struttura di un anticorpo
Un anticorpo (immunoglobulina nel caso fosse su un Linfocita B vergine) è una proteina con una peculiare struttura quaternaria che le conferisce una forma a “Y”. Gli anticorpi hanno la funzione, nell’ambito del sistema immunitario, di neutralizzare corpi estranei come virus e batteri, riconoscendo ogni determinante antigenico o epitopo legato al corpo come un bersaglio. In maniera schematica e semplificata si può dire che ciò avviene perché al termine dei bracci della “Y” vi è una struttura in grado di “chiudere” i segmenti del corpo da riconoscere. Ogni chiusura ha una chiave diversa, costituita dal proprio determinante antigenico; quando la “chiave” (l’antigene) è inserita, l’anticorpo si attiva. La produzione di anticorpi è la funzione principale del sistema immunitario umorale.
Caratteristiche generali
Gli anticorpi sono una classe di glicoproteine del siero, il cui ruolo nella risposta immunitaria specifica è di enorme importanza. Hanno la capacità di legarsi in maniera specifica agli antigeni (microorganismi infettivi come batteri, tossine o qualunque macromolecola estranea che provochi la formazione di anticorpi). Negli organismi a sangue caldo vengono prodotte dai linfociti B, trasformati per adempiere a questo compito, in seguito a stimoli specifici, in plasmacellule. Le immunoglobuline, insieme ai recettori dei linfociti T TCR(T Cell Receptors) e alle molecole del complesso maggiore di istocompatibilità MHC (Major Histocompatibility Complex) sono le uniche molecole capaci di legare l’antigene in misura altamente specifica. La storia degli anticorpi nasce nel 1890 con la scoperta da parte di Emil von Behring e Shibasaburo Kitasato dell’immunità umorale per la quale usarono il siero di animali immunizzati per trattare la difterite in alcuni pazienti. La componente proteica di questo siero venne chiamata inizialmente antitossina per l’azione rivolta verso le tossine batteriche. Con la scoperta che le immunoglobuline potevano reagire con molte altre sostanze, presero il nome attuale di anticorpi e le molecole in grado di legarli antigeni. Le immunoglobuline fanno parte delle gammaglobuline facenti parte a loro volta delle globuline uno dei due gruppi di proteine plasmatiche (insieme alle albumine).
Struttura degli anticorpi
I primi studi sugli anticorpi analizzavano immunoglobuline presenti nel sangue di soggetti immunizzati. Questa metodica, tuttavia, non condusse a grandi conclusioni per la presenza di moltissimi anticorpi differenti fra loro e specifici per porzioni diverse di un antigene (anticorpi policlonali). Notevoli progressi furono effettuati esaminando il sangue di pazienti affetti da mieloma multiplo, un tumore delle plasmacellule, che porta alla formazione di grandi quantità di anticorpi uguali.
Gli anticorpi sono complessi proteici a struttura modulare che condividono una struttura di base ma che presentano notevoli variabilità in specifiche regioni capaci di legarsi a particelle strutturalmente complementari denominate antigeni. In maniera molto grossolana, sono paragonabili a delle Y, costituite da un gambo centrale e due bracci laterali. Le immunoglobuline sono simmetriche e composte da 4 catene: due leggere e due pesanti legate covalentemente da ponti disolfuro presenti tra residui di cisteine le cui posizioni variano a seconda del tipo di anticorpo. Ogni catena contiene una serie di unità costituite da circa 110 amminoacidi formanti una struttura globulare chiamata dominio Ig. Il dominio è contenuto anche in altre proteine che, per la presenza di questa particolare struttura, vengono accomunate sotto il nome di superfamiglia delle Ig. Nello specifico il dominio Ig è costituito da due foglietti β tenuti insieme da un ponte disolfuro composti da 3-5 “nastri” ad andamento antiparallelo collegati da anse le cui sequenze amminoacidiche possono essere importanti per il riconoscimento dell’antigene.
Sia le catene pesanti che leggere sono formate da una regione variabile (V) aminoterminale ed una regione costante (C) carbossiterminale. Le regioni variabili di una catena pesante (VH) e di una leggera (VL) formano il sito di legame per l’antigene, dove le anse dei domini Ig contengono la variabilità che rende specifico il legame con l’antigene. Poiché ogni immunoglobulina è composta da due catene leggere e due pesanti, saranno presenti due siti di legame. Le regioni costanti non partecipano al riconoscimento dell’antigene ma alle funzioni effettrici degli anticorpi.
Leggi anche:
- Sistema immunitario, immunità innata e specifica: riassunto, schema e spiegazione
- Immunodeficienza primaria e secondaria: sintomi, cause e terapie
- Immunità innata (aspecifica): barriere, infiammazione e complemento
- Immunità innata (aspecifica): neutrofili, macrofagi e linfociti natural killer
- Immunità specifica (acquisita): linfociti, T killer, T helper, T γδ, B ed anticorpi
- Immunità specifica (acquisita): memoria passiva, attiva ed immunizzazione
- Immunità specifica (acquisita) umorale e cellulare
- Patologie del sistema immunitario: immunodeficienze, autoimmunità ed ipersensibilità
- Differenza tra antigene, aptene allergene ed epitopo
- Aptene: cos’è e perché è importante per il sistema immunitario
- Antigene: cos’è e perché è importante per il sistema immunitario
- Differenza tra antigeni esogeni, endogeni, tumorali, nativi ed autoantigeni
- Epitopi sequenziali e conformazionali: cosa sono e come funzionano
- HIV: dopo quanto si manifestano i sintomi? I 4 stadi dell’infezione
- Differenza tra HIV e AIDS: sono uguali?
- Si muore di AIDS? Qual è l’aspettativa di vita?
- HIV: sintomi iniziali in donne e uomini
- Differenza tra malattia, sindrome e disturbo con esempi
- Differenza tra virus HIV1 e HIV2
- Sesso e AIDS: l’HIV si trasmette anche tramite il rapporto orale
- Il liquido pre-eiaculatorio può indurre gravidanza e trasmettere l’HIV?
- HIV e AIDS: come, dove e quando si eseguono i test per la diagnosi?
Organizzazione delle Immunoglobuline
Alcuni esperimenti condotti da Rodney Porter servirono a capire le associazioni tra le catene e parte della struttura delle immunoglobuline. Essendo proteine, esse possono andare incontro a digestione proteolitica se trattate con specifici enzimi. Usando la papaina le immunoglobuline vengono tagliate in 3 frammenti costituiti dai due bracci e dal gambo. Due di questi sono identici e costituiti dalla catena leggera ancora legata ad un pezzo di catena pesante. Dal momento che la capacità di legare l’antigene è mantenuta vengono chiamati frammenti con sito di legame per l’antigene (FAB = Fragment, Antigen Binding). Il terzo frammento è composto dalle parti restanti delle catene pesanti che tendono ad aggregarsi e a cristallizzare. Viene per questo chiamato frammento cristallizzabile (FC = Fragment, crystallizable). L’uso della pepsina, invece, genera un solo frammento F(ab’)2 costituito dai due FAB legati insieme. La restante parte dell’immunoglobulina non genera un Fc, ma piccoli frammenti peptidici.
Regione variabile (V) e ipervariabile
Le regioni variabili, costituite da un dominio Ig per entrambe le catene contengono le cosiddette regioni ipervariabili: tratti della catena polipeptidica dove si riscontrano le maggiori variabilità amminoacidiche che donano a ciascun anticorpo la specificità unica verso un antigene. Tali regioni sono costituite dalle 3 anse che collegano i nastri adiacenti dei foglietti β costituite ciascuna da 10 amminoacidi. Dal momento che sono presenti due domini per ogni regione variabile (VH e VL) ci saranno complessivamente 6 regioni ipervariabili per ogni braccio dell’immunoglobulina. Queste sequenze formano una superficie complementare all’antigene e sono pertanto chiamate anche regioni determinanti la complementarità(Complementarity-Determining Regions, CDR’) e sono numerate a partire dall’estremità N-terminale di ogni dominio in CDR1, CDR2 e CDR3. Quest’ultimo si è scoperto essere sensibilmente più variabile rispetto agli altri due ed è quello che effettua più contatti con l’antigene. Le 6 CDR presenti in ciascun braccio sono esposte a formare un’ampia superficie in maniera simile ai recettori per i linfociti T. La caratteristica di variabilità solo in specifiche regioni consente alle immunoglobuline di avere una struttura di base costante.
Regione costante (C)
La regione costante, costituita da un dominio Ig nelle catene leggere (CL) e da 3-4 domini in quelle pesanti (CH1,2,3,4), permette alle immunoglobuline di avere peculiarità che si ripercuotono nella funzione effettrice delle stesse. Anzitutto, gli anticorpi possono essere prodotti in forma secreta o legati alla membrana: ciò dipende da differenze presenti nella regione costante delle catene pesanti. Nella forma di membrana, infatti, sono presenti una regione idrofobica ad α-elica (che sarà la parte transmembranale) e una regione carica positivamente (che sarà situata all’interno della cellula). La regione compresa fra i domini CH1 e CH2, detta regione cerniera, di tutte le immunoglobuline ha la particolarità di essere flessibile e di permettere un diverso orientamento (fino a 90° gradi) dei bracci in modo da poter legare più antigeni contemporaneamente. Infine, differenze presenti nella sequenza amminoacidica della regione costante conferiscono una distinzione delle immunoglobuline in classi (denominate anche isotipi) in base alle differenze presenti.
Classi delle catene pesanti
Esistono 5 tipi di catene pesanti, il cui nome è caratterizzato da alcune lettere greche (α, δ, ε, γ e μ), che danno vita a diverse classi di immunoglobuline denominate con la corrispondente lettera dell’alfabeto latino: IgA, IgD, IgE, IgG e IgM. Alcune sono ulteriormente suddivise in sottoclassi. Anticorpi appartenenti ad uno stesso isotipo condividono essenzialmente la sequenza amminoacidica della regione costante che è diversa da quella delle altre classi. La maggior parte delle funzioni effettrici è mediata dal legame con un recettore; la sequenza amminoacidica diversa presuppone recettori diversi e conseguentemente funzioni diverse.
| Isotipo |
Catena H (sottoclasse) |
Domini Ig nella catena H |
Emivita (giorni) |
Concentrazione nel siero (mg/ml) |
Forma secreta |
Presenza |
Funzioni |
Altro |
| IgA |
α (IgA1 e IgA2) |
3 |
6 |
3,5 |
Monomero, dimero, trimero |
Secrezioni mucose (principalmente), sangue, latte materno |
Immunità e protezione delle mucose, debole opsonizzante e attivatore del complemento |
La presenza nel latte materno permette il trasferimento di protezione dalla madre al figlio, resistenti alla proteolisi |
| IgD |
δ |
3 |
3 |
Tracce |
Nessuna |
Sangue |
Recettore per i linfociti (BCR) |
Sensibili alla digestione proteolitica |
| IgE |
ε |
4 |
2 |
0,05 |
Monomero |
Sangue, tessuti |
Difesa contro gli elminti e ipersensiblità immediata (reazioni allergiche) |
– |
| IgG |
γ (IgG1, IgG2, IgG3 e IgG4) |
3 |
23 |
13,5 |
Monomero |
Sangue, tessuti, placenta |
Opsonizzazione, attivazione del complemento, citotossicità cellulare anticorpo-dipendente (ADCC), inibizione dei linfociti B, immunità neonatale (fino a 6-12 mesi dalla nascita) |
È la principale Ig del siero (80% ca.), sono i soli anticorpi che passano attraverso la placenta |
| IgM |
μ |
4 |
5 |
1,5 |
Pentamero |
Sangue (a causa delle grosse dimensioni) |
Attivazione del complemento, attività agglutinante, recettore per i linfociti B (BCR) |
Sono i principali anticorpi durante la prima settimana d’infezione |
Classi delle catene leggere
Nelle catene leggere le regioni costanti sono formate da un solo dominio Ig. In questa regione costante possono esserci differenze sequenziali che dividono le catene in due grandi classi: κ e λ. Ogni imunoglobulina può avere due catene per tipo e mai di due tipi diversi. Il 60% degli anticorpi contiene κ e solo il 40% λ, nell’uomo. Detto rapporto viene alterato in presenza di tumori dei linfociti B in quanto porteranno alla produzione di un elevato numero di anticorpi uguali.
Organizzazione genica
Le immunoglobuline sono codificate in 3 loci disposti su 3 cromosomi diversi (catene pesanti nel cromosoma 14, catene leggere di tipo κ nel cromosoma 2 e di tipo λ nel cromosoma 22). In ogni locus, l’estremità 5′ è occupata da un cluster di segmenti genici V (di 300 bp ca. ciascuno) che occupa una regione di circa 2000 kb. In posizione 5′ di ogni gene V è presente un esone leader (L) che codifica per gli ultimi amminoacidi N-terminali. Questa sequenza serve a indirizzare correttamente le proteine durante la sintesi e viene rimossa nella proteina matura. Ancor più a monte, naturalmente, c’è il promotore del gene V. In posizione 3′ si trovano i segmenti J(da “joining”) (di 30-50 bp ca.), separati da sequenze non codificanti e associati con i geni della regione costante a valle. Nel locus H (delle catene pesanti) tra i geni V e J si trovano ulteriori sequenze chiamate segmenti D. Nelle catene leggere il dominio variabile è codificato dai geni V e J, mentre nelle catene pesanti dai geni V, D e J. Le regioni ipervaribili 1 e 2 (CDR1 e CDR2) sono codificate da un segmento presente in ogni gene V, mentre la CDR3 è codificata dalle sequenze poste fra le regioni (tra V e J per le leggere, tra V e D e D e J per le pesanti) e dalle regioni stesse (J per le leggere, D e J per le pesanti). Le sequenze non codificanti, qui come in tutto il DNA, non svolgono alcun ruolo che si concretizzi nella produzione di proteine, ma sono fondamentali per regolare l’espressione dei geni adiacenti e la loro ricombinazione.
Numero di geni
Nell’uomo i segmenti V sono costituiti da circa 100 geni per la catena pesante, 35 geni per la catena leggera κ e 30 per quella λ. I segmenti costanti sono costituiti da 9 geni per le catene pesanti, 1 gene per le catene leggere κ e 4 per la λ. I geni delle catene leggere sono formati da un singolo esone, mentre quelli delle catene pesanti da 5-6 esoni di cui 3-4 codificano per la catena e gli altri 2 per la regione C-terminale che deve percorrere la membrana (inclusa la coda citoplasmatica). Anche i segmenti D e J sono costituiti da un numero variabile di geni.
Leggi anche:
Sintesi ed assemblaggio
Le immunoglobuline, essendo proteine, vengono prodotte, assemblate ed espresse come comuni proteine. Le tappe prevedono una trascrizione, una traduzione e dunque una rifinitura che le porta alla secrezione o all’espressione sulla membrana. Nel caso specifico degli anticorpi le tappe più importanti e che determinano l’estrema diversità tra di essi sono gli avvenimenti portanti alla produzione di un mRNA maturo e pronto alla traduzione. Prima della traduzione, difatti, vi sono modificazioni post-trascrizionali quali l’editing o semplicemente il processamento, ma soprattutto gli eventi pre-trascrizionali: la ricombinazione. Ciò che determina effettivamente la diversità è la capacità delle cellule che producono anticorpi di riarrangiare le sequenze geniche contenenti i loci per le Ig così da creare un’ampia varietà di regioni variabili leganti antigeni.
Ricombinazione
E’indubbiamente la tappa più importante ed è condivisa anche con il recettore dei linfociti T. Questa avviene solo nelle cellule in grado di esprimere gli enzimi che la permettono (Rag-1 e Rag-2), e di fatto gli unici tipi sono proprio i linfociti B e i linfociti T. L’espressione di suddetti enzimi è tra i caratteri che permettono di osservare, durante la maturazione, la differenziazione verso la linea linfocitaria delle cellule staminali emopoietiche (vedi maturazione dei linfociti B e dei linfociti T). I loci delle immunoglobuline sono caratterizzati da diversi segmenti, V, J, C e, per le catene pesanti, anche D. La ricombinazione consiste in un “taglia-incolla” di segmenti diversi. Tutto inizia dal riarrangiamento DJ (se presente D), e il conseguente V(D)J. Viene perciò creato un trascritto primario che contiene anche sequenze non codificanti fra J e C. Il successivo processamento porta alla formazione di un mRNA maturo pronto per la traduzione.
Scambio di classe
Lo scambio di classe delle catene pesanti avviene durante l’attivazione dei linfociti B nei centri germinativi ad opera dei linfociti T-follicolari e, in porzione minore, nei foci extrafollicolari. Questa capacità di cambiare classe fornisce una versatilità maggiore dal momento che classi diverse svolgono al meglio funzioni effettrici diverse garantendo una alla risposta immunitaria migliore. Il processo è noto come ricombinazione per scambio nella quale un esone V(D)J già riarrangiato ricombina con la regione C di un gene più a valle. Questo processo richiede le sequenze note come regioni di scambio presenti all’estremità 5′ di ogni gene C e precedute da un iniziatore della trascrizione chiamato esone I a sua volta preceduto da una sequenza promotrice. Il tutto prende inizio con CD40 e alcune citochine che attivano la trascrizione dell’esone I, della regione di scambio e dell’esone C del loci μ e della classe interessata allo scambio. Si forma il cosiddetto trascritto germinativo (che non codifica per nessuna proteina) che si lega al filamento codificante del DNA generando un loop R, cioè un’ansa del filamento opposto (non codificante). In quest’ansa agisce l’enzima AID che catalizza la deaminazione delle citosine trasformandole in uracile. Un secondo enzima, la uracil-N-glicosilasi, rimuove i residui di uracile lasciando regioni prive di basi azotate che vengono rimossi da un terzo enzima, ApeI generando dei tagli nel filamento. Questi tagli si ripercuotono anche nel filamento codificante. Le regioni di scambio dei due loci ora possono essere avvicinate ed unite tramite la riparazione delle rotture della doppia elica. L’esone V(D)J viene quindi portato in prossimità della C finale e il tutto viene trascritto e tradotto, formando le Ig volute.
Ipermutazione somatica
Durante la proliferazione dei linfociti B che producono anticorpi avviene una maturazione dell’affinità delle immunoglobuline verso gli antigeni. Nei geni V del locus, infatti, è presente una frequenza di mutazione pari a 1 su 1000 paia di base, circa un migliaio di volte superiore a qualsiasi altro gene del genoma. Questa caratteristica è detta ipermutazione somatica. Questo porta ad una mutazione per ogni mitosi che si estrinseca in un accumulo di mutazioni che portano ad un aumento dell’affinità verso l’antigene. Queste mutazioni sono principalmente concentrate nelle regioni che determinano la complementarità e sono maggiormente presenti nelle IgG che nelle IgM. Uno degli agenti di questa alta frequenza di mutazioni è proprio AID, l’enzima coinvolto nello scambio di classi. La sua capacità di deaminazione delle citosine causa l’eliminazione dell’uracile formato e la sua sostituzione con una base azotata qualsiasi. Tutto ciò è poi controllato da una selezione dei linfociti per impedire che mutazioni errate portino a sviluppare anticorpi inutili o potenzialmente dannosi.
Leggi anche:
Legame con gli antigeni
Un antigene è una qualsivoglia sostanza in grado di legarsi ad un anticorpo (zuccheri, lipidi, ormoni o peptidi di qualsiasi grandezza), mentre un immunogeno è qualcosa in grado di attivare i linfociti B. Nella realtà solo le macromolecole (quindi non tutti gli antigeni) sono in grado di stimolare i linfociti B, dal momento che è necessaria l’aggregazione di più recettori per l’antigene (cross-linking) o antigeni proteici che attivino i linfociti T-helper (che poi attiveranno i B stessi). Molti piccoli antigeni (apteni) non sono immunogeni, ma lo diventano se legati con delle macromolecole (carrier) formando il complesso aptene-carrier. Gli anticorpi si legano solo a specifiche parti degli antigeni denominati determinanti o epitopo. Nel caso delle proteine, costituite da più livelli di organizzazione, esistono due tipi di determinanti: determinanti lineari , che riconoscono la struttura primaria e determinanti conformazionali per la struttura terziaria. Le macromolecole possono contenere più determinanti, anche ripetuti, e la presenza di tali epitopi uguali viene definita polivalenza. La natura dei legami anticorpo-antigene è non covalente e di tipo reversibile. La forza di questo legame è chiamata affinità dell’anticorpo. Una maggiore affinità (espressa in termini della costante di dissociazione) significa che basta una bassa concentrazione dell’antigene perché il legame avvenga. Questo è un concetto importante, perché durante la risposta immunitaria vi è una produzione continua di anticorpi con un’affinità sempre maggiore. Antigeni polivalenti permettono più legami con lo stesso anticorpo. Il legame di IgG e IgE interessa al massimo due siti combinatori, vista la natura monomerica dell’immunoglobulina. Per le IgM, invece, la natura pentamerica permette un legame di un singolo anticorpo con 10 epitopi differenti. La forza del legame con l’anticorpo non dipende solo dall’affinità verso il singolo antigene, ma dalla somma di tutti i legami che possono essere effettuati. Questa forza “multipla” è nota come avidità. In questo modo una Ig a bassa affinità, ma che può effettuare più legami, presenta un’avidità elevata. Questo ha un’importanza funzionale dal momento che si è vista una maggiore efficienza di attivazione della risposta da parte di anticorpi legati a molti antigeni rispetto che una singola Ig con due siti combinatori. L’anticorpo e l’antigene legati insieme formano un immunocomplesso. Esiste una precisa concentrazione detta zona di equivalenza in cui quasi tutti gli anticorpi sono legati con la quasi totalità degli antigeni. Si viene a formare un grosso reticolo molecolare che se accade in vivo può portare a pesanti reazione infiammatorie dette malattie da immunocomplessi. Naturalmente aumentando le molecole di antigeni o anticorpi si sposta l’equilibrio e i grossi complessi si rompono.
Anticorpi come antigeni
Essendo proteine le immunoglobuline, o porzioni di esse, possono essere viste come antigeni. Ogni anticorpo presenta una specifica combinazione di isotipi, allotipi e idiotipo. Si definisce allotipo la variante polimorfica di anticorpi presente in ogni individuo, idiotipo le differenze tra le regioni variabili fra immunoglobuline diverse, isotipo la classe dell’immunoglobulina stessa. L’allotipo è la conseguenza dell’elevato polimorfismo dei geni che codificano per le immunoglobuline ed è quindi possibile riscontrare differenze anche fra anticorpi di individui di una stessa specie. L’idiotipo rappresenta l’individualità dell’anticorpo in sé, dal momento che coincide con il repertorio di antigeni che può legare. L’idiotipo può essere anche definito come la somma di tutti gli idiotopi individuali di una molecola anticorpale, cioè con i determinanti antigenici che possono associarsi con una regione variabile. Ogni anticorpo ha idiotopi multipli. Queste tre caratteristiche possono comportarsi da determinanti antigenici e quindi essere riconosciuti da altre immunoglobuline (rete idiotipica). Esistono anticorpi antiallotipo ed entrano in gioco specialmente quando si inocula in una specie del siero contenente anticorpi prelevati da una specie diversa (e va sotto il nome di malattia da siero), ma anche anticorpi anti-idiotipo.
Leggi anche:
Funzioni e correlazioni strutturali
Specificità e diversificazione
La prima caratteristica che rende gli anticorpi importanti nell’immunità è la specificità con cui riconoscono l’antigene. Sono in grado, infatti, di distinguere tra frammenti proteici che differiscono anche per un solo amminoacido, ma anche di legare più antigeni diversi nel fenomeno conosciuto come cross-reattività. La specificità, però, deriva dalla capacità di creare anticorpi sempre diversi che possano legare antigeni differenti capaci di costituire un repertorio anticorpale estremamente ampio. Questa diversificazione è frutto dei passaggi che portano alla formazione delle immunoglobuline a partire da un ridotto numero di geni (vedi sopra o ricombinazione V(D)J. L’estrema specificità, inoltre, non nasce subito con la produzione del primo anticorpo, ma deriva da una serie di generazioni che portano a miglioramenti successivi e ad una maturazione dell’affinità.
Legame con l’antigene
Le funzioni effettrici delle immunoglobuline entrano in gioco solo dopo il legame con l’antigene. Prima, infatti, non sarebbero in grado di attivare la fagocitosi dei macrofagi (opsonizzazione, da parte delle IgG), la degranulazione di mastociti (IgE) o di attivare il complemento.
Il tipo di classe
È già stato detto come le differenze presenti nelle regioni costanti delle catene pesanti possano costituire classi diverse di immunoglobuline. L’appartenenza ad una classe rispetto che ad un’altra permette agli anticorpi di reagire meglio verso i patogeni per dislocazione (le IgA agiscono prevalentemente nelle mucose), per funzione (solo le IgE possono indurre risposte efficienti verso gli elminti) e per durata (le IgG hanno un’emivita molto più elevata). Ad ogni modo, i linfociti B possono produrre tutti i tipi di classi a partire da IgM o IgD attraverso il fenomeno di switching isotipico (o scambio di classe).
Anticorpi naturali
Gli anticorpi naturali sono un particolare tipo di immunoglobuline che vengono prodotte fisiologicamente senza un’esposizione all’antigene. Questi anticorpi sono per lo più agenti contro carboidrati, antigeni di membrana; prodotti dai linfociti B della zona marginale o linfociti B-1 e dotati di una bassa affinità.
Risposta anticorpale
Gli anticorpi sono i principali protagonisti della risposta immunitaria umorale insieme alle cellule che li producono, i linfociti B. Durante la risposta immunitaria i linfociti B vengono attivati dai linfociti T helper a produrre grandi quantità di anticorpi sempre più efficienti per rispondere al meglio all’ antigene. La principale funzione degli anticorpi è quella di opsonizzare i microbi, cioè legarsi a loro e facilitare la loro distruzione (attraverso fagocitosi o lisi cellulare). Le diverse classi (interscambiabili fra loro) permettono una risposta più efficiente rispetto alla natura e alla localizzazione del patogeno. La risposta primaria si concentra sulla produzione di IgM, mentre successivamente agiscono le IgG.
Neutralizzazione
Il solo legame con l’antigene può impedire diverse funzionalità patogene. Ne sono esempi l’anticorpi contro l’emoagglutina, una proteina usata dal normale virus dell’influenza che legandosi impedisce che infetti altre cellule dell’organismo o i cambiamenti della superficie batterica conseguenti al legame che inibiscono di interagire con i recettori. In altri casi, come i batteri che causano tetano e difterite, gli anticorpi si legano alle tossine che producono impedendo il loro legame su proteine del nostro organismo. La maggior parte degli anticorpi neutralizzanti nel siero è composta da IgG e IgA, sebbene tutte le immunoglobuline possano legare antigeni con la regione variabile.
Opsonizzazione
Come sopra citato, gli anticorpi svolgono la funzione di opsonizzare i patogeni e sono quindi delle opsonine. Questa funzione è svolta dalle IgG. A tal fine macrofagi e neutrofili (altre cellule fagocitarie) sono provvisti di recettori che legano le porzioni Fc. Questo legame causa l’attivazione della fagocitosi e la seguente trasduzione del segnale che porta ad attività microbicida e al processo infiammatorio. Sono stati identificati recettori per le IgG, per IgE, per gli anticorpi polivalenti e il recettore Fc neonatale (FcRn).
Recettori per le IgG
I recettori Fc per le IgG o FcγR sono tutti, salvo per un caso di inibitore, attivatori cellulari. Ne esistono 3 tipi (FcγRI, FcγRII, FcγRIII) con le relative isoforme, ma tutti possiedono una catena α responsabile del legame con le immunoglobuline e della diversa affinità nel legarla. La catena α è quasi sempre associata con delle catene deputate alla trasduzione del segnale. Per il FcγRI sono due catene γ strutturalmente omologhe alle catene ζ del TCR, per il FcγRIII possono essere sia le catene γ che le stesse ζ dei TCR. FcγRII è in grado di trasdurre il legame da sé.
| FcR |
Affinità per Ig |
Domini Ig |
Catene di trasduzione associate |
Distribuzione |
Funzioni |
| FcγRI (CD64) |
Elevata |
3 |
catene γ |
Macrofagi, neutrofili, linfociti B (debolmente) |
Attivazione della fagocitosi |
| FcγRIIA/C (CD32) |
Bassa |
2 |
nessuna |
Macrofagi, neutrofili, eosinofili e C anche sui linfociti NK |
Attivazione cellulare e della fagocitosi |
| FcγRIIB (CD32) |
Bassa |
2 |
nessuna |
Leucociti, linfociti B |
Inibizione dei linfociti B nelle fasi terminali della risposta |
| FcγRIIIA (CD16) |
Bassa |
2 |
catene γ e ζ |
Linfociti NK |
Citotossicità cellulare anticorpo-dipendente |
| FcγRIIIB (CD16) |
Bassa |
2 |
nessuna |
Neutrofili |
Sconosciute |
Dettagli molecolari dell’attivazione
La trasduzione dei segnali è iniziata dal cross-linking delle catene α. Le tappe prevedono:
- fosforilazione dei residui di tirosina nelle sequenze ITAM presenti in tutti i FcγR (tranne FcγRIIB);
- reclutamento di chinasi della famiglia Syk sulle sequenze fosforilate;
- attivazione della PI3 chinasi;
- arrivo di molecole adattatrici come SLP-76 e BLNK, di enzimi e membri della famiglia delle chinasi Tec.
Questi eventi portano alla formazione in grandi quantità di inositolo trifosfato, diaciglicerolo e spostamento di ioni calcio. Il fine ultimo di tutto questo, naturalmente, è la trascrizione dei geni che permettono di effettuare la fagocitosi. Tra questi si annoverano: ossidasi fagocitica (responsabile del burst respiratorio), sintasi dell’ossido nitrico inducibile, enzimi idrolitici. Dopo l’attivazione i fagociti possono anche secernere tutti questi enzimi, indispensabili per l’uccisione di microbi di grandi dimensioni, danneggiando, in minor misura, anche i tessuti stessi.
FcRn
Il recettore Fc neonatale è un recettore legato alla lunga emivita che presentano le IgG rispetto alle altre classi. Il FcRn è inizialmente coinvolto nel trasporto di IgG dalla placenta all’intestino del feto. Nella vita adulta, si posizionano sulla superficie delle cellule endoteliali. Ha una struttura simile alle MHC, ma senza tasca leganti il peptide. Sembra che la principale funzione sia quella di legare le IgG entrate nelle cellule a livello degli endosomi. Qui le trattiene impedendo che vengano degradate e poi rilasciate non appena il recettore viene riespresso sulla membrana. Questa funzione viene usata in terapia per bloccare l’attività di alcune molecole infiammatorie.
Leggi anche:
Recettori per le IgE
Le IgE sono una particolare classe di immunoglobuline implicata soprattutto nelle risposte contro gli elminti e nel causare l’ipersensibilità immediata comunemente nota semplicemente come allergia. Le IgE, a differenza delle IgG, non agiscono opsonizzando e poi legando il recettore Fc, ma prima legando il recettore e successivamente l’antigene. Le principali classi di cellule presentanti recettori per le IgE, detti Fcε, sono i mastociti, granulociti basofili ed eosinofili.
Il recettore espresso da mastociti e basofili ha un’elevata affinità per le catene pesanti ε ed è definito “FcεRI” ed è questo il motivo per cui queste cellule hanno i recettori completamente saturati di anticorpi. FcεRI è stato anche trovato sulle cellule di Langerhans nella cute e su alcuni macrofagi e monociti attivati, sebbene non sia ancora chiaro il loro ruolo.
Esiste anche un altro recettore, definito “FcεRII” o CD23, la cui struttura proteica è molto simile a quello delle lectine di tipo C e presenta un’affinità per le immunoglobuline molto inferiore rispetto all’altro recettore. La sua funzione non è ancora stata chiarita.
Il legame degli antigeni (detti anche allergeni in questo caso) con le IgE già legate ai recettori causa l’attivazione di mastociti e basofili con conseguente rilascio del contenuto dei loro granuli citoplasmatici. Nel caso specifico dei mastociti l’attivazione prevede anche la produzione e secrezione di mediatori lipidici e di citochine.
Struttura di FcεRI
Ogni recettore è composto da 4 catene distinte: una catena α, una β e due catene γ. Ogni catena α comprende due domini Ig responsabili del legame con le IgE. La catena β attraversa 4 volte la membrana cellulare e presenta un solo dominio ITAM (Immunoreceptor Tyrosine-base Activating Motif) e un sito di legame per Lyn nella regione citoplasmatica. Una singola catena γ presenta un dominio ITAM e una corta regione N-terminale extracellulare. Le catene γ sono omologhe alla catena ζ del recettore dei linfociti T e presenta la stessa funzionalità di subunità di trasduzione del segnale delle catene γ degli altri FcR. Gli eosinofili esprimono FcεRI privi della catena β che, partecipando alla trasduzione, risultano quindi meno efficienti.
Dettagli molecolari dell’attivazione dei mastociti
La trasduzione dei segnali è iniziata dal cross-linking delle catene. Le tappe prevedono:
- fosforilazione dei residui di tirosina nelle sequenze ITAM da parte delle proteina Fyn e Lyn associate alle catene β;
- relutamento di chinasi della famiglia Syk sulle sequenze fosforilate;
Questo causa:
- attivazione della PI3 chinasi con conseguente aumento di calcio intercellulare e attivazione della proteina chinasi c;
- attivazione delle chinasi Ras-MAP che attivano la fosfolipasi A2 citoplasmatica che trasforma la fosfatidilcolina in acido arachidonico;
Gli eventi 1. portano sia alla trascrizione di citochine che alla fusione delle membrane dei granuli con il plasmalemma dei mastociti con conseguente rilascio del loro contenuto, mentre gli eventi 2. causano la produzione dei mediatori lipidici.
Attivazione del sistema del complemento
Tra le tre vie di attivazione del sistema del complemento due, la classica e la lectinica, utilizzano gli anticorpi legati ad antigeni per attivarsi. Il complesso C1 e MBL legata alle MASP si legano alle immunoglobuline leganti l’antigene e vanno ad attivare C4 iniziando la cascata del complemento.
Leggi anche:
- Che significa malattia autoimmune? Spiegazione ed esempi
- Differenza tra immunità specifica ed immunità aspecifica
- Differenza tra linfociti B e T
- Differenza tra immunità umorale e cellulare
- Fattore reumatoide alto o basso? Valori normali e Reuma test
- Reuma test positivo o negativo? Cos’è e come si interpreta il valore?
- Differenza tra anticorpo ed autoanticorpo
- Differenza tra self non self in immunologia
- Che significa malattia terminale?
- Artrite reumatoide: sintomi iniziali, cause, cure e mortalità
- Differenze tra artrite ed artrosi: sintomi comuni e diversi
- Differenza artrite reumatoide e artrite psoriasica: sintomi comuni e diversi
- Mycobacterium tuberculosis: il batterio che causa la tubercolosi
- Sintomi della tubercolosi polmonare ed extrapolmonare
- Come si trasmette la tubercolosi?
- Tubercolosi: diagnosi e progressione della malattia
- Test cutaneo della tubercolina: Test di Mantoux per la tubercolosi
- Trattamento farmacologico per la tubercolosi
- Trattamento della tubercolosi resistente ai farmaci
- Tubercolosi: prognosi, vaccino e strategie di prevenzione
- Papilloma vescicale: virus, sintomi, vaccino e cure
- Virus del papilloma (HPV): tipi più pericolosi ed a basso rischio
- Come si contrae il Virus del papilloma (HPV)?
- Infezione da Virus del papilloma, gravidanza e problemi al feto
- Trattamento del Virus del papilloma (HPV)
- Artrite psoriasica e spondiloartriti sieronegative: sintomi, diagnosi e cura
- Terapia con Infrarossi per il dolore
- Ti piace scrocchiare le dita? Ecco cosa succede alle tue ossa e i danni che rischi
- Dolore: cos’è, da cosa è causato, quanti tipi di dolore esistono?
- Nove cose che non sai sul tuo sistema immunitario
- Malattie reumatiche: cosa sono, come si curano, sono pericolose?
- Lupus eritematoso sistemico (LES): cause, sintomi e terapie
- Sclerodermia: cause, sintomi e cura
- Sindrome di Sjögren: sintomi, invalidità, terapia e mortalità
- Fibromialgia: sintomi, cause, cura e tender points
- Fibromialgia: dove si trovano i tender points che provocano dolore alla palpazione?
- Dita ippocratiche congenite e secondarie: cause, sintomi e terapie
- Fenomeno di Raynaud: cause, sintomi e trattamento
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Condividi questo articolo:
 La risposta immunitaria è una forma di difesa dell’organismo verso cellule o sostanze non self (estranee all’organismo) o comunque ritenute potenzialmente dannose per l’organismo. La risposta immunitaria può essere specifica (o adattativa) o aspecifica (innata). La risposta immunitaria specifica può essere ulteriormente distinta in due tipi: umorale o cellulo-mediata.
La risposta immunitaria è una forma di difesa dell’organismo verso cellule o sostanze non self (estranee all’organismo) o comunque ritenute potenzialmente dannose per l’organismo. La risposta immunitaria può essere specifica (o adattativa) o aspecifica (innata). La risposta immunitaria specifica può essere ulteriormente distinta in due tipi: umorale o cellulo-mediata.

 Il sistema immunitario è una complessa rete integrata di mediatori chimici e cellulari, di strutture e processi biologici, sviluppatasi nel corso dell’evoluzione, per difendere l’organismo da qualsiasi forma di insulto chimico, traumatico o infettivo alla sua integrità. Per funzionare correttamente, un sistema immunitario deve essere in grado di rilevare un’ampia varietà di agenti, noti come agenti patogeni, dai virus agli elminti e distinguerli dal proprio tessuto sano dell’organismo.
Il sistema immunitario è una complessa rete integrata di mediatori chimici e cellulari, di strutture e processi biologici, sviluppatasi nel corso dell’evoluzione, per difendere l’organismo da qualsiasi forma di insulto chimico, traumatico o infettivo alla sua integrità. Per funzionare correttamente, un sistema immunitario deve essere in grado di rilevare un’ampia varietà di agenti, noti come agenti patogeni, dai virus agli elminti e distinguerli dal proprio tessuto sano dell’organismo. La risposta immunitaria è una forma di difesa dell’organismo verso cellule o sostanze non self (estranee all’organismo) o comunque ritenute potenzialmente dannose per l’organismo. La risposta immunitaria può essere distinta in due tipi, entrambi importanti per la sua efficacia:
La risposta immunitaria è una forma di difesa dell’organismo verso cellule o sostanze non self (estranee all’organismo) o comunque ritenute potenzialmente dannose per l’organismo. La risposta immunitaria può essere distinta in due tipi, entrambi importanti per la sua efficacia: