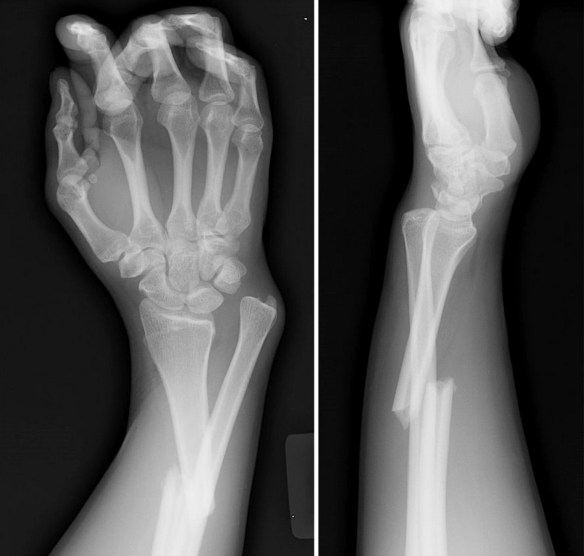
 Quando un osso subisce una frattura, in condizioni fisiologiche inizia un processo biologico di riparazione che con il tempo porta alla formazione del “callo osseo”. Il callo osseo è un tessuto di riparazione che viene creato grazie al processo di callogenesi che solitamente si manifesta dopo tre settimane dall’evento traumatico che ha portato alla frattura. Il callo osseo salda i frammenti dell’osso fratturato e si modifica progressivamente modulandosi in risposta alle forze meccaniche esercitate su di esso, diventando sempre più resistente. Nelle settimane o nei mesi seguenti, il callo osseo ricostituisce l’integrità e le normali caratteristiche biomeccaniche del segmento scheletrico lesionato, tuttavia – se il processo di calcificazione subisce un condizionamento o un’interruzione tale da non consentire un consolidamento – è possibile che la frattura non guarisca correttamente. In tale evenienza si ha la formazione di un callo di tipo fibroso che comporta dolore e limitazione funzionale (pseudoartrosi) e, spesso, rende necessario intervenire chirurgicamente. In alcuni casi si può parlare di “ritardo di consolidazione” quando l’osso inizia a formare callo ma impiega più tempo del normale per ultimare la guarigione. La guarigione dell’osso può essere ostacolata da alcuni fattori di rischio preesistenti come ad esempio patologie metaboliche o fumo di sigaretta.
Quando un osso subisce una frattura, in condizioni fisiologiche inizia un processo biologico di riparazione che con il tempo porta alla formazione del “callo osseo”. Il callo osseo è un tessuto di riparazione che viene creato grazie al processo di callogenesi che solitamente si manifesta dopo tre settimane dall’evento traumatico che ha portato alla frattura. Il callo osseo salda i frammenti dell’osso fratturato e si modifica progressivamente modulandosi in risposta alle forze meccaniche esercitate su di esso, diventando sempre più resistente. Nelle settimane o nei mesi seguenti, il callo osseo ricostituisce l’integrità e le normali caratteristiche biomeccaniche del segmento scheletrico lesionato, tuttavia – se il processo di calcificazione subisce un condizionamento o un’interruzione tale da non consentire un consolidamento – è possibile che la frattura non guarisca correttamente. In tale evenienza si ha la formazione di un callo di tipo fibroso che comporta dolore e limitazione funzionale (pseudoartrosi) e, spesso, rende necessario intervenire chirurgicamente. In alcuni casi si può parlare di “ritardo di consolidazione” quando l’osso inizia a formare callo ma impiega più tempo del normale per ultimare la guarigione. La guarigione dell’osso può essere ostacolata da alcuni fattori di rischio preesistenti come ad esempio patologie metaboliche o fumo di sigaretta.
Leggi anche:
- Femore rotto: tipi di frattura, sintomi, intervento, riabilitazione e conseguenze
- Articolazione del ginocchio: com’è fatta, quali sono le patologie, i sintomi e gli esami da fare ?
- Dismetria degli arti inferiori: una gamba è più corta dell’altra
- Lussazione della spalla: cause, tipi, sintomi e cosa fare per guarire
- Differenza tra femore e anca
- Lesioni da decubito: prevenzione, stadi, classificazione e trattamento
Quali fattori possono condizionare la guarigione ossea?
L’osso guarisce quando la frattura è stabile e ha una vascolarizzazione sufficiente per cui possa formarsi callo osseo. Una corretta alimentazione gioca un ruolo importante nella guarigione dell’osso.
- Stabilità, allineamento, contatto reciproco delle parti, immobilità: la regola più importante è quella che quando un osso si rompe le parti rotte devono essere riallineate e a contatto e non devono muoversi fino a quando non guariscono in quanto anche piccoli movimenti durante la formazione del callo osseo possono disturbare la guarigione e creare una pseudoartrosi. Alcune fratture possono essere stabilizzate semplicemente con un gesso altre richiedono un trattamento chirurgico con una riduzione e la stabilizzazione attraverso mezzi di sintesi come placche, viti, chiodi o fissatori esterni.
- Vascolarizzazione: l’apporto di sangue è fondamentale per la guarigione di una frattura poiché attraverso il sangue vengono trasportati tutti i fattori che sono indispensabili per la formazione del callo osseo
- Nutrizione: avere una alimentazione adeguata è importante per facilitare la guarigione ossea attraverso una dieta sana ed equilibrata che comprende calcio, proteine, vitamina C e D sta alla base di una corretta guarigione dell’osso, integratori alimentari che vanno oltre i requisiti giornalieri non sono necessari (la rara eccezione è rivolta a pazienti gravemente malnutriti con patologie metaboliche o con danni multiorgano, in questo caso il medico potrà consigliare le linee guida dietetiche migliori e eventualmente aggiungere integratori alimentari).
Fasi della osteogenesi ripartiva delle fratture
In sintesi, le fasi che portano alla guarigione di una frattura, sono:
- fase di formazione e di organizzazione dell’ematoma (= travaso emorragico);
- fase di proliferazione e differenziazione tissutale in senso osteogenetico (le cellule ematiche sopraggiunte a livello del focolaio di frattura si differenziano in osteociti);
- fase di maturazione (cioè indurimento, calcificazione de callo) e successivamente fase di rimodellamento (cioè rimaneggiamento del callo che tende a fare scomparire quelli che sono i segni di frattura veri e propri).
Cause di pseudoartrosi
L’osso non guarisce e va in pseudoartrosi quando manca di stabilità sufficiente o il flusso di sangue è ridotto, situazioni che a volte possono coesistere. Un trauma ad alta energia come ad esempio un incidente stradale, può causare una lesione grave che oltre a rompere l’osso determina una compromissione della vascolarizzazione a causa della lesione dei tessuti molli circostanti.
Leggi anche:
- Differenza tra distorsione, lussazione, sublussazione e strappo muscolare
- Sindrome del tunnel carpale: prevenzione, diagnosi e cura di una dolorosa patologia
- Sindrome del piriforme: sintomi, esercizi, cura e recupero
Fattori di rischio
Diversi sono i fattori di rischio che aumentano la probabilità che una frattura vada incontro a pseudoartrosi:
- utilizzo di tabacco o nicotina inibisce la guarigione di una frattura e aumenta la probabilita’ di formazione della pseudoartrosi
- età avanzata
- anemia grave
- diabete
- livelli bassi di vitamina D
- ipotiroidismo
- scarsa o cattiva alimentazione
- utilizzo di famaci come acido acetil-salicilico, ibuprofene e cortisone (il medico deve essere a conoscenza dei farmaci assunti dai pazienti che hanno riportato una frattura per valutare la possibilità di sospendere la terapia durante il periodo di guarigione della frattura)
- infezioni
- fratture esposte (quando l’osso è fuoriuscito dalla pelle)
Compromissione della vascolarizzazione
- Alcune ossa, come ad esempio quelle del piede, hanno una stabilitá intrinseca ed un eccellente apporto di sangue, in questi casi possono guarire anche con un trattamento non chirurgico e una minima stabilità.
- In alcune ossa come ad esempio la testa del femore o lo scafoide del polso, la frattura causa una interruzione della vascolarizzazione e di conseguenza il rischio di pseudoartrosi è elevato.
- Alcune ossa come ad esempio la tibia hanno un apporto di sangue moderato; traumi ad alta energia possono compromettere lo stato cutaneo e favorire la pseudoartrosi della frattura in questo distretto.
Sintomi di pseudoartrosi
La pseudoartrosi solitamente è dolorosa e quando si verifica, insorge dopo un periodo di benessere a seguito del trattamento della frattura, quindi inizia il dolore a distanza di mesi dalla frattura e può essere persistente per mesi o anni, oppure può iniziare quando si utilizza il braccio o la gamba rotta o può essere presente anche a riposo.
Leggi anche:
- Come viene effettuata una ecografia articolare (muscolo tendinea) ed a cosa serve?
- Rottura della cuffia dei rotatori: dolore alla spalla, deficit di forza, diagnosi e cura
- Si rompe il femore a 109 anni: “Ora voglio andare a bere il caffè al bar”
- Ho dimenticato di assumere l’anticoagulante, cosa fare?
Diagnosi di pseudoartrosi
Per diagnosticare una pseudoartrosi il medico ortopedico si avvale degli esami radiografici e a seconda del distretto interessato potrebbero essere richieste semplici radiografie o esami più particolari come la TAC o la RMN. Attraverso queste indagini il medico stabilisce l’avanzamento della guarigione o la presenza di una pseudoartrosi. Solitamente si parla di pseudoartosi quando dagli esami clinici e radiografici il medico ortopedico riscontra:
- dolore persistente da più di 6 mesi nel sito di frattura
- la mancata formazione del callo osseo nei tempi biologici adeguati e durante i controlli nei mesi successivi
- un riassorbimento dei monconi della frattura o uno spazio tra questi
Nel caso in cui si diagnostichi una pseudoartrosi il medico potrà chiedere alcuni esami del sangue per scoprire se esiste una carenza vitaminica o di calcio, una patologia metabolica come diabete e ipotiroidismo o se è in atto un’infezione.
Trattamento della pseudoartrosi
Il trattamento può essere chirurgico o non chirurgico il vostro ortopedico discuterà con voi le possibilità terapeutiche che meglio si adattano al vostro caso esponendovi i rischi ed i benefici della scelta per risolvere il caso di pseudoartrosi.
1) Trattamento non chirurgico. L’utilizzo di uno stimolatore osseo come la magneto terapia o i CEMP (campi elettromagnetici pulsati) viene applicato sulla pelle nella zona di pseudoartrosi, questo piccolo dispositivo eroga onde elettromagnetiche a ultrasuoni o impulsi che stimolano la guarigione dell’osso. Il dispositivo va applicato giornalmente da 20 minuti a diverse ore in base alle disposizioni del vostro ortopedico o fisiatra.
2) Trattamento chirurgico. La chirurgia è necessaria quando i metodi tradizionali di trattamento falliscono. Potrebbe essere necessario un nuovo trattamento chirurgico se il primo trattamento non ha portato a guarigione la frattura. Le opzioni chirurgiche prevedono nuova sintesi della frattura, innesto osseo autologo o da donatore di organi (allograft) o sostituti dell’osso e sintesi interna e/o esterna.
- Innesto osseo autologo: durante questa procedura il chirurgo ortopedico preleva dell’osso in un altro distretto come ad esempio dal bacino, e lo pone nel sito di pseudoartrosi dopo aver tolto il tessuto di guarigione patologico dalla frattura. L’osso utilizzato ha la funzione di supporto funzionale e biologico ovvero serve a rinforzare la stabilità della sintesi e ad apportare cellule e fattori di guarigione nel sito della frattura. Il sito maggiormente utilizzato per il prelievo di tessuto osseo è il bacino, in questo caso il chirurgo fa un’incisione sul bordo della cresta iliaca e da lì preleverà il tessuto osseo sufficiente per trattare la pseudartrosi.
- Allograft (innesto da donatore di organi): un allotrapianto (Allograft) evita di prelevare osso dal paziente e diminuisce quindi la durata dell’intervento ed il dolore post operatorio. Esso fornisce un’impalcatura quindi un supporto funzionale alla stabilità della frattura ma non da nessun apporto biologico in quanto è osso non vitale, motivo per cui viene utilizato spesso in associazione con osso prelevato dal bacino del paziente. Con il tempo l’allograft verrà o riassorbito o sostituito da osso vitale.
- Sostituti dell’osso: come per gli allograft i sostituti dell’osso hanno il vantaggio di ridurre i tempi chirurgici e ridurre il dolore post operatorio da soli non forniscono supporto funzionale nè biologico essi sono trattati con alcune sostanze che attivano e favoriscono la formazione dell’osso .
Molto frequentemente la stabilità della frattura in pseudoartrosi non è data dagli innesti ossei ma questi vanno associati ad una stabilizzazione attraverso sintesi con fissatori interni come placche e viti o chiodi oppure fissatori esterni:
- Fissazione interna: se si verifica una pseudoartrosi dopo un intervento di sintesi interna la scelta chirurgica potrebbe essere una nuova sintesi interna per aumentare la stabilità. Il chirurgo può scegliere di sostituire un chiodo endomidollare con uno di diametro maggiore per aumentare la stabilità della frattura e favorire il sanguinamento nel sito di pseudoartrosi oppure cambiare una placca per aumentare la stabilità utilizzando anche innesti ossei per favorire la guarigione.
- Fissatore esterno è una impalcatura esterna che si fissa all’osso attraverso dei perni rigidi Fiches che vengono avvitati nell’osso stesso lontano dalla frattura e su questi perni esternamente si costruisce l’impalcatura che serve a stabilizzare la frattura. La fissazione esterna può essere utilizzata anche nel caso di una pseudoartrosi infetta dopo rimozione di un dispositivo di fissazione interna.
Leggi anche:
- Perché la frattura di femore può portare alla morte del paziente?
- Come capire se ho una frattura di femore?
- Fratture al femore: ritornare a camminare è possibile?
- Frattura di femore: perché è importante recuperare rapidamente?
- Differenza tra osso compatto e spugnoso
- Differenza tra osso fibroso e lamellare
- I tipi di tessuto osseo: cellule, matrice, formazione e struttura
- Differenza tra osso e cartilagine: funzioni, composizione e durezza
- Differenza tra osso sacro e coccige
- Osso sacro e coccige: dove si trovano ed a che servono?
- Differenza ossa umane e animali
- Differenza tra ossa pari, impari e mediane con esempi
- Differenza tra midollo osseo e spinale
- A cosa serve il midollo osseo?
- Differenza tra midollo giallo e rosso
- Differenza tra midollo osseo e cellule staminali
- Differenza tra epifisi, diafisi, metafisi ed ipofisi
- Differenza tra osso ed avorio: come distinguerli
- Tendine e muscolo semitendinoso: anatomia, funzioni ed uso chirurgico
- Differenza tra tendine rotuleo e semitendinoso
- Tendine rotuleo: anatomia, funzioni e patologie in sintesi
- Lesione del legamento crociato anteriore: ricostruzione in artroscopia
- Differenza delle lesioni dei legamenti crociato anteriore e posteriore
- Tendinite del rotuleo: cause, sintomi e rimedi dell’infiammazione
- Valgismo di arti inferiori e ginocchio: cause, sintomi e rimedi
- Pubalgia del podista: cause, diagnosi e rimedi
- Differenza tra ginocchio valgo e varo
- Strabismo rotuleo: cause, sintomi e rimedi
- Formicolio alla gamba ed al piede: cause, diagnosi, sintomi e rimedi
- Strappo muscolare a braccio, coscia, schiena: cosa fare?
- Contrattura muscolare a schiena, coscia, polpaccio, collo: cosa fare?
- Stiramento muscolare: cause, sintomi e rimedi
- Differenza tra stiramento, strappo, contrattura, distorsione e distrazione
- Postura sbagliata: come correggerla, specie seduti alla scrivania
- Colpo della strega: cause, sintomi, rimedi e prevenzione
- Muscolo piriforme: anatomia, funzioni e cosa fare se è infiammato
- Encefalopatia traumatica cronica: cos’è e quali sport sono a rischio?
- Differenza tra sciatalgia e finta sciatalgia
- Nervo sciatico (ischiatico): anatomia, funzioni e patologie
- Articolazione del ginocchio: com’è fatta, quali sono le patologie, i sintomi e gli esami da fare?
- Quante ossa ed articolazioni abbiamo nel nostro corpo?
- Differenza tra rotula e menisco
- Femore: anatomia, funzioni e muscoli in sintesi
- Quante ossa ci sono nella mano e come si chiamano?
- Quante ossa ha il piede e come si chiamano?
- Le 7 fasi della deglutizione (volontarie ed involontarie)
- Glucosamina e condroitina: dose, efficacia e controindicazioni
- Differenza tra artrite ed artrosi: come riconoscerle
- Articolazioni: cosa sono, come sono fatte e come funzionano
- Dolori alle articolazioni: cosa fare? Cause e rimedi
- Dolori alle articolazioni: consigli per la prevenzione e cura
- Gotta: sintomi, cause, dieta e rimedi per la malattia
- Differenza tra gotta ed artrite reumatoide
- Differenza tra gotta ed alluce valgo
- Dolore che interessa una singola articolazione: cause e terapia
- Dolore che interessa varie articolazioni (poliarticolare): cause e rimedi
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su YouTube, su LinkedIn, su Tumblr e su Pinterest, grazie!

 Prima di iniziare la lettura, per meglio comprendere l’argomento, vi consiglio di leggere:
Prima di iniziare la lettura, per meglio comprendere l’argomento, vi consiglio di leggere:  I farmaci usati nel trattamento della stipsi sono diversi: antrachinoni, lassativi di volume, emollienti/lubrificanti, anticolinesterasici (o para-simpaticomimetici), lassativi salini.
I farmaci usati nel trattamento della stipsi sono diversi: antrachinoni, lassativi di volume, emollienti/lubrificanti, anticolinesterasici (o para-simpaticomimetici), lassativi salini.
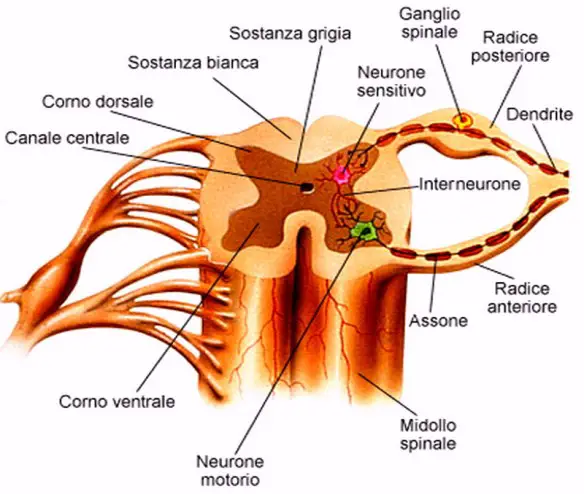 L’atrofia muscolare progressiva, detta anche atrofia muscolare di Duchenne-Aran o malattia di Duchenne-Aran, nota anche con l’acronimo AMP o in inglese PMA (Progressive muscular atrophy), è una malattia neurologica configurabile attualmente quale rara forma di malattia del motoneurone (Motor neurone disease, MND), considerata talvolta relativa o collegata alla sclerosi laterale amiotrofica. La PMA colpisce solo il 2° motoneurone, lasciando intatto il 1°.
L’atrofia muscolare progressiva, detta anche atrofia muscolare di Duchenne-Aran o malattia di Duchenne-Aran, nota anche con l’acronimo AMP o in inglese PMA (Progressive muscular atrophy), è una malattia neurologica configurabile attualmente quale rara forma di malattia del motoneurone (Motor neurone disease, MND), considerata talvolta relativa o collegata alla sclerosi laterale amiotrofica. La PMA colpisce solo il 2° motoneurone, lasciando intatto il 1°.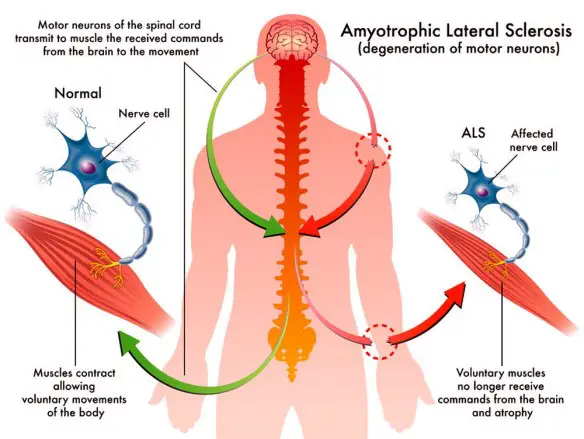 La sclerosi multipla, SM, e la sclerosi laterale amiotrofica, SLA, vengono confuse molto spesso tra i non “addetti ai lavori”, questo a causa del termine “sclerosi” che le due patologie hanno in comune, pur essendo molto diverse tra loro.
La sclerosi multipla, SM, e la sclerosi laterale amiotrofica, SLA, vengono confuse molto spesso tra i non “addetti ai lavori”, questo a causa del termine “sclerosi” che le due patologie hanno in comune, pur essendo molto diverse tra loro. La SLA, Sclerosi laterale amiotrofica, conosciuta anche come “malattia dei motoneuroni“, “malattia di Lou Gehrig” (dal nome del giocatore di baseball la cui malattia nel 1939 fu portata all’attenzione pubblica) o “malattia di Charcot” (dal cognome del neurologo francese che per la prima volta descrisse questa patologia nel 1860), è una malattia neurodegenerativa progressiva che colpisce i motoneuroni, ovvero le cellule nervose cerebrali e del midollo spinale in grado di regolare l’attività di contrazione dei muscoli volontari. La morte di queste particolari cellule avviene gradualmente, in un lasso di tempo che può andare da diversi mesi a diversi anni, e la gravità può variare molto da un paziente all’altro.
La SLA, Sclerosi laterale amiotrofica, conosciuta anche come “malattia dei motoneuroni“, “malattia di Lou Gehrig” (dal nome del giocatore di baseball la cui malattia nel 1939 fu portata all’attenzione pubblica) o “malattia di Charcot” (dal cognome del neurologo francese che per la prima volta descrisse questa patologia nel 1860), è una malattia neurodegenerativa progressiva che colpisce i motoneuroni, ovvero le cellule nervose cerebrali e del midollo spinale in grado di regolare l’attività di contrazione dei muscoli volontari. La morte di queste particolari cellule avviene gradualmente, in un lasso di tempo che può andare da diversi mesi a diversi anni, e la gravità può variare molto da un paziente all’altro.