
L’emicrania è un mal di testa caratterizzato da un dolore prevalentemente unilaterale (ma può anche essere bilaterale), di intensità moderata o severa, descritto come pulsante, che tende a peggiorare con il movimento e con gli sforzi fisici e solitamente risulta associato a nausea e/o vomito. Generalmente il dolore si sviluppa nella regione frontotemporale per poi estendersi a tutto il capo e in alcuni casi anche al collo. I soggetti colpiti da emicrania manifestano disturbi nei confronti della luce (fotofobia), disturbi nei confronti del rumore (fonofobia) e, in alcuni casi, disturbi nei confronti di odori (osmofobia). Solitamente il paziente desidera e ha bisogno di stare a letto, a riposo assoluto, in ambiente buio e silenzioso. La durata degli attacchi è compresa tra 4 e 72 ore. La presenza media dell’emicrania nella popolazione adulta è di circa il 12% (18% nelle donne e 6% negli uomini). L’emicrania si distingue in due forme: emicrania senza aura ed emicrania con aura (quest’ultima è meno frequente).
Leggi anche:
- Emicrania senza aura: cause, sintomi, diagnosi e trattamenti
- Differenza tra emicrania con aura ed emicrania senza aura
Cos’è l’aura?
A tale proposito leggi questo articolo: Cos’è l’aura emicranica?
Cos’è l’emicrania con aura?
Nella forma con aura, l’emicrania è preceduta da diversi sintomi tipo visione di lampi (fotopsia), scotomi scintillanti, deformazioni degli oggetti, emianopsia (oscuramento di metà campo visivo), ma anche addormentamento del braccio e della gamba (parestesia), disturbi della parola di tipo afasico (se la cefalea è localizzata a sinistra). Alla cessazione dei sintomi che costituiscono l’aura inizia l’emicrania, che si accompagna generalmente a nausea, vomito, fotofobia, fonofobia e osmofobia.
Quali sono le cause dell’emicrania con aura?
All’origine dell’emicrania sembrerebbe esserci un particolare processo caratterizzato dallo spasmo rapido dei vasi encefalici seguito da una prolungata vasodilatazione. Quali siano le cause che, a loro volta, provocano l’innescarsi di questo particolare meccanismo non è però ancora noto. Nonostante le cause all’origine di questo disturbo non siano ancora note, alcuni fattori possono risultare scatenanti, come ad esempio il consumo di particolari alimenti, variazioni delle abitudini di vita o dei ritmi di sonno/veglia, eventi particolarmente stressanti.
Quali sono i sintomi dell’emicrania con aura?
Nell’emicrania con aura il dolore tipico dell’emicrania è preceduto da diversi sintomi, che possono durare tra i 10 e i 60 minuti, tra cui:
- visione di lampi (fotopsia);
- scotomi scintillanti;
- deformazioni degli oggetti;
- emianopsia (oscuramento di metà campo visivo);
- addormentamento del braccio e della gamba (parestesia);
- disturbi della parola di tipo afasico (se la cefalea è localizzata a sinistra).
Alla cessazione dei sintomi che costituiscono l’aura inizia l’emicrania, che si accompagna generalmente a nausea, vomito, fotofobia, fonofobia e osmofobia.
Leggi anche:
- Perché sogniamo? Perché ricordiamo alcuni sogni e altri no? Cos’è un sogno lucido e la fase REM?
- Differenze tra fase REM e NON REM del sonno
Diagnosi
La diagnosi di emicrania con aura può essere fatta quando si siano verificati almeno due attacchi con le medesime caratteristiche. La storia clinica e l’esame obiettivo e neurologico serviranno per escludere un’origine secondaria dell’emicrania (attribuibile, cioè, ad altre patologie).
Trattamento e prevenzione
Nei soggetti che soffrono di un numero limitato di crisi emicraniche all’anno la terapia farmacologica è mirata a stroncare l’attacco (terapia sintomatica), mentre quando le crisi sono frequenti e ricorrenti si prende in considerazione una finalità preventiva (terapia preventiva).
Tra i farmaci più utilizzati nella terapia sintomatica dell’attacco emicranico ci sono i comuni analgesici non steroidei (Fans) e i triptani: entrambe queste tipologie di farmaci riescono a stroncare l’attacco doloroso, mentre generalmente non riescono a sortire effetto sull’aura.
I farmaci di prevenzione vengono impiegati soprattutto sui soggetti – che costituiscono la minoranza – che presentano attacchi di emicrania molto frequenti. I rimedi più frequenti contro le crisi sono il metoprololo, la flunarizina, l’amitriptilina e la lamotrigina, che sembrerebbe essere efficace sia sull’attacco doloroso che sull’aura. Tra le terapie preventive non farmacologiche vanno segnalati il biofeedback e l’agopuntura.
Leggi anche:
- La morte per mancanza di sonno è davvero possibile? Per quanto tempo si può restare svegli?
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Cervello maschile e femminile: quali sono le differenze?
- Cervelletto: anatomia esterna ed interna
- Cervelletto: le lesioni cerebellari più comuni
- Le funzioni del cervelletto: apprendimento e correzione dei movimenti del corpo
- Jet lag: cos’è, quanto dura, sintomi, rimedi e melatonina
- Mal d’auto, di mare, d’aereo: cinetosi, rimedi e farmaci per bambini ed adulti
- Cocaina: effetti a breve e lungo termine e loro durata
- Meccanismo d’azione della cocaina: il reuptake della dopamina
- Cocaina: trattamenti psicoterapici per contrastare la dipendenza
- Cocaina in gravidanza: effetti sul feto e sul bambino
- Cocaina: trattamenti farmacologici per contrastare l’astinenza
- Differenza tra cocaina e crack
- Uso cronico di cocaina: i danni al naso e ai denti
- Cocaina: i sintomi in caso di uso, abuso ed overdose
- Astinenza da cocaina: i principali sintomi del craving
- Ollie, il “bambino Pinocchio” nato con il cervello nel naso
- Dolore: cos’è, da cosa è causato, quanti tipi di dolore esistono?
- Farmaci antidepressivi: cosa sono, a cosa servono e quali tipi esistono
- Sostanze naturali ad azione antidepressiva
- Farmaci Inibitori Selettivi della Ricaptazione della Serotonina (SSRI): cosa sono ed a che servono
- Antidepressivi SSRI: meccanismo d’azione e farmacocinetica
- SSRI: efficacia in depressione, disturbo ossessivo compulsivo, ansia ed eiaculazione precoce
- SSRI: uso di antidepressivi in gravidanza ed allattamento
- SSRI: effetti collaterali, disfunzioni sessuali, sospensione e suicidio
- Disfunzione sessuale post-SSRI: sintomi, effetti a lungo termine e cure
- SSRI: effetti a breve e lungo termine
- SSRI in pazienti con diabete, iponatriemia, osteoporosi e prolungamento QT
- Inibitori della ricaptazione della serotonina-norepinefrina (SNRI)
- Disturbo ossessivo compulsivo: il trattamento con farmaci e terapia cognitivo-comportamentale è la migliore scelta
- Citalopram (Elopram): modalità d’assunzione e meccanismo d’azione
- Citalopram (Elopram): lista degli effetti collaterali del farmaco
- Citalopram (Elopram): interruzione, astinenza, diabete e prolungamento QT
- Citalopram (Elopram): uso in gravidanza ed allattamento
- Fluoxetina (Fluoxeren): meccanismo d’azione del farmaco
- Fluoxetina (Fluoxeren): lista degli effetti collaterali e diabete
- Fluoxetina (Fluoxeren): uso in gravidanza ed allattamento
- Antidepressivi triciclici: tipi, indicazioni e meccanismo di azione
- Antidepressivi triciclici: tipici effetti collaterali dei farmaci
- Antidepressivi triciclici: overdose, tossicità e trattamento
- Antipsicotici (neurolettici): classificazione, usi e meccanismo di azione
- Farmaci antipsicotici: differenza tra neurolettici tipici ed atipici
- Farmaci antipsicotici (neurolettici): lista degli effetti collaterali
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!

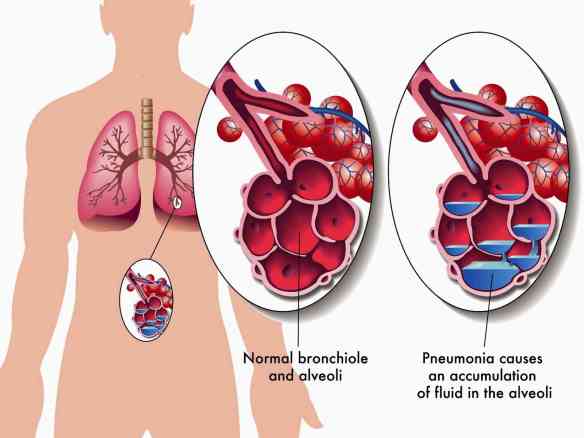 L’edema polmonare è una condizione caratterizzata da un aumento dei liquidi nello spazio extravascolare (interstizio e alveoli) a livello del parenchima dei polmoni. L’edema polmonare acuto può essere secondario ad un aumento della pressione idrostatica nei capillari polmonari (insufficienza cardiaca o scompenso cardiaco acuto in lingua inglese acute heart failure, AHF), stenosi mitralica o ad un’alterazione delle membrane alveolocapillari (inalazione di sostanze irritanti, processi infettivi). Accumulandosi all’interno degli alveoli, le strutture in cui avvengono gli scambi di ossigeno tra l’aria e il sangue, i fluidi causano problemi respiratori.
L’edema polmonare è una condizione caratterizzata da un aumento dei liquidi nello spazio extravascolare (interstizio e alveoli) a livello del parenchima dei polmoni. L’edema polmonare acuto può essere secondario ad un aumento della pressione idrostatica nei capillari polmonari (insufficienza cardiaca o scompenso cardiaco acuto in lingua inglese acute heart failure, AHF), stenosi mitralica o ad un’alterazione delle membrane alveolocapillari (inalazione di sostanze irritanti, processi infettivi). Accumulandosi all’interno degli alveoli, le strutture in cui avvengono gli scambi di ossigeno tra l’aria e il sangue, i fluidi causano problemi respiratori.
 Il linfoma non Hodgkin è un tumore che nasce nel sistema linfatico e si sviluppa dai linfociti, cellule presenti nel sangue e nel tessuto linfatico di linfonodi, milza, timo, midollo osseo, tonsille e altre piccole aree dell’organismo. Invece di combattere le malattie, i linfociti (linfociti B o linfociti T) si accumulano nei linfonodi e in altri organi. Il linfoma non Hodgkin ha un’incidenza di 5 volte maggiore rispetto al linfoma di Hodgkin, e il 95% dei pazienti colpiti da questa malattia sono adulti. Sono state identificate almeno 30 forme diverse di questo tipo di tumore.
Il linfoma non Hodgkin è un tumore che nasce nel sistema linfatico e si sviluppa dai linfociti, cellule presenti nel sangue e nel tessuto linfatico di linfonodi, milza, timo, midollo osseo, tonsille e altre piccole aree dell’organismo. Invece di combattere le malattie, i linfociti (linfociti B o linfociti T) si accumulano nei linfonodi e in altri organi. Il linfoma non Hodgkin ha un’incidenza di 5 volte maggiore rispetto al linfoma di Hodgkin, e il 95% dei pazienti colpiti da questa malattia sono adulti. Sono state identificate almeno 30 forme diverse di questo tipo di tumore. Il linfoma di Hodgkin può colpire tutte queste parti del corpo e poi diffondersi ad altri organi. Nel linfoma di Hodgkin, le cellule del sistema linfatico (chiamate linfociti B) crescono in modo anormale e possono accumularsi sia nel sistema linfatico stesso che in altri organi. Con il progredire della malattia, viene compromessa la capacità dell’organismo di combattere le infezioni.
Il linfoma di Hodgkin può colpire tutte queste parti del corpo e poi diffondersi ad altri organi. Nel linfoma di Hodgkin, le cellule del sistema linfatico (chiamate linfociti B) crescono in modo anormale e possono accumularsi sia nel sistema linfatico stesso che in altri organi. Con il progredire della malattia, viene compromessa la capacità dell’organismo di combattere le infezioni.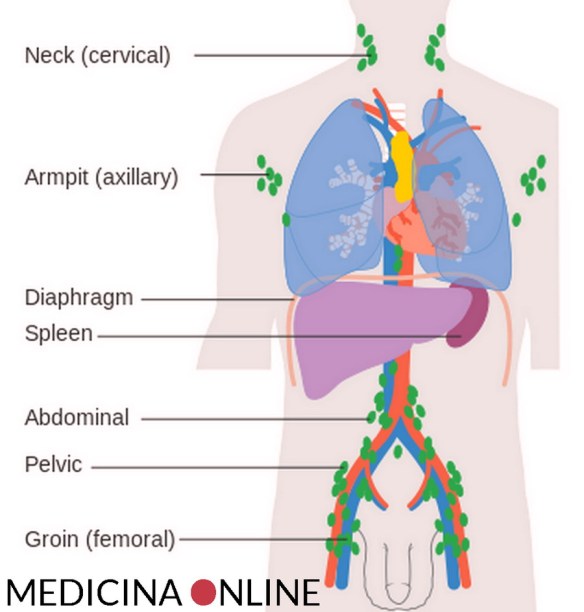 Il linfoma è una malattia del sistema linfatico, cioè dell’insieme di tessuti che hanno la funzione di difendere l’organismo dagli agenti esterni e dalle malattie. Questo sistema comprende i linfonodi, la milza, il timo, il midollo osseo e altre piccole aree dell’organismo. I linfomi fanno parte del più ampio gruppo di neoplasie dei tessuti linfoidi (linfociti T e B e loro precursori). A livello mondiale si stima che attualmente vi siano circa 600.000 linfomi all’anno con circa 300.000 decessi. I linfomi costituiscono il 4% di tutti i tumori e ciò li rende la settima forma più comune tra gli adulti, nei bambini sono il terzo tumore più comune.
Il linfoma è una malattia del sistema linfatico, cioè dell’insieme di tessuti che hanno la funzione di difendere l’organismo dagli agenti esterni e dalle malattie. Questo sistema comprende i linfonodi, la milza, il timo, il midollo osseo e altre piccole aree dell’organismo. I linfomi fanno parte del più ampio gruppo di neoplasie dei tessuti linfoidi (linfociti T e B e loro precursori). A livello mondiale si stima che attualmente vi siano circa 600.000 linfomi all’anno con circa 300.000 decessi. I linfomi costituiscono il 4% di tutti i tumori e ciò li rende la settima forma più comune tra gli adulti, nei bambini sono il terzo tumore più comune. Ogni anno, puntuali come le vacanze, le meduse compaiono nei nostri mari. E ogni anno si parla di nuovo record di presenze: ultimamente nel Mediterraneo ne sono state avvistate anche alcune specie tropicali, forse attirate dell’innalzamento delle temperature. Ma non illudiamoci: le meduse non sono mai mancate, e la loro presenza è stata spiegata di volta in volta con l’impatto delle attività umane sull’ecosistema marino, sulla pulizia delle acque e con altri motivi più o meno plausibili. Normalmente compaiono verso la fine di aprile, dopo la fioritura del fitoplancton e la comparsa dei crostacei, e restano per tutta l’estate, con diverse specie che si alternano in base alla temperatura dell’acqua e alla presenza di nutrimenti. Non tutte le meduse ‘pungono’, e comunque quelle avvistate finora nel Mediterraneo non sono mortali, ma hanno solo effetti dermo-tossici (sì, ne esistono anche in grado di causare shock anafilattici mortali). Di sicuro c’è solo che conviene starne alla larga: anche le poche specie non urticanti infatti hanno i tentacoli dotati di cnidocisti, i piccoli organi che contengono il veleno, che se pure sono innocui per le mani e la pelle potrebbero comunque provocare infiammazioni dolorose o potenzialmente pericolose a parti più delicate del nostro corpo come occhi o mucose.
Ogni anno, puntuali come le vacanze, le meduse compaiono nei nostri mari. E ogni anno si parla di nuovo record di presenze: ultimamente nel Mediterraneo ne sono state avvistate anche alcune specie tropicali, forse attirate dell’innalzamento delle temperature. Ma non illudiamoci: le meduse non sono mai mancate, e la loro presenza è stata spiegata di volta in volta con l’impatto delle attività umane sull’ecosistema marino, sulla pulizia delle acque e con altri motivi più o meno plausibili. Normalmente compaiono verso la fine di aprile, dopo la fioritura del fitoplancton e la comparsa dei crostacei, e restano per tutta l’estate, con diverse specie che si alternano in base alla temperatura dell’acqua e alla presenza di nutrimenti. Non tutte le meduse ‘pungono’, e comunque quelle avvistate finora nel Mediterraneo non sono mortali, ma hanno solo effetti dermo-tossici (sì, ne esistono anche in grado di causare shock anafilattici mortali). Di sicuro c’è solo che conviene starne alla larga: anche le poche specie non urticanti infatti hanno i tentacoli dotati di cnidocisti, i piccoli organi che contengono il veleno, che se pure sono innocui per le mani e la pelle potrebbero comunque provocare infiammazioni dolorose o potenzialmente pericolose a parti più delicate del nostro corpo come occhi o mucose. I farmaci usati nel trattamento della stipsi sono diversi: antrachinoni, lassativi di volume, emollienti/lubrificanti, anticolinesterasici (o para-simpaticomimetici), lassativi salini.
I farmaci usati nel trattamento della stipsi sono diversi: antrachinoni, lassativi di volume, emollienti/lubrificanti, anticolinesterasici (o para-simpaticomimetici), lassativi salini.