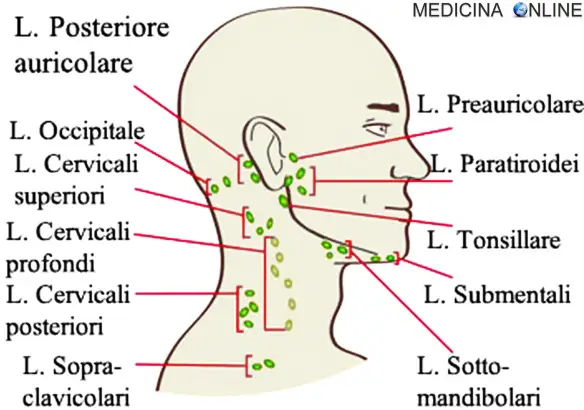
 Nel linguaggio comune, quando si usa il termine “ghiandola”, specialmente in riferimento alle differenze tra “ghiandola” e “tonsille”, ci si Continua a leggere
Nel linguaggio comune, quando si usa il termine “ghiandola”, specialmente in riferimento alle differenze tra “ghiandola” e “tonsille”, ci si Continua a leggere
Archivi tag: linfonodi
Tumore al polmone operabile ed inoperabile: stadiazione
 Le forme di carcinoma polmonare vengono classificate in base a vari fattori:
Le forme di carcinoma polmonare vengono classificate in base a vari fattori:
- “T” indica l’estensione e la localizzazione del tumore;
- “N” indica coinvolgimento linfonodale;
- “M0” indica l’assenza di metastasi;
- “M1” indica la presenza di metastasi;
- il numero accanto alla lettera indica la gravità (maggiore è il numero e maggiore è la gravità).
Linfedema a caviglie, gambe e braccia: cos’è e come si cura
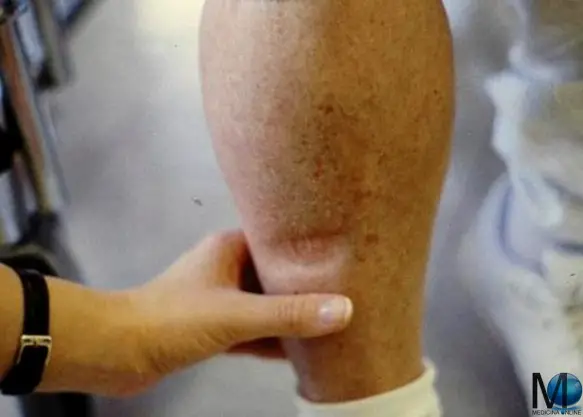 Il linfedema è una condizione che si manifesta con un gonfiore e che può interessare il braccio, la gamba, la caviglia in particolare o altre parti del corpo. Colpisce prevalentemente (ma non esclusivamente) in modo monolaterale, cioè ad esempio una sola gamba piuttosto che entrambe. Da un punto di vista clinico, la presenza di liquidi stagnanti nei tessuti viene resa evidente dal segno della fovea (vedi foto in alto) che è rappresentato dal segno che rimane impresso nella cute dopo una pressione effettuata con un dito. Il sospetto di linfedema viene confermato successivamente da tecniche di diagnostica per immagini. La cura può essere sia medica che chirurgica.
Il linfedema è una condizione che si manifesta con un gonfiore e che può interessare il braccio, la gamba, la caviglia in particolare o altre parti del corpo. Colpisce prevalentemente (ma non esclusivamente) in modo monolaterale, cioè ad esempio una sola gamba piuttosto che entrambe. Da un punto di vista clinico, la presenza di liquidi stagnanti nei tessuti viene resa evidente dal segno della fovea (vedi foto in alto) che è rappresentato dal segno che rimane impresso nella cute dopo una pressione effettuata con un dito. Il sospetto di linfedema viene confermato successivamente da tecniche di diagnostica per immagini. La cura può essere sia medica che chirurgica.
Perché si verifica il linfedema?
Il linfedema si può verificare in varie condizioni come in caso di patologia dei linfonodi, di ostruzione al deflusso della linfa o quando i linfonodi sono asportati con un intervento chirurgico. Ciò causa uno squilibrio della circolazione linfatica, per cui la linfa, non potendo più defluire nell’arto interessato attraverso i vasi linfatici interrotti, ristagna nei tessuti, dando appunto luogo al linfedema. I pazienti affetti da alcuni tipi di tumore (mammella, melanoma, utero, prostata…) possono sviluppare un linfedema in conseguenza dell’asportazione chirurgica dei linfonodi, della radioterapia o dell’ostruzione delle vie e/o delle ghiandole linfatiche da parte di cellule tumorali.
Chi è più a rischio di sviluppare linfedema?
L’incidenza maggiore la si ha intorno alla metà della terza decade di età, esistono le forme precoci (se dovesse manifestarsi durante l’adolescenza o addirittura alla nascita) e tardive (se dovesse mostrarsi in seguito), il sesso femminile per il linfedema inferiore è il più colpito, per il resto non si mostrano differenze nei sessi. Mancano dati precisi sulla diffusione del linfedema primario ma la sua incidenza annuale è stimata intorno a 1,5/100.000 soggetti di età inferiore ai 20 anni.
Leggi anche: Segno della fovea in medicina: cos’è e cosa indica
Tipi di linfedema
Esistono due forme principali di linfedema:
- linfedema primario: causato da anomalie linfatiche congenite;
- linfedema secondario: causato da ostruzione al deflusso della linfa determinato da varie patologie.
Edema linfatico primario
Le forme primarie (non derivate) sono formate da anomalie congenite del sistema linfatico, queste possono essere di varia natura (morfologiche e funzionali)
- edema linfatico congenito, in tale forma si ritrova anche la malattia di Milroy;
- edema linfatico precoce;
- edema linfatico tardivo.
Il linfedema primario coinvolge prevalentemente, ma non esclusivamente, gli arti inferiori. Nonostante la causa sia una alterazione congenita delle vie linfatiche, l’edema è solo molto raramente presente sin dalla nascita. Nella maggior parte dei casi il suo esordio avviene entro i 35 anni (insorgenza precoce), con un picco di comparsa intorno ai 17 anni; non è rara tuttavia è la sua insorgenza dopo i 35 anni (insorgenza tardiva). Colpisce prevalentemente il sesso femminile (rapporto femmine:maschi, 7:1) e coinvolge nella metà dei casi un solo arto mentre un interessamento bilaterale è riscontrabile soltanto nel 25% dei casi.
Leggi anche: Sistema linfatico e linfonodi: anatomia e funzioni in sintesi
Edema linfatico secondario
L’ostruzione, causa del linfedema, viene causata da un’altra malattia, sovente si tratta di forme tumorali ma possono essere dovute a adenopatie, sindrome, postflebitica, linfangite. Il linfedema si manifesta soprattutto dopo il trattamento chirurgico di asportazione di linfonodi e/o la radioterapia effettuate per una malattia neoplastica. Nonostante il miglioramento delle tecniche chirurgiche, sempre meno invasive, e radioterapiche l’incidenza del linfedema rimane significativa: nelle persone operate per tumore al seno circa il 25% di coloro che hanno subito una asportazione dei linfonodi ascellari e anche il 5% di coloro che hanno subito l’asportazione del linfonodo sentinella, possono presentare un linfedema clinicamente rilevante negli anni successivi. Tale incidenza è addirittura superiore, intorno al 40%, delle persone sottoposte ad interventi di asportazione dei linfonodi inguinali, pelvici ed addominali come effettuato in caso di tumori in campo ginecologico e urinario. Queste percentuali aumentano significativamente se, oltre all’asportazione dei linfonodi, si rende necessario anche un trattamento radioterapico. La comparsa del linfedema è molto precoce solo in pochi casi mentre, solitamente, insorge nel corso dei primi 2-3 anni dalle cure chirurgiche; in diversi casi può comparire anche dopo molti anni dall’intervento. Il linfedema dell’arto superiore compare infatti nel 60% dei casi entro 2 anni dall’intervento e l’80% entro 5 anni, mentre il linfedema dell’arto inferiore compare nell’80% dei casi entro 1 anno dall’intervento. Il linfedema secondario, una volta instaurato, purtroppo non guarisce mai completamente, ma grazie ai trattamenti riabilitativi e/o farmacologici è possibile controllarne le dimensioni e i sintomi correlati (pesantezza, indolenzimento, fastidio).
Leggi anche: Linfodrenaggio manuale con metodo Vodder e Leduc: controindicazioni e tecniche
Sintomi e segni di linfedema
Fra i sintomi e i segni clinici si riscontrano dolore (da un leggero dolore quando la parte viene pizzicata ad un dolore più persistente), facile affaticamento degli arti interessati, diminuzione della normale mobilità di questi, vi possono essere anche disturbi psicologici per via del disagio subito. Viene impedito il segno di Stemmer, fra le complicanze si ritrova l’ipercheratosi. Esteticamente, a seconda della gravità fisica e congenita del soggetto colpito dalla patologia, si riscontrerà una maggiore o minore sproporzione tra la parte interessata ed il resto del corpo, mostrando le parti infiammate come tendenzialmente informi, facendole assomigliare ad un blocco unico con la progressiva scomparsa della loro naturale definizione. Quindi questa condizione medica coinvolge anche soggetti normopeso e non necessariamente obesi come si potrebbe supporre. A lungo andare, nel caso di mancate cure mediche e trattamenti adeguati, i tessuti tenderanno a fibrotizzarsi. Oltre all’edema cronico, il paziente affetto da linfedema può lamentare altri sintomi, come:
- ispessimento della pelle;
- pelle fragile, suscettibile alle infezioni;
- alterazione della cromia della pelle. Lungo l’arto colpito dal linfedema, non è raro osservare una variazione della cromia della cute: la pelle tende a scolorire e diviene lucida;
- difficoltà nel muovere o piegare l’arto colpito da linfedema;
- percezione costante di appesantimento e costrizione dell’arto affetto da linfedema (gambe pesanti e doloranti);
- prurito e tensione della pelle dell’arto coinvolto.
Diagnosi di linfedema
La diagnosi di linfedema si avvale di vari strumenti da associare all’esame obiettivo:
- linfografia: è una radiografia che si avvale di un mezzo di contrasto che viene iniettato nell’organismo per fornire indicazioni più precise, ma vi sono alcune limitazione dell’evento che favoriscono l’uso di altri esami;
- linfoscintigrafia: è probabilmente la migliore tecnica diagnostica per lo studio del linfedema. La rilevazione viene effettuata da gammacamera di albumina marcata con Tecnezio 99 e iniettata negli arti interessati a confronto.
- linfangioscopia: nella quale si controlla lo stato di diffusione di un determinato colorante precedentemente iniettato, dato che in caso di linfedema il colorante non segue il normale percorso di propagazione.
- Biopsia.
Per accertare un sospetto di linfedema, è possibile avvalersi anche di risonanza magnetica, TAC ed ecografia con colordoppler.
Leggi anche: Differenza tra pressoterapia e cavitazione: quale preferire?
Diagnosi differenziale
La diagnosi differenziale si pone con malattie che presentano simili sintomi e segni, come un flebedema, in cui vi è una consistenza molle, al contrario del linfedema che può presentarsi anche come molto compatto. Vi possono essere problemi di identificazione della patologia relativa soprattutto all’inizio dell’insorgenza dove le varie differenze sono molto lievi, ma generalmente nelle donne si tratta di linfedema, accompagnato da cellulite dovuta a questo ristagno. La diagnosi differenziale dev’essere posta con edemi dipendenti da:
- insufficienza cardiaca congestizia;
- insufficienza renale;
- insufficienza epatica.
Anche nelle patologie appena elencate l’edema costituisce un sintomo assai ricorrente; in simili circostanze, il ristagno di liquidi coinvolge entrambi gli arti, quando invece nel linfedema il gonfiore tende a colpire in prevalenza un singolo arto.
Terapia del linfedema
La terapia è basata sulla cura della patologia che ha determinato il linfedema: ad esempio, nel caso venga diagnosticata una linfangite batterica sottostante, occorre intraprendere una terapia antibiotica specifica, in altri casi si opterà per l’approccio chirurgico.
Il trattamento non chirurgico prevede:
- linfodrenaggio manuale;
- bendaggio elastocompressivo;
- pressoterapia;
- utilizzo di tutori elastici definitivi.
ATTENZIONE: la terapia decongestiva non dev’essere eseguita nei pazienti ipertesi, diabetici, affetti da paralisi, insufficienza cardiaca, infezioni acute della pelle, cancro o trombosi.
Come farmaci si usano:
- bioflavonoidi (che aumentano l’attività dei macrofagi);
- benzopironi (esempio la cumarina);
- corticosteroidi (che riescono a ridurre la proliferazione fibroplastica);
- antibiotici (utili soprattutto nella profilassi).
Come trattamento chirurgico si usa:
- microchirurgia derivativa o ricostruttiva;
- liposuzione.
Va tenuto a mente che curare il linfedema non significa guarirlo. Attualmente non esistono cure definitive; questo comporta il fatto che in casi non eccessivamente avanzati, in cui si ha un miglioramento complessivo della parte interessata, il soggetto necessiterà di una terapia di controllo per tutta la durata della sua vita, impedendo così al sintomo di ripresentarsi degenerando pericolosamente.
Terapia linfodrenante casalinga
Vi riportiamo una lista di prodotti per una terapia linfodrenante che potete usare comodamente a casa. Se soffrite di gambe pesanti, gonfiori, cellulite e dolori agli arti inferiori, potrebbero essere un ottimo investimento per la vostra salute e la vostra bellezza:
- Crema gel sollievo immediato per gambe gonfie e pesanti: http://amzn.to/2ARXgv7
- Crema anticellulite con sali del Mar Morto ed alghe: http://amzn.to/2DoULDx
- Apparecchio per pressoterapia sotto i 300 euro: http://amzn.to/2D7sfZk
- Apparecchio per pressoterapia sotto i 500 euro: http://amzn.to/2ASIsMQ
- Libro manuale “Massaggio facile”: http://amzn.to/2D4UIyF
- Terapia ad infrarossi sotto i 90 euro: http://amzn.to/2Fn9QGf
- Olio di Arnica Montana: http://amzn.to/2Fmsdem
- Cerotti dolori muscolari articolari: http://amzn.to/2CZFoUT
- Elettrostimolatore muscolare e nervoso digitale: http://amzn.to/2CYyf6I
- Integratore completo di vitamine e sali minerali: http://amzn.to/2iXrBW4
- Integratore di omega 3: http://amzn.to/2AdJXtx
Leggi anche:
- Differenza tra edema infiammatorio, non infiammatorio, essudato, trasudato, idropisìa e idrope
- Anasarca, edema generalizzato, idropisìa: cause, sintomi e cure
- Edema infiammatorio e vasi sanguigni nell’infiammazione
- Differenza tra pressoterapia e mesoterapia: quale preferire?
- Differenza tra pressoterapia e radiofrequenza: quale preferire?
- La pressoterapia per combattere cellulite e gambe pesanti
- Sistema immunitario, immunità innata e specifica: riassunto, schema e spiegazione
- Immunodeficienza primaria e secondaria: sintomi, cause e terapie
- Linfonodi: cosa sono, come riconoscerli, quando sono pericolosi
- Linfonodo sentinella: cos’è e perché è importante in caso di cancro
- Biopsia del linfonodo sentinella: a che serve, perché è importante
- Differenza tra cisti e linfonodo
- Shock settico e sepsi: sintomi, terapia, conseguenze, si può guarire
- Differenza tra sepsi e Sindrome da risposta infiammatoria sistemica (SIRS)
- Meningite: contagio, sintomi, vaccino, gravità e profilassi
- Endocardite: cause, sintomi, diagnosi e terapie
- Differenza tra batteri Gram negativi e Gram positivi
- Differenza tra batteri bacilli, cocchi, streptococchi e spirilli
- Triade di Virchow: i tre fattori di rischio per la trombosi
- Chetosi: cos’è, da cosa è causata, sintomi e terapia in adulti e bambini
- Coagulazione intravascolare disseminata: cause e trattamenti
- Sepsi: cause, sintomi, diagnosi e terapie
- Differenza tra sepsi e setticemia
- Sindrome da disfunzione multiorgano: cause, sintomi, stadi e cure
- Coprocoltura feci per salmonella: perché e come si fa
- Batteriemia: cura, segni, sintomi, diagnosi ed antibiotici
- I cinque segni cardinali dell’infiammazione
- Differenza tra infezione ed infiammazione: sono la stessa cosa?
- Infiammazione: le alterazioni dei vasi sanguigni, permeabilità vascolare e migrazione leucocitaria
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, segui la nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su YouTube, su LinkedIn, su Reddit, su Tumblr e su Pinterest, grazie!
Tumore al seno: sintomi e dolore al braccio
 Il dolore localizzato al braccio sinistro, in assenza di traumi, è un tipo di dolore che genera molta ansia nelle persone in quanto viene immediatamente associato all’attacco di cuore. In realtà, pur essendo in effetti il dolore al braccio sinistro uno dei sintomi distintivi dell’infarto del miocardio, sono molte le condizioni che possono provocarlo e, nella maggior parte dei casi, certi timori sono fortunatamente infondati. Bisogna considerare, infatti, che un braccio è costituito da varie strutture (muscoli, ossa, tendini ecc.) e, conseguentemente, un problema a una di queste (un’infezione, un processo infiammatorio, un problema muscolare, un disturbo nervoso, un trauma di vario tipo ecc.) può essere, fra le altre cose, causa di dolenzia. Il dolore al braccio, inoltre, può essere determinato da patologie di un’altra parte del corpo apparentemente “insospettabile”: in questo caso si parla di “dolore riferito”.
Il dolore localizzato al braccio sinistro, in assenza di traumi, è un tipo di dolore che genera molta ansia nelle persone in quanto viene immediatamente associato all’attacco di cuore. In realtà, pur essendo in effetti il dolore al braccio sinistro uno dei sintomi distintivi dell’infarto del miocardio, sono molte le condizioni che possono provocarlo e, nella maggior parte dei casi, certi timori sono fortunatamente infondati. Bisogna considerare, infatti, che un braccio è costituito da varie strutture (muscoli, ossa, tendini ecc.) e, conseguentemente, un problema a una di queste (un’infezione, un processo infiammatorio, un problema muscolare, un disturbo nervoso, un trauma di vario tipo ecc.) può essere, fra le altre cose, causa di dolenzia. Il dolore al braccio, inoltre, può essere determinato da patologie di un’altra parte del corpo apparentemente “insospettabile”: in questo caso si parla di “dolore riferito”.
Dolore al braccio sinistro: le cause principali
Come detto, il dolore al braccio sinistro può riconoscere diverse cause e, se in certi casi può essere piuttosto facile capirne i motivi (come nel caso di un trauma diretto), in determinate circostanze può non essere facile identificarli. Le tre cause tipiche sono:
- angina pectoris: una sindrome clinica provocata da un’ischemia miocardica di tipo transitorio (diminuzione temporanea del flusso sanguigno al muscolo cardiaco);
- artrosi cervicale: una degenerazione patologica che interessa le vertebre del collo;
- infarto del miocardio: oltre al dolore al braccio sinistro, si associano alcuni sintomi quali dolore toracico, senso di oppressione, sensazione di pesantezza a livello toracico, sensazione di bruciore al petto, sudori freddi, vomito, respiro affannoso, senso di svenimento, frequenza cardiaca aumentata. In questi casi è opportuno richiedere un intervento medico il più tempestivamente possibile in quanto c’è una forte probabilità di un attacco di cuore.
Altre cause di dolore al braccio sinistro, sono:
- attacco di panico;
- cattiva circolazione;
- contratture muscolari;
- errata postura;
- lesioni del plesso brachiale;
- lesioni e traumi muscolari, tendinei, articolari;
- neuropatia periferica;
- reflusso gastroesofageo;
- sindrome dello stretto toracico superiore;
- vaccinazione recente;
- tendiniti.
Dolore al braccio e mammella
Il dolore al braccio può, in alcuni casi, essere la conseguenza di una recente operazione di mastectomia, che si effettua per trattare diversi tipologie di tumori al seno. In alcuni casi un dolore al braccio può essere irradiato dalla mammella in caso di forte mastodinia, a tal proposito leggi anche: Mastodinia: quando il seno è gonfio e dolorante
Dolore al braccio e cancro al seno
In alcuni casi il dolore localizzato a clavicola, ascella e braccio, spesso associati a gonfiore ed ingrossamento dei linfonodi dell’ascella, possono essere sintomo di tumore al cavo ascellare o al quadrante superiore esterno della mammella. In questo caso si associano spesso altri sintomi, come:
- un ispessimento diverso dagli altri tessuti della mammella,
- una mammella che diventa più grande o più bassa,
- un capezzolo che cambia posizione, morfologia o si ritrae (capezzolo introflesso),
- la presenza di una increspatura della pelle o di fossette, “pelle a buccia d’arancia”,
- un arrossamento cutaneo intorno a un capezzolo,
- una secrezione purulenta e/o ematica dal capezzolo,
- dolore costante in una zona della mammella o dell’ascella,
- un gonfiore sotto l’ascella o intorno alla clavicola.
Tutti i segni e sintomi finora elencati sono ancora più indicativi di cancro mammario, se il paziente presenta i seguenti fattori di rischio:
- sesso femminile (ricordiamo infatti che il cancro mammario può colpire anche l’uomo, ma molto più raramente);
- età avanzata (>30 anni, specialmente superati i 50 anni);
- fumo di sigaretta;
- genetica (altri casi in famiglia: madre, sorella…);
- mancanza di procreazione;
- esposizione ad inquinamento atmosferico;
- mancanza di allattamento al seno;
- elevati livelli di alcuni ormoni;
- dieta ricca di grassi;
- obesità.
Leggi anche:
- Cancro al seno: sintomi precoci, diagnosi, terapia e prevenzione
- Riconoscere il cancro al seno: sintomi precoci e tardivi
- Tumore al seno: sintomi e segni visibili
- Tumore al seno: stadiazione, prognosi e sopravvivenza
- Cancro al seno: metastasi e sintomi avanzati del tumore
- Differenza tra ecografia e mammografia nella diagnosi di tumore al seno
- Noduli al seno: quando preoccuparsi ed andare dal medico?
- Come riconoscere un nodulo maligno del seno da uno benigno?
- Tumore al seno C1 C2 C3 C4 C5: cosa significa il referto?
- Tumore al seno età: a quanti anni si può verificare?
- Classificazione e stadiazione delle fasi del tumore alla mammella
- Capezzolo retratto (introflesso): cause, cancro al seno e trattamenti
- Capezzolo dolorante e sensibile in uomo, donna, gravidanza e menopausa
- Malattia di Paget del capezzolo: sintomi precoci, cause e cure
- Mammella: anatomia e funzioni del seno e delle ghiandole mammarie
- Divisione in quadranti della mammella (Q1 Q2 Q3 Q4)
- Quadranti mammari, tumore al seno, quadrantectomia e mastectomia radicale
- Breast Unit salvavita: -18% di mortalità in caso di cancro al seno
- Capezzolo femminile: forma, dimensioni, funzioni e simmetria
- Areola femminile: forma, dimensioni, funzioni e simmetria
- Differenza tra capezzolo maschile e femminile
- Differenza tra capezzolo ed areola
- Differenza tra seno della donna e seno dell’uomo
- Gli uomini possono avere il tumore al seno?
- Tumore al seno nell’uomo sintomi, dolore, sopravvivenza e guarigione
- A che età inizia a crescere il seno nelle donne?
- A che età smette di crescere il seno nelle adolescenti?
- E’ normale avere un seno asimmetrico? Esistono rimedi?
- E’ normale avere un seno più grande dell’altro? Rimedi?
- La donna con un enorme seno sulla schiena
- Tumore alla mammella: cause, diagnosi e prevenzione
- La visita senologica: come, quando e perchè farla?
- Cosa sono le metastasi? Tutti i tumori danno metastasi?
- Differenza dei capezzoli e del seno in gravidanza
- A cosa serve e come si fa l’autopalpazione del seno?
- Autopalpazione della mammella: come farla nel modo giusto [VIDEO]
- Perché ho il seno piccolo? Quali sono i fattori che influenzano la grandezza del mio seno?
- Biopsia del linfonodo sentinella: a che serve, perché è importante
- La mammografia: un esame rapido che può salvarti la vita
- L’ecografia mammaria: un esame innocuo ed indolore che ti può salvare vita
- Ginecomastia: quando è l’uomo ad avere il seno
- Differenza tra ginecomastia vera, falsa, acquisita, congenita e puberale
- L’uomo può allattare al seno?
- Storia di un seno: dall’embrione alla menopausa
- Cos’è la pubertà, a che età inizia e come si manifesta?
- Il reggiseno provoca il cancro al seno? Finalmente abbiamo una risposta
- Perché agli uomini piace così tanto il seno delle donne?
- Ormoni estrogeni: cosa sono e quali funzioni svolgono?
- Differenza dolore al seno da gravidanza e da ciclo mestruale
- Differenze tra neonati allattati con latte materno ed artificiale
- Quando una mammella non si sviluppa: la Sindrome di Poland
- Politelia: quando i capezzoli sono troppi, cause e terapie
- Rassodare il seno senza chirurgia con la Radiofrequenza Monopolare
- Aumentare il seno senza chirurgia con i cibi ricchi di fitoestrogeni
- Vuoi avere un seno più bello? Comincia con la postura e la ginnastica giusta
- Dimagrire senza perdere seno
- Prendere il sole al seno fa male? Come abbronzarlo in sicurezza
- Grandezza del seno: le donne del nord battono quelle del sud
- La donna con il seno più grande del mondo [VIDEO]
- I deodoranti che contengono alluminio causano il cancro al seno?
- Esercizi e consigli per rassodare e tonificare il seno
- Il reggiseno che può far crescere il tuo seno
- L’incidenza del tumore al seno in crescita tra le quarant’enni: l’importanza della mammografia
- Linfonodo sentinella: cos’è e perché è importante in caso di cancro
- Rossore ed irritazione della pelle sotto e tra il seno: cause e rimedi
- Fitoestrogeni: rimedi naturali in menopausa
- Ingrandire il seno con l’ipnosi
- Filler ad alta densita’: Macrolane™ per l’aumento del seno senza bisturi
- I fitoestrogeni aumentano il rischio di cancro al seno?
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Stadiazione e classificazione TNM: cancro curabile o terminale?
 Quando si scopre un cancro, è fondamentale intervenire rapidamente asportando chirurgicamente quanto più tessuto maligno sia possibile, anche a costo di amputare parti del corpo importanti, demolendo ad esempio parzialmente o totalmente tiroide, fegato, pancreas, polmone, mammella e retto. Diagnosticare e rimuovere un cancro al più presto è importante perché permette di evitare che il tessuto tumorale diventi troppo grande e che le sue cellule arrivino a colonizzare altri organi tramite la diffusione metastatica. I tumori maligni, infatti, non sono formazioni statiche, bensì dinamiche, che cambiano nel tempo.
Quando si scopre un cancro, è fondamentale intervenire rapidamente asportando chirurgicamente quanto più tessuto maligno sia possibile, anche a costo di amputare parti del corpo importanti, demolendo ad esempio parzialmente o totalmente tiroide, fegato, pancreas, polmone, mammella e retto. Diagnosticare e rimuovere un cancro al più presto è importante perché permette di evitare che il tessuto tumorale diventi troppo grande e che le sue cellule arrivino a colonizzare altri organi tramite la diffusione metastatica. I tumori maligni, infatti, non sono formazioni statiche, bensì dinamiche, che cambiano nel tempo.
Il tumore progredisce
Nelle fasi iniziali un cancro è generalmente di dimensioni più ridotte, è più localizzato, non ha ancora colonizzato altri organi; nelle fasi successive esso si ingrandisce e colonizza gli organi vicini: intervenire nelle fasi iniziali o nelle fasi tardive della progressione cancerosa, può letteralmente fare la differenza tra la vita e la morte del paziente. Per questo, quando viene diagnosticato un cancro, diventa per il medico molto importante il capire in quale fase della malattia si trova il tumore maligno. Ciò avviene soprattutto alla diagnostica per immagini: una RX, una TAC, una risonanza magnetica, permettono di capire lo stadio della malattia; leggi anche: Differenze tra risonanza magnetica, TAC, PET, MOC, radiografia, ecografia ed endoscopia
La classificazione TNM
Tutte le indagini volte a capire in quale stadio si trova il tumore, convergono nella “classificazione TNM“, cioè un sistema di classificazione dei tumori internazionale, a partire dal quale si può velocemente intuire “a che punto” della sua progressione si trova la neoplasia. Ogni tumore viene classificato attraverso questa sigla, che ne riassume le caratteristiche principali, contribuendo a determinare la stadiazione, da cui deriveranno, insieme con altri fattori, le scelte terapeutiche (farmaci, chirurgia, terapie palliative) e la prognosi (probabilità di guarigione o morte) associata. A partire dalla conoscenza dei parametri della classificazione TNM, si può ricavare lo stadio in cui si trova il tumore maligno, cioè l’estensione della malattia e quindi la sua gravità.
Leggi anche:
- Differenza tra tumore benigno, maligno, neoplasia, cancro e metastasi
- Differenza tra cancro e carcinoma con esempi
- Cosa sono le metastasi? Tutti i tumori danno metastasi?
I parametri della classificazione TNM
Per qualsiasi tipo di tumore esistono quattro stadi, a cui va aggiunto lo stadio 0 in cui si ha un carcinoma in situ, cioè un tumore non invasivo che non ha infiltrato altri organi ed è quindi di solito facilmente curabile).
I quattro stadi sono indicati con numeri da 1 a 4, in ordine crescente di gravità; tale divisione, a partire dalla classificazione TNM, varia a seconda della sede del tumore primario (ad esempio il T2N0M0 fa parte del secondo stadio nel tumore al seno e del primo nel tumore polmonare), ma in genere le differenze non sono molto significative.
- Il parametro T può essere 1, 2, 3, 4 a seconda della grandezza del tumore (1 piccola, 4 grande). Può inoltre essere “is” ovvero “in situ”. Il T4 in genere è tale non solo per la dimensione, ma anche per l’infiltrazione di organi vitali adiacenti (pericardio, esofago, trachea, ecc.).
- Il parametro N indica lo stato dei linfonodi vicini al tumore, se è 0 sono del tutto indenni, altrimenti può valere 1, 2, 3 con gravità via via crescente. Il coinvolgimento linfonodale è molto importante per capire la gravità del tumore.
- Il parametro M indica la presenza di metastasi a distanza, esso può valere solo 0 (nessuna metastasi) o 1 (presenza di metastasi). La presenza di metastasi è un fattore prognostico molto importante per capire la gravità del tumore.
- Un parametro rappresentato da una “x” (ad esempio, T2N1Mx) indica che non si conosce l’esatta estensione a distanza della malattia per il quale sono necessari ulteriori esami di approfondimento (ad esempio: PET, TAC, RMN, scintigrafia ossea, ecografia, radiografie…).
Leggi anche:
- Che significa malattia terminale?
- Quanto tempo mi rimane da vivere?
- Cure palliative: cosa sono ed a che servono?
Valutazione del grading
In alcune neoplasie (per esempio nei sarcomi dei tessuti molli) nella stadiazione rientra anche la valutazione del grading. Il grado di aggressività del tumore o grado di differenziazione cellulare della neoplasia (grading) è indicato con (G), che va da 1 a 4. (Va tenuto presente che le cellule “sane” sono quelle completamente differenziate ossia quelle che si sono sviluppate fino ad arrivare ad avere le caratteristiche per svolgere perfettamente le funzioni per le quali sono state destinate.
- Il grado 1 (G1, tumore ben differenziato) si riferisce a neoplasie con cellule tumorali che hanno, all’esame microscopico, aspetto lievemente differente rispetto alle cellule normali dello stesso tessuto;
- Il grado 2 (G2, tumore moderatamente differenziato) è quello intermedio.
- Il grado 3 (G3, tumore scarsamente differenziato) si riferisce a cellule tumorali con aspetto altamente difforme da quelle dello stesso tessuto normale;
- Il grado 4 (G4, indifferenziato) si riferisce a cellule che hanno perso totalmente le caratteristiche del tessuto d’origine (anaplasia).
Il grading considera parametri ora citologici, ora istologici, ora entrambi a seconda dell’istogenesi del tumore. Esistono svariati sistemi di grading più o meno complessi, anche se per questioni di riproducibilità e standardizzazione, si sta cercando di adottare sistemi a classi dicotomiche (alto/basso), annullando così classi intermedie che sono fonte di variabilità e soggettività.
Esempio di classificazione
Ecco la classificazione in stadi nel caso del tumore polmonare maligno di tipo non-microcitoma:
| Stadio | TNM |
| Stadio 0 | Tis N0 M0 (tumore in situ) |
| Stadio I | T1-2 N0 M0 |
| Stadio II | T1-2 N1 M0 T3 N0 M0 |
| Stadio III | T1-2 N2-3 M0 T3 N1-3 M0 T4 N0-3 M0 |
| Stadio IV | T1-4 N0-3 M1 (qualunque caso in cui si abbiano metastasi a distanza) |
Stadio della malattia e prognosi
Abbiamo quindi capito quanto la conoscenza dello stadio della malattia sia importante per fornire al paziente delle cure il più possibile appropriate, oltre che per formulare una prognosi. Nello stadio 0 le percentuali di guarigione sono praticamente del 100%; gli stadi I e II sono considerati iniziali e la prognosi è, nella maggioranza dei casi, favorevole (soprattutto se non vi è coinvolgimento linfonodale); Nello stadio III è in genere utile associare alla chirurgia una terapia sistemica “adiuvante”; lo stadio IV viene considerato come malattia avanzata e la prognosi è spesso infausta in quanto guaribile solo in pochi tipi di neoplasia. In presenza di un tumore avanzato, soprattutto se metastatico, la terapia (tranne pochi tipi tumorali) non può avere l’ambizione dei guarire il paziente, ed è quindi palliativa, finalizzata cioè a prolungare la durata della vita, a mantenere o migliorare la qualità della vita, a limitare i sintomi (prevalentemente il dolore) nel paziente. Bisogna però tenere presente che queste sono solo indicazioni generali di massima, e che le cose variano da tumore a tumore. Ad esempio, le percentuali di guarigione di un cancro al testicolo avanzato sono superiori a quelle di un cancro al pancreas in fase iniziale: ogni tumore ha, in virtù di posizione, vascolarizzazione, citologia ed una moltitudine di altri fattori, capacità ed aggressività diverse dagli altri tumori.
Leggi anche:
- Come nasce un cancro? Cosa sono i cancerogeni e come avviene la cancerogenesi?
- Come prevenire i tumori ed il cancro? I 10 cambiamenti consigliati
- Differenza tra adenocarcinoma e carcinoma con esempi
L’importanza della prevenzione e dello screening
Molti tumori maligni non danno sintomi se non nelle fasi terminali e vengono purtroppo scoperti solo quando sono talmente estesi che nessuna cura potrà impedire la morte del paziente, è il caso ad esempio di alcuni tipi di tumore del pancreas che, dopo la diagnosi, determinano spesso la morte in pochi mesi. Per questo motivo è importante prevenire i tumori (con dieta adeguata, attività fisica, eliminazione di fumo di sigaretta…) ma è anche vitale lo screening nei soggetti a rischio. Il termine “screening” indica una strategia di indagini diagnostiche in soggetti che, pur non avendo alcun sintomo, né segno clinico di malattia, hanno un’alta probabilità di averla. Per esempio una donna di 40 anni, con una madre che ha sofferto di cancro al seno, dovrebbe periodicamente effettuare palpazione al seno, unita ad ecografia mammaria e mammografia, anche se non ha alcun sintomo di tumore. In questo modo, un eventuale neoplasia, sarà scoperta nelle sue fasi più precoci, con stadiazione meno grave e – come avete intuito dalla lettura di questo articolo – più facilmente curabile. Ricordate: scoprire al più presto un tumore maligno, equivale ad avere molte più chance di sopravvivenza.
Leggi anche:
- Differenza tra tumore e tessuto normale con esempi di tumori benigni e maligni
- Significato di lesione neoplastica, lesione eteroformativa, eteroplasia e lesione eteroplastica
- Tumore primitivo, lesione eteroplastica primitiva e lesione eteroformativa primitiva: cosa significano?
- L’ecografia mammaria: un esame innocuo ed indolore che ti può salvare vita
- Chemioterapia: durata, in pastiglie, come funziona, fa male, perché farla?
- Radioterapia: cos’è, come si fa, come funziona e durata del trattamento
- Chemioterapia: gli effetti collaterali più e meno comuni
- Radioterapia: rischi, dolore, fastidio ed effetti collaterali
- Radioterapia in gravidanza: può far male al bambino?
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Carcinoma della tiroide: sintomi, prognosi e linee guida
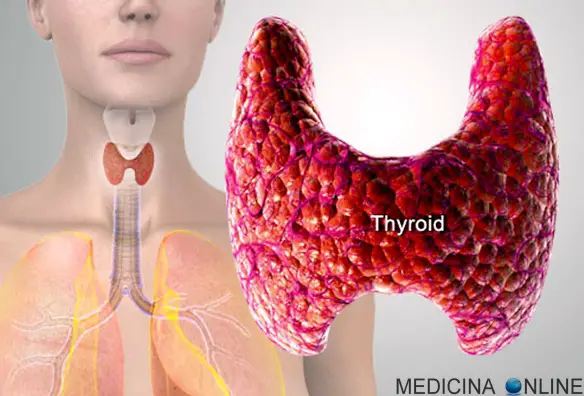 Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
Leggi anche:
- Tiroide: anatomia, funzioni e patologie in sintesi
- Paratiroidi: anatomia e funzioni in sintesi
- Differenza tra tiroide e paratiroide
- Nodulo Tiroideo: sintomi e cure
- Paratiroidectomia: intervento, convalescenza e conseguenze
I tumori della tiroide originano nella maggior parte dei casi dalle cellule follicolari (che compongono il tessuto tiroideo insieme alle cellule parafollicolari o C) e si distinguono in:
- carcinoma papillare (PTC): è la forma più frequente di carcinoma differenziato della tiroide (circa il 75%). Presenta una crescita lenta e può dare luogo a metastasi che interessano i linfonodi del collo. In alcuni pazienti il tumore è multifocale e può interessare entrambi i lobi della tiroide. Secondo il Centro medico dell’Università del Maryland, il carcinoma papillare della tiroide ha una prognosi molto favorevole, con un tasso di sopravvivenza di oltre il 95% dei pazienti ad almeno 10 anni dalla diagnosi (UMM).;
- carcinoma follicolare (FTC): rappresenta circa il 15% dei carcinomi differenziati della tiroide e può dare luogo a metastasi a distanza. Colpisce per lo più persone di età superiore ai 50 anni. – carcinoma anaplastico: è un tipo di tumore raro (<1% dei tumori della tiroide) ma particolarmente aggressivo e di difficile gestione, in quanto dà metastasi a distanza molto precocemente;
- carcinoma midollare (MTC): origina dalle cellule parafollicolari (o cellule C) e si caratterizza per la presenza di elevati livelli circolanti di calcitonina. Tale tumore può avere un andamento familiare e può essere la manifestazione di sindromi genetiche quali la sindrome neoplastica multiple tipo 2 (MEN2).
Quali sono i fattori di rischio per il carcinoma della tiroide?
Un fattore di rischio accertato per il carcinoma differenziato della tiroide è l’esposizione a radiazioni. Il tumore della tiroide è infatti più comune in persone sottoposte a radioterapia sul collo per altre neoplasie o esposte a ricadute di materiale radioattivo come accaduto dopo l’esplosione della centrale nucleare di Cernobyl.
Come si effettua la diagnosi di carcinoma della tiroide?
Il sintomo più comune del tumore della tiroide è il riscontro alla palpazione o all’osservazione di un nodulo tiroideo. Solo il 3-5% di tutti i noduli della tiroide sono però forme tumorali maligne.
In alcuni casi, in presenza di un carcinoma tiroideo possono essere riscontrati in sede laterocervicale masse linfonodali anche di dimensioni e consistenza importanti. Una volta accertata la presenza di noduli tiroidei, generalmente si effettuano ulteriori approfondimenti diagnostici, in particolare:
- valutazione della funzione della ghiandola: si effettua misurando i livelli circolanti di TSH, FT4 ed FT3 come pure gli anticorpi anti Tireoglobulina e anti Tireoperossidasi. Di nessuna utilità è invece il dosaggio della tireoglobulina.
- ecografia tiroidea: è l’esame radiologico di prima scelta. Di semplice esecuzione, consente di valutare sia le dimensioni sia le caratteristiche ecostrutturali dei noduli. Costituiscono segni di sospetto ecografico la presenza di microcalcificazioni, di vascolarizzazione intra-nodulare e l’irregolarità dei margini del nodulo.
- agoaspirato con ago sottile: è indicato in presenza di un nodulo singolo o di un nodulo sospetto nell’ambito di un gozzo multinodulare. Il campione di cellule così raccolto viene sottoposto ad esame citologico consentendo di distinguere, in un buon numero di casi, un nodulo benigno da un nodulo maligno.
- scintigrafia tiroidea: fornisce importanti informazioni sul comportamento funzionale della tiroide e dei noduli tiroidei, in particolare nei casi in cui il nodulo all’esame citologico venga considerato dubbio. E’ un esame molto semplice, basato sulla somministrazione per via endovenosa di un tracciante radioattivo (99mTc-pertecnetato) che viene elettivamente captato dalle cellule tiroidee
- misurazione dei livelli di calcitonina, sostanza che rappresenta il marker specifico del carcinoma midollare della tiroide. In caso di livelli dubbi di calcitonina, può essere indicato un test di stimolo con calcio o con penta gastrina, in regime di Day Hospital.
- test genetici: l’esecuzione può essere indicata nel caso di un carcinoma midollare della tiroide, dal momento che questo tipo di tumore può avere un andamento familiare ed essere parte di sindromi genetiche quali la sindrome neoplastica endocrina tipo 2 (MEN2).
- TAC, RMN e PET/CT: consentono la stadiazione del tumore identificando le possibili sedi di diffusione della malattia.
Quali sono i trattamenti per il carcinoma della tiroide?
Esistono vari tipi di trattamenti, che si possono dividere in chirurgici e non chirurgici.
- Trattamenti chirurgici. In tutti i casi di carcinoma della tiroide, la chirurgia rappresenta la prima opzione terapeutica. Generalmente, in presenza di un tumore della tiroide viene eseguita di routine la tiroidectomia totale. La linfadenectomia del compartimento centrale è sempre eseguita in presenza di una carcinoma midollare, mentre in presenza di un carcinoma differenziato (follicolare o papillare) è eseguita solo se intraoperatoriamente si evidenziano linfonodi sospetti per metastasi o di dimensioni aumentate. Particolare attenzione viene dedicata anche al risultato estetico, grazie all’utilizzo di suture intradermiche con materiale riassorbibile e alla raccomandazione di massaggi postoperatori della ferita con creme dedicate per ridurre l’incidenza di cicatrici ipertrofiche.
- Trattamenti non chirurgici. Dopo l’intervento di tiroidectomia è generalmente indicata l’ablazione del residuo tiroideo mediante iodio-131. Lo scopo della Terapia Radiometabolica con iodio 131 è distruggere il tessuto tiroideo normale che quasi sempre residua anche dopo una tiroidectomia totale ed eliminare eventuali microfocolai neoplastici presenti all’interno dei residui tiroidei o in altre sedi. Un secondo obiettivo di questa terapia è rendere più efficace il follow-up mediante il dosaggio della tireoglobulina sierica e l’eventuale esecuzione della scintigrafia total-body con iodio 131. La terapia radiometabolica può essere eseguita solamente in strutture autorizzate all’impiego terapeutico dello iodio 131 e deve essere eseguita in regime di “ricovero protetto”, in particolari stanze dedicate alla Medicina Nucleare.
- La terapia radiante e la chemioterapia sono infine indicate nel caso di tumori altamente aggressivi e inoperabili o in quelli caratterizzati da de-differenziazione.
Leggi anche:
- Tiroide: dove si trova, com’è fatta e quali funzioni svolge?
- Tiroidectomia: cosa mi succederà prima, durante e dopo l’intervento chirurgico
- Ipoparatiroidismo e ipocalcemia post chirurgici ed autoimmuni: sintomi e cure
- Tiroidectomia: cosa cambierà nella mia vita dopo l’intervento?
- Tiroide e obesità: qual è il vero legame?
Cosa succede dopo la fine delle terapie?
Il follow up è differenziato a seconda del tipo di carcinoma della tirodie che è stato trattato.
Carcinoma differenziato della tiroide: i pazienti, trattati con ormone tiroideo (L-Tiroxina) ad un dosaggio tale da mantenere ridotti livelli di TSH, vengono periodicamente sottoposti ad ecografia del collo e alla determinazione dei livelli circolanti di TSH, FT4, FT3, anticorpi anti tireoglobulina e tireoglobulina (che costituisce un buon marker di malattia nel paziente tiroidectomizzato). In casi selezionati anche può essere indicato valutare la risposta della tireoglobulina dopo stimolo con TSH ricombinante umano o procedere ad una Scintigrafia totale corporea con I131.
Carcinoma midollare della tiroide: dopo l’intervento i pazienti effettuano una terapia con ormone tiroideo (L-Tiroxina) al fine di ovviare all’ipotiroidismo conseguente alla rimozione della tiroide, e vengono periodicamente rivalutati previo dosaggio di TSH, FT4, FT3 e calcitonina.
Prognosi dei carcinomi della tiroide
Circa l’80% dei pazienti con carcinoma della tiroide ben differenziato (DTC) può essere curato definitivamente con un trattamento iniziale ed il 95-97% di questi sono ancora vivi dopo 30 anni di follow-up (De Groot 1990). Nonostante questa buona prognosi, alcuni pazienti presentano un alto rischio di recidiva e di morte; questi pazienti potrebbero essere identificati al momento della diagnosi usando fattori prognostici ben stabiliti che possono essere suddivisi in personali, istopatologici, biologici, molecolari e fattori relativi al trattamento.
- L’età alla diagnosi è uno dei fattori prognostici indipendenti sia per PTC, sia per FTC. L’età avanzata alla diagnosi rappresenta un fattore prognostico negativo sia per recidiva, che per mortalità. Il significato prognostico dell’età persiste quando la percentuale delle morti totali è corretta per la mortalità su una popolazione controllo di uguale sesso, età ed anno di nascita quando sono considerate solo le morti tumore-correlate. Il rischio di recidiva e morte aumenta proporzionalmente con l’età, particolarmente dopo i 40 anni, i 45, i 50 anni o 60 anni; a secondo delle diverse caratteristiche. Sebbene non sia ancora chiaro perché hanno una prognosi peggiore, i più anziani hanno più spesso tumori localmente invasivi alla presentazione, una più alta incidenza di metastasi a distanza alla diagnosi e più frequentemente varianti istologiche aggressive. I tumori della tiroide tendono ad essere presenti meno nei pazienti anziani e allo stesso tempo sono meno differenziati, con una captazione di I-131 sensibilmente inferiore nei pazienti più giovani e, quindi, una minore efficacia della terapia con I-131. Di contro, bambini e adolescenti nonostante frequentemente presentino una patologia estesa localmente alla diagnosi, hanno un’eccellente prognosi a lungo termine.
- Il sesso maschile è un fattore di rischio secondo alcuni autori, ma non per altri. Mentre è di solito un fattore prognostico negativo nelle analisi univariate, perde il suo valore prognostico nelle analisi multivariate. Se il sesso maschile sia veramente un fattore prognostico negativo non è stato ancora risolto.
- Tipi e varianti istologiche. La prognosi del PTC è migliore rispetto al FTC. La prognosi meno favorevole del FTC è strettamente correlata all’età avanzata dei pazienti e all’estensione del tumore al momento della diagnosi, piuttosto che all’istologia. La percentuale di sopravvivenza dei pazienti con PTC ed FTC è simile tra pazienti coetanei e stesso stadio di malattia. Inoltre, nell’ambito di queste due entità istologiche, la prognosi può differire per le loro differenti varianti (Rosai 1992). Nel PTC la variante a cellule alte, la variante a cellule colonnari e la variante ossifila hanno una prognosi peggiore. Viceversa, una buona prognosi si è osservata quando il tumore è ben capsulato e in caso di variante follicolare, sebbene alcune di queste siano più aggressive. Una prognosi intermedia è stata dimostrata con la variante sclerotica diffusa. Mentre il FTC minimamente invasivo mostra una buona prognosi, il FTC largamente invasivo ha una prognosi meno favorevole (Rosai 1992). Un’invasione vascolare avanzata rappresenta un fattore prognostico negativo (Lang 1986), mentre il grado di invasione della capsula ha un limitato valore prognostico (Brennan 1991). Alcune varianti FTC, come il carcinoma a cellule di Huerthle, gli istotipi scarsamenti differenziati e insulare, sono stati frequentemente associati con una prognosi sfavorevole (Akslen 1991; DeGroot 1995; Sakamoto 1983; Tubiana 1985). È interessante notare che il grado di invasione e il grado di differenziazione non sono correlati tra loro, cossichè entrambi i parametri devono essere presi in considerazione da un punto di vista prognostico. Quando accumuli microscopici di cellule indifferenziate sono ritrovate all’interno di un carcinoma tiroideo differenziato, il tumore deve essere considerato e trattato come carcinoma anaplastico.
- Il grado di differenziazione cellulare è di considerevole significato prognostico sia nel carcinoma papillifero, sia nel carcinoma follicolare. Comunque, non esiste un consenso generale nella definizione di ben moderato e scarsamente differenziato, all’interno del gruppo dei carcinomi tiroidei differenziati. Il grado del tumore, in accordo con la classificazione di Broder, che si basa sulle caratteristiche del nucleo del citoplasma e sul numero di figure mitotiche, era un fattore prognostico significativo sia nell’analisi uni variata, sia in quella multivariata per il carcinoma tiroideo papillifero. Il contenuto nucleare di DNA è considerato uno dei migliori indicatori prognostici di malignità in una grande varietà di tumori umani. Nel DTC uno studio riportava che l’aneuploidia del DNA era un fattore avverso nell’analisi uni variata, ma non era un fattore prognostico indipendente nell’analisi multivariata (Joensuu 1986). Nei casi della Mayo Clinic un contenuto anomalo di DNA era associato con una più alta mortalità per tumore, almeno nei tumori papilliferi ad alto rischio (Hay 1990). L’importanza di questo parametro non è ben stabilita per il carcinoma follicolare.
- La dimensione del tumore primitivo può variare da meno di 1 cm di diametro (molto frequente oggi giorno) a notevoli dimensioni. Quando sono unifocali e con linfonodi negativi, i tumori inferiori a 1 cm, i cosiddetti “microcarcinomi” hanno una prognosi eccellente sia in termine di sopravvivenza, sia di sopravvivenza libera da recidiva (Baudin,1998; Hay,1992). C’è un graduale aumento nel rischio di recidiva e mortalità tumore specifica con l’aumento delle dimensioni del tumore primitivo (Akslen,1991; Cady1988 ; DeGroot 1995; Hay 1990; Hay 1987; Mazzaferri 1994; Mazzaferri,1998). La dimensione del tumore è un significativo fattore di rischio nelle analisi multivariate. Sembra essere più predittivo nei tumori papilliferi che nei tumori follicolari, nei quali il grado di differenziazione e la diffusione dell’invasione prevalgono sulla dimensione del tumore (Brennan 1991; Emerick 1993; Lang 1986; Rosai 1992; Sakamoto 1983; Shaha 1995; Tubiana 1985).
- Il carcinoma tiroideo papillifero è multifocale in circa il 50% dei casi (dal 20 all’80%) relativamente al numero di sezioni patologiche analizzate (DeGroot 1990; Hay 1990; Mazzaferri 1994; Mortensen 1955). Anche se esistono divergenze di opinioni in merito, il FTC è di solito unifocale. I PTC multifocali sono più frequentemente accompagnati da metastasi linfonodali (Baudin 1998; Katoh 1992) e presentano più frequentemente un’evidenza di malattia locale persistente, recidive regionali e metastasi a distanza. Dati controversi sono stati riportati relativamente alla relazione tra multifocalità e mortalità. A questo riguardo è utile notare che la mutifocalità in un lobo è associata con una più alta probabilità di interessamento dell’altro lobo. Ciò almeno in parte spiega perchè le recidive e le morti tumore-correlate sono meno frequenti con la tiroidectomia totale che con le procedure chirurgiche meno radicali (Baudin 1998) .
- L’estensione del tumore oltre la capsula tiroidea è un fattore predittore indipendente di una prognosi peggiore sia in PTC che in FTC. È stato osservato nel 5-10% di PTC e nel 3-5% di FTC, ed è associato con una più alta percentuale di recidive locali, metastasi a distanza e morte tumore correlata (deGroot 1990; Hay 1990; Hay 1993; Mazzaferri 1994; Simpson 1987; Yamashita 1997). Comunque, dovrebbe essere fatta una distinzione tra invasione microscopica della capsula tiroidea e invasione macroscopica con coinvolgimento di altri organi del collo. In quest’ultimo caso la prognosi è peggiore, specialmente a causa della difficoltà di arginare la malattia locale (Hu A et al,2007).
- Le metastasi linfonodali sono frequenti nei PTC (30%-60%), ma non così frequenti negli FTC (15%-20%) (Grebe 1996). Sono molto più comuni nei bambini, verificandosi in oltre l’80% con PTC. I linfonodi locali possono essere coinvolti anche nel caso di microcarcinoma papillifero (Baudin 1998). Molti autori hanno dimostrato che le metastasi ai linfonodi regionali sono associate ad una più alta percentuale di recidiva di tumore e mortalità tumore specifica (Akslen 1991; DeGroot 1990; Mazzaferri 1994; Tubiana 1985), mentre altri non hanno trovato significative differenze nella sopravvivenza (Hay 1990; Hay 1993). Il coinvolgimento linfonodale è associato ad un outcome significativamente peggiore anche in assenza di invasione extra tiroidea. Nella casistica dell’Ohio State University, le metastasi ai linfonodi cervicali bilaterali e mediastinici erano un fattore prognostico indipendente predittivo di recidiva tumorale e mortalità cancro correlata (Mazzaferri 1994). All’istituto Gustave-Roussy le metastasi linfonodali palpabili rappresentavano un fattore di rischio indipendente per morte tumore correlata (Tubiana 1985). E’ stata dimostrata una mortalità del 3.6% nei pazienti con metastasi linfonodali, tale indice è estremamente alto per una patologia che è ritenuta avere una prognosi eccellente (Pacini 1994). Oltre che la presenza o assenza di metastasi linfonodali, il sito, la dimensione, il numero e l’estensione del tumore oltre la capsula tiroidea (Yamashita 1997) hanno probabilmente un impatto sulla prognosi, sebbene non siano stati presi in considerazione ampie casistiche.
- Le metastasi a distanza al momento della diagnosi rappresentano il fattore prognostico peggiore nei pazienti sia con carcinoma tiroideo papillifero sia follicolare. La mortalità tumore specifica nei pazienti con metastasi a distanza varia dal 36% al 47% a cinque anni; dipende dalla durata del follow-up e aumenta fino al 70% a 15 anni (Hoie 1988; Pacini 1994; Schlumberger 1996). L’analisi univariata ha dimostrato che nel caso di metastasi a distanza, l’età più giovane, il tipo istologico ben differenziato, la localizzazione nel polmone piuttosto che nell’osso, la presenza di piccole lesioni e la captazione di I-131 sono fattori associati ad una prognosi migliore. L’ analisi multivariata ha, comunque, dimostrato che la malattia metastatica estesa ha un impatto prognostico peggiore della localizzazione anatomica (polmone o osso). Il migliore outcome è presente nei pazienti più giovani con metastasi micronodulari responsive alla radio-iodioterapia non visibili alla radiografia standard.
- Un peggiore outcome è associato alla perdita di differenziazione dei geni di espressione tiroide specifici, quali il recettore per il TSH, il trasportatore Na+/I-, la tireoglobulina (Tg) e i geni tireoperossidasi, come dimostrato dalla ridotta espressione di questi geni nei tumori scarsamente differenziati e dalla loro assenza nei tumori indifferenziati (Arturi 1998; Elisei 1994). Tra gli oncogeni coinvolti con la patogenesi del PTC, solamente BRAFV600E è stato dimostrato avere un impatto negativo sull’outcome (Xing 2007; Elisei 2008), mentre ciò non si è dimostrato per i riarrangiamenti RET/PTC (Basolo 2001; Adeniran 2006). Mutazioni somatiche dell’oncosoppressore p53 o la sovraespressione della sua proteina codificata portano a una prognosi peggiore nell’ambito del ATC che è di per sè un tumore ad elevata mortalità (Pollina 1996). Similmente, la sovraespressione della proteina p21, che è codificata dall’oncogene RAS è stata associata a forme di carcinoma tiroideo più aggressive (Romano 1993). I risultati sopra riportati sono solamente l’inizio di un nuovo approccio alla biologia del tumore ed indicano che i prodotti degli oncogeni e degli oncosoppressori possono rivelare la prognosi dei tumori della tiroide.
Leggi anche:
- Eutirox: quando si usa, dosaggio ed effetti collaterali (foglio illustrativo)
- Differenza tra Eutirox e Ibsa nella cura dell’ipotiroidismo
- Ecografia della tiroide: a cosa serve, come si svolge e come ci si prepara all’esame
- Tiroidectomia totale: complicanze, postoperatorio e aumento di peso
- Non mangio eppure ingrasso, e se fosse ipotiroidismo?
- Ipotiroidismo: sintomi, diagnosi, cura farmacologica e consigli dietetici
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Differenza tra tumore e tessuto normale con esempi di tumori benigni e maligni
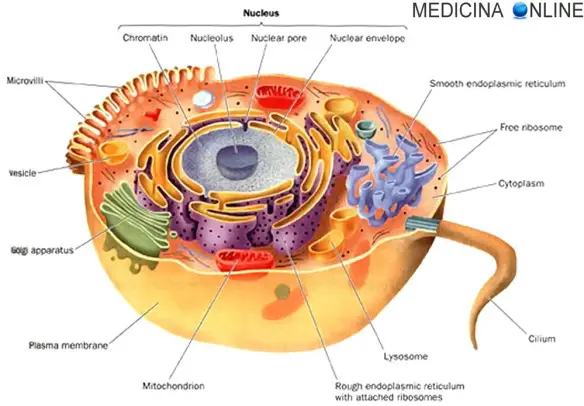 Tessuto normale
Tessuto normale
Nei tessuti sani sono presenti cellule, come quella che vedete raffigurata nel disegno in alto, che si replicano in modo organizzato, secondo un preciso schema di stimoli che portano alla mitosi, cioè il processo grazie al quale da una singola cellula si formano due cellule figlie. Tali stimoli sono attentamente regolati dall’organismo, in modo da evitare che i tessuti possano letteralmente espandersi all’infinito. Le cellule possono certamente aumentare di numero (iperplasia) o in dimensione (ipertrofia), ma sempre in un modo “deciso” dall’organismo e seguendo precise regole che ne evitino una proliferazione incontrollata. Per approfondire, leggi anche:
- Riproduzione cellulare e ciclo cellulare
- Mitosi: spiegazione delle quattro fasi
- Meiosi: spiegazione di tutte tappe
- Differenza tra ipertrofia ed iperplasia con esempi
Tumore
In caso di “tumore” (dal latino tumor, “rigonfiamento”) siamo invece di fronte ad una cellula danneggiata nelle sue “istruzioni genetiche” che inizia a replicarsi in modo incontrollato e che persiste in questo stato di anche dopo la cessazione degli stimoli che hanno indotto inizialmente la replicazione. La cellula danneggiata dà origine ad una enorme quantità di cellule figlie che a loro volta si replicheranno in modo incontrollato. Il risultato sarà una massa di tessuto anormale che cresce in modo scoordinato ed indeterminato che prende il nome di “tumore” (o di “neoplasia“, i due termini sono sinonimi). Il tumore può essere “benigno” e permanere nel sito dove ha originato, sotto forma di tumore primario, oppure può essere “maligno” ed avere quindi la capacità di colonizzare altri organi e tessuti (metastasi). Il tumore maligno è denominato anche “cancro“.
Leggi anche: Cosa sono le metastasi? Tutti i tumori danno metastasi?
Esempi di tumori benigni
Esempi di tumori benigni sono (tra parentesi il tessuto da cui originano):
- angioma o emangioma (vasi sanguigni);
- fibroma (tessuto connettivo);
- papilloma (epitelio di rivestimento);
- adenoma (epitelio ghiandolare);
- lipoma (tessuto adiposo);
- condroma (cartilagine);
- leiomioma (tessuto muscolare liscio);
- rabdomioma (muscolo striato);
- meningioma (meningi);
- neurocitoma (neuroni);
- glioma (glia, cellule non neuronali del sistema nervoso).
Esempi di tumori maligni (cancro)
Esempi di tumori maligni sono (tra parentesi il tessuto da cui originano):
- angiosarcoma (vasi sanguigni);
- fibrosarcoma (tessuto connettivo);
- carcinoma (epitelio di rivestimento);
- adenocarcinoma (epitelio ghiandolare);
- liposarcoma (tessuto adiposo);
- condrosarcoma (cartilagine);
- leiomiosarcoma (tessuto muscolare liscio);
- rabdomiosarcoma (muscolo striato);
- meningioma maligno (meningi);
- neuroblastoma (neuroni);
- melanoma (melanociti presenti nella pelle);
- glioblastoma (glia, cellule non neuronali del sistema nervoso);
- Linfoma Mieloma (linea ematopoietica linfoide);
- Leucemia mieloide (linea ematopoietica mieloide);
- seminoma (cellule germinali del testicolo).
Organi frequentemente colpiti da tumori maligni, sono la mammella, i polmoni, il pancreas, il colon e la prostata.
Leggi anche:
- Differenza tra tumore benigno, maligno, neoplasia, cancro e metastasi
- Significato di lesione neoplastica, lesione eteroformativa, eteroplasia e lesione eteroplastica
- Tumore primitivo, lesione eteroplastica primitiva e lesione eteroformativa primitiva: cosa significano?
- Stadiazione e classificazione TNM: cancro curabile o terminale?
- Differenza tra adenocarcinoma e carcinoma con esempi
- Differenza tra cancro e carcinoma con esempi
- Stomie: cosa sono, a che servono, quanti tipi esistono?
- Differenza tra ipertrofia muscolare sarcolplasmatica e miofibrillare
- Chemioterapia: durata, in pastiglie, come funziona, fa male, perché farla?
- Radioterapia: cos’è, come si fa, come funziona e durata del trattamento
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Sistema linfatico e linfonodi: anatomia e funzioni in sintesi
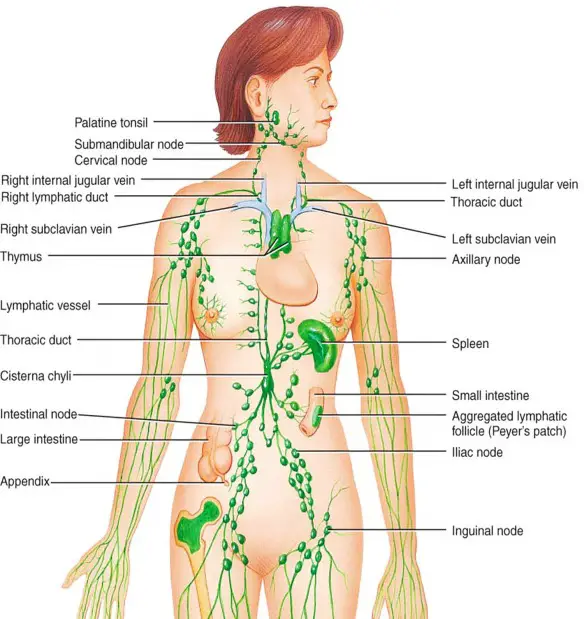 Il sistema linfatico è un complesso sistema di drenaggio a una via che trasporta i fluidi dallo spazio interstiziale dei tessuti al torrente circolatorio presente in tutti i mammiferi. La sua principale funzione è il trasporto di proteine, liquidi e lipidi (specialmente per i vasi drenanti l’intestino) dall’interstizio al sistema circolatorio sanguigno, ma presenta anche ruoli di filtraggio e nella risposta immunitaria favorendo l’arrivo di antigeni agli organi linfoidi periferici per innescare i meccanismi immunitari. Non tutti gli organi sono drenati dal sistema linfatico. Il sistema nervoso centrale, ossa, midollo osseo, parte materna della placenta ed endomisio dei muscoli mancano di vasi linfatici, anche se sono provvisti di condotti prelinfatici in grado di drenare il liquido interstiziale ai linfonodi zonali. Cristallino, cornea, epidermide, cartilagine e tonaca intima delle arterie di grosso calibro mancano oltre che della vascolarizzazione linfatica anche di quella sanguigna.
Il sistema linfatico è un complesso sistema di drenaggio a una via che trasporta i fluidi dallo spazio interstiziale dei tessuti al torrente circolatorio presente in tutti i mammiferi. La sua principale funzione è il trasporto di proteine, liquidi e lipidi (specialmente per i vasi drenanti l’intestino) dall’interstizio al sistema circolatorio sanguigno, ma presenta anche ruoli di filtraggio e nella risposta immunitaria favorendo l’arrivo di antigeni agli organi linfoidi periferici per innescare i meccanismi immunitari. Non tutti gli organi sono drenati dal sistema linfatico. Il sistema nervoso centrale, ossa, midollo osseo, parte materna della placenta ed endomisio dei muscoli mancano di vasi linfatici, anche se sono provvisti di condotti prelinfatici in grado di drenare il liquido interstiziale ai linfonodi zonali. Cristallino, cornea, epidermide, cartilagine e tonaca intima delle arterie di grosso calibro mancano oltre che della vascolarizzazione linfatica anche di quella sanguigna.
Struttura del sistema linfatico
Il sistema linfatico è formato da una fitta rete di piccoli canali periferici, i capillari linfatici che, dopo aver raccolto la linfa dagli spazi intercellulari, la drenano in vasi di diametro maggiore, i collettori linfatici. I collettori, analogamente a quanto accade per le vene, confluiscono in vasi di calibro crescente per terminare in due grossi tronchi: il dotto linfatico destro, che raccoglie la linfa della porzione sopra-diaframmatica destra del corpo ed è tributario della vena succlavia destra, e il dotto toracico, cui giunge tutta la linfa delle regioni sotto-diaframmatiche più quella della parte sopra-diaframmatica sinistra, tributario della vena succlavia sinistra. Per il tramite delle succlavie, afferenti alla vena cava superiore, la circolazione linfatica termina immettendosi in quella ematica.
Leggi anche:
- Sistema immunitario, immunità innata e specifica: riassunto, schema e spiegazione
- Immunodeficienza primaria e secondaria: sintomi, cause e terapie
- Immunità innata (aspecifica): barriere, infiammazione e complemento
- Immunità innata (aspecifica): neutrofili, macrofagi e linfociti natural killer
- Immunità specifica (acquisita): linfociti, T killer, T helper, T γδ, B ed anticorpi
- Immunità specifica (acquisita): memoria passiva, attiva ed immunizzazione
- Immunità specifica (acquisita) umorale e cellulare
Linfonodi
Il percorso dei collettori linfatici è interrotto dai linfonodi, strutture specifiche formate da tessuto linfoide aggregato in noduli, che possono essere unici o più spesso raggruppati in vere e proprie stazioni linfonodali o linfocentri. La sequenza di collettori e linfonodi costituisce le catene linfatiche che decorrono affiancate ai vasi sanguigni, cosa che peraltro ne agevola l’identificazione nel corso degli interventi chirurgici, da cui prendono il nome: catena linfatica dell’arteria gastrica, catena linfatica para-aortica, catena linfatica dell’arteria mammaria interna, catena linfatica dell’arteria mesenterica inferiore. I linfonodi, in quanto centri nodali della rete linfatica, rappresentano il punto d’arrivo dei collettori pre-nodali, provenienti anche da zone diverse, e di partenza dei collettori post-nodali, in numero minore rispetto a quelli afferenti, rivolti in varie direzioni. Ciò determina la caratteristica del sistema linfatico per cui un distretto anatomico o un determinato organo, avvolto in una fitta ragnatela di capillari, può drenare verso una o più catene linfatiche e ogni stazione linfonodale, a sua volta, può ricevere linfa anche da più organi o distretti anatomici.
Leggi anche:
- Linfonodi: cosa sono, come riconoscerli, quando sono pericolosi
- Linfonodo sentinella: cos’è e perché è importante in caso di cancro
- Biopsia del linfonodo sentinella: a che serve, perché è importante
- Differenza tra cisti e linfonodo
Funzioni dei linfonodi
La funzione primarie dei linfonodi è quella di filtrare la linfa proveniente dai tessuti per permettere la ricircolazione delle cellule dendritiche che hanno catturato l’antigene e degli antigeni stessi al loro interno. Linfociti, cellule dendritiche e antigeni una volta all’interno del linfonodo vengono indirizzati in specifici luoghi dove danno vita alla risposta immunitaria.
- Ricircolazione dei linfociti. I linfociti si concentrano nei linfonodi perché attratti da una particolare specie di molecole, le chemochine. Le chemochine sono un particolare tipo di citochine atte ad attirare le cellule responsabili della risposta immunitaria nei giusti settori degli organi linfoidi per il loro sviluppo e attivazione. In particolare i linfociti T esprimono un recettore, il CCR7, capace di legare le chemochine CCL19 e CCL21 che vengono prodotte solo nelle aree T dei linfonodi consentendo solo a quel tipo di linfociti di arrivare in tali zone. Allo stesso modo il recettore CXCR5 dei linfociti B lega CXCL13, una chemochina prodotta solo dalle cellule dendritiche follicolari. La produzione di CXCL13 è attivata da un’altra citochina, che però non è una chemochina, la linfotossina.
- Trasporto dell’antigene. Come descritto nel paragrafo precedente, la struttura del seno sottocapsulare, entro cui si riversa la linfa proveniente dai vasi afferenti, non consente il libero passaggio di molecole solubili, ma permette alle cellule di entrare in contatto o migrare nella regione sottostante. I virus e gli antigeni ad alto peso molecolare vengono fagocitati dai macrofagi presenti nel seno e presentati ai linfociti B della regione corticale. Gli antigeni a basso peso molecolare, invece, si impegnano nei condotti FRC per essere poi catturati dalle cellule dendritiche presenti nei condotti stessi. Gli antigeni fagocitati dalle cellule dendritiche direttamente nei tessuti raggiungono i linfonodi grazie all’espressione di un recettore per le chemochine, CCR7, che è specifico per le chemochine CCL19 e CCL21 prodotte nelle aree T dei linfonodi stessi.
Drenaggio linfatico della mammella
Un organo che si presta bene alla esemplificazione di questo concetto è la mammella che può drenare, oltre che verso il diaframma e la parete toracica, in particolare nei:
- linfonodi posti medialmente alla ghiandola e che formano la catena dell’arteria mammaria interna, tributaria del linfocentro sopraclavicolare;
- linfonodi della mammella contro-laterale;
- linfonodi della catena linfatica ascellare che partendo dalla ghiandola si porta in alto verso il cavo omonimo. I linfonodi di questo linfocentro sono in media una trentina e sono distribuiti in sottogruppi variamente classificati. Un criterio è quello di identificarli in base alla loro posizione rispetto al muscolo piccolo pettorale (M.P.P.):
- linfonodi dell’ascella inferiore o di I livello, posti lateralmente al bordo esterno del M.P.P;
- linfonodi dell’ascella media o di II livello, posti tra il bordo mediale e quello laterale del M.P.P;
- linfonodi dell’apice dell’ascella o di III livello, posti medialmente al margine interno del muscolo.
Numerose ricerche riguardanti la dinamica del drenaggio linfatico della mammella hanno dimostrato che la quasi totalità della linfa proveniente dalla ghiandola segue la via ascellare, mentre una parte minima intorno all’1-3% segue la via mammaria interna.
Leggi anche:
- Linfodrenaggio manuale con metodo Vodder e Leduc: controindicazioni e tecniche
- Differenza tra pressoterapia e cavitazione: quale preferire?
- Differenza tra pressoterapia e mesoterapia: quale preferire?
- Differenza tra pressoterapia e radiofrequenza: quale preferire?
- Shock settico e sepsi: sintomi, terapia, conseguenze, si può guarire
- Differenza tra sepsi e Sindrome da risposta infiammatoria sistemica (SIRS)
- Meningite: contagio, sintomi, vaccino, gravità e profilassi
- Endocardite: cause, sintomi, diagnosi e terapie
- Differenza tra batteri Gram negativi e Gram positivi
- Differenza tra batteri bacilli, cocchi, streptococchi e spirilli
- Triade di Virchow: i tre fattori di rischio per la trombosi
- Chetosi: cos’è, da cosa è causata, sintomi e terapia in adulti e bambini
- Coagulazione intravascolare disseminata: cause e trattamenti
- Sepsi: cause, sintomi, diagnosi e terapie
- Differenza tra sepsi e setticemia
- Sindrome da disfunzione multiorgano: cause, sintomi, stadi e cure
- Coprocoltura feci per salmonella: perché e come si fa
- Batteriemia: cura, segni, sintomi, diagnosi ed antibiotici
- I cinque segni cardinali dell’infiammazione
- Differenza tra infezione ed infiammazione: sono la stessa cosa?
- Infiammazione: le alterazioni dei vasi sanguigni, permeabilità vascolare e migrazione leucocitaria
- Differenza tra infezione acuta e cronica
- Morte cellulare: differenza tra necrosi, apoptosi ed autofagia
- Infestazione: cos’è, da cosa è causata, come si cura
- Differenza tra infezione ed infestazione
- Differenza tra infestazione interna ed esterna
- Differenza tra infiammazione cronica granulomatosa e non granulomatosa
- Differenza tra granulomi asettici (da corpo estraneo) e settici
- Differenza tra cisti, pseudocisti, ascesso ed empiema
- Differenza infiammabile, combustibile, comburente e facilmente infiammabile
- Differenza tra virus e batteri: chi è più pericoloso? Diagnosi, sintomi e terapia
- Differenza tra acidosi ed alcalosi, metabolica e respiratoria
- Peritonite: tipi, cause, sintomi, diagnosi e terapie
- Appendicite acuta e cronica: cause, sintomi e terapie
- Differenza tra empiema ed ascesso
- Virus e virioni: cosa sono, come sono fatti, come funzionano e come si riproducono
- HIV: dopo quanto si manifestano i sintomi? I 4 stadi dell’infezione
- HIV: sintomi iniziali in donne e uomini
- Differenza tra HIV e AIDS: sono uguali?
- Si muore di AIDS? Qual è l’aspettativa di vita?
- Differenza tra aterosclerosi e arteriosclerosi
- Differenza tra trombo, embolo, coagulo, embolia e trombosi
- Differenza tra arterie, vene, capillari, arteriole e venule
- Differenza tra arteriola afferente ed efferente: struttura e funzioni
- Differenza tra edema infiammatorio, non infiammatorio, essudato, trasudato, idropisìa e idrope
- Cos’è l’Idropisìa?
- Idrope: cause, tipi e terapia
- Cos’è l’edema, come e perché si forma?
- Differenza tra edema localizzato, generalizzato e sistemico
- Differenza tra insufficienza renale acuta, cronica e dialisi
- Crisi respiratoria acuta e rischio di morte: cosa fare?
- Apparato respiratorio: anatomia in sintesi, struttura e funzioni
- Asma bronchiale: spirometria e diagnosi differenzialeAsma bronchiale: spirometria e diagnosi differenziale
- Esofago e trachea: zona, anatomia, rapporti e differenze
- Spirometria diretta ed indiretta: come si esegue ed a cosa serve
- Differenza tra BPCO ed asma: terapia e sintomi comuni e diversi
- Broncopneumopatia cronica ostruttiva (BPCO): sintomi, diagnosi e cura
- Asma bronchiale in bambini e adulti: cause, sintomi e cura
- Differenza tra inspirazione e espirazione: l’atto respiratorio
- Tumore al polmone in chi non fuma: da cosa viene causato?
- Differenza tra ventilazione polmonare e alveolare: spazio morto anatomico e fisiologico
- Broncoscopia polmonare con biopsia: a cosa serve, fa male, è pericolosa?
- Tutti gli articoli sullo smettere di fumare
- Enfisema polmonare: sintomi, tipi, cause, diagnosi e terapia
- Alveoli polmonari: cosa sono e che funzioni svolgono?
- Enfisema polmonare: cure, complicazioni, quando chiamare il medico
- Spirometria diretta ed indiretta: come si esegue ed a cosa serve
- Che significa malattia autoimmune? Spiegazione ed esempi
- Parametri della spirometria: capacità, volumi, rapporti e flussi
- Polmoni: anatomia e funzioni in sintesi
- Differenza tra laringe, faringe e trachea
- Pneumotorace spontaneo primario, secondario ed iperteso: cause, sintomi, terapie
- Sangue dal naso (epistassi) in bambini e adulti: cause, rimedi naturali, cosa fare e cosa NON fare
- Differenza tra dispnea, apnea e tachipnea
- Differenza apnea statica, dinamica e profonda
- Differenza tra ipossiemia, ipossia ed anossia
- Differenza tra ipossiemia e ipercapnia
- Differenza tra insufficienza respiratoria di tipo 1 e 2
- Differenza tra costola incrinata e rotta
- Cos’è una costa? Differenza tra costole e coste
- Gabbia toracica: dove si trova, a che serve e da cosa è composta
- Costola rotta (frattura costale): sintomi, diagnosi e terapia
- Costola incrinata: sintomi, terapia e tempi di recupero
- Differenza tra costole e vertebre
- Muscoli respiratori volontari ed involontari
- Frattura costale multipla, volet costale e pneumotorace
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su YouTube, su LinkedIn e su Pinterest, grazie!
