 La sindrome da inappropriata secrezione di ADH (o SIADH) è una patologia caratterizzata da un’elevazione patologica della secrezione dell’ormone antidiuretico Continua a leggere
La sindrome da inappropriata secrezione di ADH (o SIADH) è una patologia caratterizzata da un’elevazione patologica della secrezione dell’ormone antidiuretico Continua a leggere
Archivi tag: ormone antidiuretico
Vasopressina (ormone antidiuretico o ADH): funzioni e patologie
 La vasopressina (o ADH, acronimo dall’inglese antidiuretic hormone) è un peptide di nove aminoacidi con funzioni di ormone, neurotrasmettitore e modulatore della trasmissione nervosa. È nota anche come ormone antidiuretico, adiuretina o arginina-vasopressina (AVP). La maggior parte della vasopressina viene sintetizzata dai nuclei sopraottico e paraventricolare dell’ipotalamo, una importante struttura del sistema nervoso centrale.
La vasopressina (o ADH, acronimo dall’inglese antidiuretic hormone) è un peptide di nove aminoacidi con funzioni di ormone, neurotrasmettitore e modulatore della trasmissione nervosa. È nota anche come ormone antidiuretico, adiuretina o arginina-vasopressina (AVP). La maggior parte della vasopressina viene sintetizzata dai nuclei sopraottico e paraventricolare dell’ipotalamo, una importante struttura del sistema nervoso centrale.
Leggi anche: Ipotalamo: anatomia, struttura e funzioni
Quando viene secreta la vasopressina?
La vasopressina viene secreta nelle seguenti condizioni:
- Disidratazione dell’organismo: è lo stimolo più efficace nell’indurre la secrezione dell’ormone. La vasopressina determina il recupero di fluidi attraverso la formazione di urine più concentrate in modo da conservare i liquidi contenuti nel corpo e mantenere stabile la volemia (il volume di sangue circolante). Determina anche un aumento della pressione arteriosa in quanto ha anche attività di vasocostrittore. Una sostanza simile denominata lisin-vasopressina è stata trovata nei maiali dove svolge funzioni analoghe. Nell’ipotalamo i neuroni che formano i nuclei sopraottico e paraventricolare che sintetizzano la vasopressina sono osmocettori che in seguito all’aumento dell’osmolarità del plasma (soprattutto se determinata da una aumentata concentrazione di sodio) inducono la secrezione di vasopressina a livello dell’ipofisi posteriore (neuroipofisi). Questi neuroni ricevono anche afferenze da altri osmocettori localizzati in regioni (organo vascolare della lamina terminale e organo subfornicale) localizzate in prossimità della parete anteriore del terzo ventricolo. La secrezione, assente a livelli di osmolarità plasmatica intorno ai 280 mosm/kg, è già spiccata a 290 mosm/kg ossia a livelli di poco superiori. Gli osmocettori, oltre a regolare il rilascio di vasopressina, controllano anche lo stimolo della sete. La vasopressina non è l’unico ormone che regola i fenomeni di concentrazione e diluizione delle urine: altri ormoni coinvolti sono l’aldosterone e i peptidi natriuretici come il peptide natriuretico atriale.
- Contrazione del volume plasmatico: è un meccanismo meno sensibile rispetto alla risposta in seguito ad aumenti dell’osmolarità plasmatica. La vasopressina viene prodotta in seguito a stimolazione dei barocettori presenti nelle carotidi e nelle altre arterie e dei volocettori a livello dell’atrio destro. Le emorragie massive, determinando una diminuzione della volemia, inducono la liberazione di vasopressina attraverso questi meccanismi.
- Aumenti della concentrazione plasmatica di colecistochinina attraverso modalità non ancora chiarite.
- L’alcool etilico riduce la secrezione di vasopressina, il che determina riduzione del riassorbimento di acqua dal filtrato glomerulare ed aumenta la diuresi: in parole povere, quindo si bevono alcolici, si ha maggiore stimolo ad urinare.
- L’angiotensina II può stimolare la secrezione di vasopressina.
Leggi anche: Idratazione corretta: quanta acqua bere al giorno e perché è così importante
Funzioni della vasopressina a livello renale
L’ormone agisce a livello del dotto collettore (zona iperosmotica) dove promuove l’inserimento, a livello della membrana apicale delle cellule epiteliali tubulari, di proteine chiamate acquaporine (aquaporina-2s), che aumentano il riassorbimento dell’acqua. Vengono così escrete urine ridotte in volume e concentrate fino a 1200 mMol/l(antidiuresi). Viceversa per una diminuzione di osmolarità del plasma si avranno urine diluite (150 mMol/l). La vasopressina lega recettori specifici denominati V2 (accoppiati a proteine G stimolatorie) situati sulla membrana basolaterale delle cellule del tubulo contorto distale. Le proteine G stimolatorie attivano l’enzima adenilato ciclasi con formazione di cAMP e pirofosfato a partire da ATP. Il cAMP attiva una cascata di segnali che termina con l’inserzione nella membrana plasmatica apicale delle acquaporine le quali normalmente si trovano inserite nella membrana di vescicole di deposito. L’inserimento delle proteine nella membrana plasmatica avviene tramite un processo di esocitosi delle vescicole. In caso di diminuzione della vasopressina le acquaporine saranno nuovamente internalizzate nella cellula tramite endocitosi. Il processo tramite cui porzioni di membrana vengono inserite o tolte dalla membrana plasmatica è noto come “riciclaggio di membrana”. La proteina repressore che regola l’espressione del gene che codifica per la protein chinasi A (PKA) ha un sito di legame per il cAMP. In seguito al legame, la proteina si distacca dal promoter del gene determinando una maggior sintesi di PKA. La protein chinasi A fosforila altri enzimi che in cascata arrivano alla liberazione di glucosio a partire dal glicogeno alla base dei processi che producono energia all’interno della cellula. L’energia viene anche utilizzata per fondere la membrana delle vescicole nella quale sono inserite le acquaporine con la membrana della cellula epiteliale tubulare. In questo processo sono probabilmente coinvolti ioni calcio e quindi la fosfolipasi C(PLC). La PLC può essere attivata da recettori associati a proteine G. La vasopressina inoltre aumenta la permeabilità all’urea della porzione papillare dei dotti collettori, determinando un aumentato riassorbimento di urea nell’interstizio della midollare renale, in seguito al gradiente di concentrazione creato dalla rimozione di acqua nella porzione corticale dei dotti collettori. L’urea, a livello degli osmocettori ipotalamici, diffondendo liberamente attraverso le membrane, non costituisce uno stimolo per l’inibizione del rilascio di vasopressina. Un’altra funzione della vasopressina nel rene è quella di stimolare il riassorbimento di Sodio a livello della porzione ascendente dell’ansa di Henle.
Leggi anche: Mi alzo spesso di notte per urinare: quali sono le cause e le cure?
Funzioni della vasopressina a livello cardiovascolare
La vasopressina, aumentando le resistenze periferiche, determina un innalzamento della pressione arteriosa. Questo tipo di regolazione è blanda nell’individuo sano; acquista maggiore importanza nei casi di shock ipovolemico dovuto, ad esempio, ad emorragie dove la vasopressina secreta si rivela un efficiente meccanismo di compensazione.
Leggi anche:
- Shock ipovolemico emorragico: cause, sintomi, rischi, diagnosi, terapie, prognosi, morte
- Emorragia interna: definizione, cause, sintomi, diagnosi, gravità, terapia
Funzioni della vasopressina a livello del sistema nervoso centrale
La vasopressina prodotta e rilasciata nel sistema nervoso centrale, dove ha funzioni di neurotrasmettitore o neuromodulatore, sembra essere implicata nei meccanismi di formazione della memoria (memoria a lungo e breve termine), riflessi polisinaptici. I meccanismi alla base di queste funzioni non sono stati ancora chiariti e anche il reale ruolo della vasopressina in questo ambito è ancora controverso. Ciononostante la desmopressina, una sostanza analoga alla vasopressina, ha suscitato interesse come sostanza nootropa. La vasopressina è rilasciata nel cervello con ritmo circadiano dai neuroni del nucleo soprachiasmatico dell’ipotalamo. La vasopressina rilasciata dai neuroni ipotalamiciche proiettano alla corteccia è coinvolta nella regolazione della pressione arteriosa, della temperatura corporea e, in animali come il topo campagnolo comune, nei comportamenti aggressivi. È in studio il ruolo della vasopressina nei comportamenti sociali dei topi. Si pensa che la vasopressina, rilasciata nel sistema nervoso centrale durante l’attività sessuale, induca e mantenga comportamenti rivolti a mantenere la stabilità della coppia come ad esempio l’aggressività verso altri maschi. Le evidenze sperimentali includono studi condotti in diverse specie animali e indicano che la distribuzione all’interno delle varie regioni del sistema nervoso centrale della vasopressina e dei suoi recettori presenta differenze tra le varie specie animali e correla con differenti comportamenti sociali specie specifici. In particolare, i recettori per la vasopressina sono distribuiti in maniera differente nelle specie animali monogame e promiscue, talvolta è differente anche la distribuzione degli assoni contenenti vasopressina, anche quando vengano comparate specie strettamente correlata tra di loro. Inoltre, anche esperimenti che prevedono l’iniezione intracerebrale di agonisti ed antagonisti della vasopressina rafforzano l’ipotesi che la vasopressina sia coinvolta nei comportamenti aggressivi contro altri maschi. È stato anche dimostrato che differenze nella sequenza del gene che codifica per il recettore della vasopressina tra individui della stessa specie potrebbero essere predittive di differenze nel comportamento sociale.
Leggi anche: Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
Struttura e correlazione con l’ossitocina
Le vasopressine (vasopressina umana e gli analoghi ormoni presenti in altre specie animali) sono dei peptidi formati da 9 aminoacidi (nonapeptide). Il numero di aminoacidi presenti nella molecola di preormone prima che questa venga attivata per clivaggio è di 164. La sequenza aminoacidica (struttura primaria) della vasopressina umana è Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly con i residui di cisteina legati da un ponte disolfuro. La lisin-vasopressina ha l’aminoacido lisina al posto dell’arginina. La struttura dell’ossitocina è molto simile a quella delle vasopressine: anch’essa è un nonapeptide (peptide di nove aminoacidi) con un ponte disolfuro e la sua sequenza aminoacidica differisce solo in due posizioni (vedi tabella seguente). Il gene che codifica per la vasopressina e il gene che codifica per l’ossitocina si trovano sullo stesso cromosoma separati da una distanza relativamente breve (meno di 15,000 basi nelle varie specie). I neuroni magnocellulari che producono vasopressina sono simili in molti aspetti e adiacenti ai neuroni magnocellulari che producono ossitocina. La somiglianza tra vasopressina ed ossitocina può determinare reazioni crociate: l’ossitocina presenta una bassa attività antidiuretica, alti livelli di vasopressina possono determinare contrazioni della muscolatura uterina.
Leggi anche: Patologie di ipotalamo e ipofisi
Patologie correlate alla vasopressina
Una alterata secrezione di vasopressina, può determinare danni anche molto gravi all’organismo:
- un aumentato livello di vasopressina configura la sindrome da inappropriata produzione di ormone antidiuretico (SIADH) che decorre con iposodiemia. Si possono riscontrare in patologie neurologiche e in caso di microcitoma polmonare, un tumore che può secernere sostanze ad attività ormonale tra cui la vasopressina;
- una diminuzione del rilascio di vasopressina o una diminuita sensibilità dei reni all’ormone determina diabete insipido, una condizione caratterizzata da ipersodiemia(aumento del sodio nel sangue), poliuria (aumentata produzione di urina) e conseguente polidipsia (sete);
- alcuni medicamenti preoperatori come gli oppiacei, ossitocina, antiemetici determinano un’aumentata secrezione di vasopressina che può causare una moderata iposodiemia per alcuni giorni;
- la vasopressina ha un ruolo nell’idrope dell’orecchio interno e nella sindrome di Mèniére.
Leggi anche:
- Rene: anatomia, funzioni e patologie in sintesi
- Differenza tra sindrome nefritica e nefrosica
- Proteinuria 24 ore alta: cause, tipi, valori e terapie
- Albumina ed albuminemia alta o bassa: cause, valori e terapie
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Differenza tra pressione idrostatica, oncotica ed osmotica
- Differenza tra osmosi ed osmosi inversa
- Esame delle urine completo con urinocoltura: come fare e capire i risultati
- Emoglobina nelle urine (emoglobinuria): cause, sintomi e terapia
- Differenza tra proteinuria transitoria, persistente ed ortostatica
- Differenza tra insufficienza renale acuta, cronica e dialisi
- Differenza tra anuria ed oliguria
- Differenza tra surrene e rene
- Differenza tra rene policistico e multicistico
- Differenza tra rene destro e sinistro
- Differenza tra uretra e uretere
- Differenza tra nefrologo ed urologo: patologie e competenze specifiche e comuni
- Elettroforesi delle proteine o protidogramma: valori e significato clinico
- Surrene: anatomia, funzioni e patologie in sintesi
- Differenza tra renella e calcoli renali
- Differenza tra anuria e ritenzione urinaria
- Azotemia (Urea) alta o bassa: valori, cause, sintomi e cosa fare
- Scura o chiara, liquida o schiumosa: la tua urina rivela la tua salute
- Si può vivere senza reni? Conseguenze della nefrectomia
- Differenze tra apparato urinario maschile e femminile
- Glomerulo renale: schema, funzione e flusso ematico renale
- Filtrazione glomerulare, riassorbimento e secrezione
- Vescica: dove si trova, anatomia, funzioni e patologie frequenti in sintesi
- Urodinamica: cos’è, a che serve e come funziona
- Minzione: come funziona l’emissione di urina e come si controlla
- Uretra maschile e femminile: anatomia, funzioni e patologie in sintesi
- Uretere: dove si trova, anatomia, funzioni e patologie in sintesi
- Differenza tra trombo, embolo, coagulo, embolia e trombosi
- Differenza tra arterie, vene, capillari, arteriole e venule
- Differenza tra arteriola afferente ed efferente: struttura e funzioni
- Differenza tra sinapsi elettrica e chimica
- Pressione arteriosa: valori normali e patologici
- Pressione alta (ipertensione arteriosa): sintomi, cause, valori e cure
- Perché la pressione arteriosa alta (ipertensione) è pericolosa?
- Differenza tra neuroni e nervi
- Qual è la differenza tra arteria e vena?
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su Mastodon, su YouTube, su LinkedIn, su Tumblr e su Pinterest, grazie!
Differenze tra diabete mellito ed insipido: glicemia, vasopressina, poliuria e polidipsia
 Il diabete insipido (DIN) è una malattia rara che – a causa del nome – viene spesso confusa con il diabete “più famoso”, cioè il diabete mellito. Il diabete mellito (di tipo 1 e 2) ed il diabete insipido, hanno effettivamente dei tratti in comune; entrambi sono caratterizzati da:
Il diabete insipido (DIN) è una malattia rara che – a causa del nome – viene spesso confusa con il diabete “più famoso”, cioè il diabete mellito. Il diabete mellito (di tipo 1 e 2) ed il diabete insipido, hanno effettivamente dei tratti in comune; entrambi sono caratterizzati da:
- Poliuria: cioè urinare molto; la diuresi è maggiore di 2500-3000 ml nelle 24 ore e si associa nicturia (necessità, anche molto frequente, di eliminazione dell’urina durante il riposo notturno);
- polidipsia: cioè una sete insaziabile.
Fatta eccezione per questi sintomi, il diabete insipido è molto diverso dal più diffuso diabete mellito e non esiste nessun tipo di correlazione accertata tra i due, che portano ai prima citati sintomi corrispondenti, tramite due meccanismi eziologici completamente diversi.
La glicemia nel diabete insipido è normale
Nel diabete insipido non si riscontrano alterazioni nella concentrazione di glucosio nel sangue e nelle urine, che dagli esami risultano quindi nella norma, al contrario di quello che accade nel mellito. Nel caso del diabete insipido, infatti, l’eccessiva quantità di urina non è la conseguenza di valori troppo alti di glucosio nel sangue dovuti ad un mancato o cattivo funzionamento dell’insulina, bensì è causata da un’alterazione della produzione, della secrezione o dei meccanismi di funzionamento dell’ormone vasopressina (l’ormone antidiuretico) da parte dell’ipotalamo e dell’ipofisi posteriore, o dalla sua mancata attività a livello renale.
Leggi anche:
- Differenze tra il diabete di tipo 1 e 2 (insulino dipendente e resistente)
- Diabete gestazionale: cos’è e quali sono i rischi per il feto e la madre
- Cosa può e non può mangiare il diabetico: cibi per controllare la glicemia
- Insulina alta: cause, diabete, prediabete, valori normali e cure
- Glicemia alta o bassa: valori normali, che patologie indica e come si controlla nei diabetici
Ormone antidiuretico
Nel caso di mancata produzione di vasopressina si tratta di diabete insipido centrale, ADH-sensibile o neurogenico, nel secondo caso di diabete insipido nefrogenico o ADH-insensibile (perché non si può correggere con la somministrazione di vasopressina). Il diabete insipido può essere completo o parziale, permanente o temporaneo. La vasopressina agisce a livello renale stimolando il riassorbimento di acqua ed opponendosi alla diuresi, per questo il sintomo principale del diabete insipido è la produzione di grandi quantità di urine diluite associate a sete intensa.
Diverse cause
Il diabete mellito è causato principalmente da patologie genetiche, l’insulinoresistenza di tipo A, il leprecaunismo, la Sindrome di Rabson-Mendenhall, le sindromi lipodistrofiche, il sovrappeso e l’obesità, la pancreatite, la fibrosi cistica, l’emocromatosi e il tumore del pancreas.
Il diabete insipido riconosce invece come cause altre patologie, come tumori ipofisari o per metastasi, traumatismi, operazioni neurochirurgiche, encefalite, meningite, patologie ereditarie o genetiche (alterazione dei recettori di tipo 2 della vasopressina, o deficit di acquaporina 2 a livello dei tubuli collettori renali).
Leggi anche:
- Emoglobina glicata alta, valori normali, IFCC e diabete
- Cosa succede al tuo corpo quando smetti di mangiare pasta e pane
- Shirataki, la pasta senza carboidrati e senza glutine che non fa ingrassare e può essere consumata anche da celiaci e diabetici
- Zucchero: il killer del terzo millennio. Ecco i cibi insospettabili dove si nasconde
- Stevia: tutta la dolcezza che vuoi a “calorie zero” e senza alterare la glicemia
Diagnosi differenziale
La diagnosi differenziale del diabete insipido si effettua escludendo la polidipsia psicogena, il diabete mellito e l’abuso di diuretici. La determinazione dell’osmolarità urinaria dopo prova di assetamento o dopo amministrazione di arginina-vasopressina è diagnostica.
- Prova di assetamento. In un soggetto sano comporta un aumento dell’osmolarità. Nel diabete insipido questa resta <300mOsm/L, mentre l’osmolarità plasmatica è superiore a 295. Non bere per lungo tempo può provocare una disidratazione ipertonica senza perdita di elettroliti.
- Test secondo Hickey-Hare. Se si sospetta un’assunzione di liquidi durante la prova di assetamento, si somministrano soluzioni ipertoniche che procurano risultati fisiologici e patologici identici alla prova da assetamento.
- Test alla desmopressina. Controindicata in caso di insufficienza coronarica per i suoi effetti vasospastici. Dopo questa somministrazione l’osmolarità urinaria aumenta in caso di diabete insipido centrale, ma non nel nefrogenico.
La determinazione dell’ADH è raramente necessaria. In caso di polidipsia psicogena sia l’ADH che l’osmolarità urinaria si elevano. Occorre escludere un tumore ipofisario o ipotalamico mediante tomografia computerizzata o imaging a risonanza magnetica.
Leggi anche:
- Fa più ingrassare la pasta o il riso? Quale scegliere per dimagrire?
- Quante calorie ha il pane? Bianco o integrale: per dimagrire quale scegliere?
- Polifenoli, erbe medicinali e staminali: funzionano realmente contro il diabete?
- Con la dieta mediterranea ti difendi dal diabete
- Zucchero o aspartame: quali sono le differenze?
- Il diabetico può mangiare la marmellata o il miele?
- Il diabetico può mangiare le fave ed i piselli?
- Il diabetico può mangiare la polenta?
- Il diabetico può mangiare le banane?
- Il diabetico può mangiare il riso?
- Diabete: quale frutta mangiare e quale evitare? Guida completa
- Alimentazione consigliata a chi soffre di diabete: i cibi che tengono sotto controllo la glicemia
- Indice glicemico: perché è importante per il paziente diabetico
- Diabete: come comportarsi col paziente anziano
- Diabete: guida completa a carboidrati, proteine, grassi, fibre, condimenti, bevande e dolci
- Diabete mellito: diffusione, sintomi, classificazione e diagnosi differenziale
- Diabete mellito: cause e fattori di rischio del tipo 1 e 2
- Diabete mellito: come si forma la malattia?
- Diabete mellito: conseguenze e complicanze a lungo termine
- Prevenzione del diabete mellito
- Trattamento del diabete mellito: esercizio fisico e follow up
- Trattamento farmacologico del diabete mellito
- Trattamento chirurgico del diabete mellito
- Neuropatia diabetica: sintomi e diagnosi di una complicanza del diabete
- Piede di Charcot: quali sono le cause della neuro-osteoartropatia?
- Piede diabetico: gradi di rischio, sintomi, diagnosi e terapia
- Ulcera diabetica: cause e tipi
- Diabete: tutte le diverse tipologie
- Diabete insipido: cause, diagnosi e trattamento
- Diabete mellito gestazionale: cause, diagnosi e trattamento
- Indice glicemico: cos’è, a che serve, perché è così importante?
- Differenza tra indice glicemico e carico glicemico
- Differenza tra indice glicemico e insulinico
- Differenza tra calorie e indice glicemico
- Differenza tra glicemia e indice glicemico
- Differenza tra glicemia e insulina
- Differenza calorie, kilocalorie e Joule: 1 Kcal quante calorie sono?
- Fabbisogno calorico: quante calorie “mangiare” ogni giorno?
- Diabete di tipo 2: cause, fattori di rischio, sintomi e cure
- Diabete di tipo 1: cause, fattori di rischio, sintomi e cure
- Differenza tra dieta ipocalorica, normocalorica ed ipercalorica
- Dieta ipoglucidica: cos’è e cosa mangiare?
- Dieta zero grano senza pane né pasta: cosa mangiare?
- Dieta mima digiuno: cosa mangiare, esempio e menu
- Dieta chetogenica: cosa mangiare, controindicazioni e rischi
- Dieta ipoproteica ed aproteica: cosa mangiare e chi la deve seguire
- Alga bruna o fucus per dimagrire: proprietà e controindicazioni
- Zucchine per dimagrire: proprietà, calorie, e controindicazioni
- Se hai il diabete puoi andare in pensione anticipata
- “Può causare cancro”: procura di Torino avvia inchiesta su farmaco anti-diabete
- Diabete e gengive infiammate: i diabetici rischiano di perdere il sorriso
- Farmaco per diabete ritirato dalle farmacie: ecco i lotti interessati
- Inverti il primo piatto con il secondo: il segreto della dieta anti-diabete
- Contenitori in plastica per il cibo e rischio diabete: studio su mamme e bimbi
- Diabete e dolci di Natale: il diabetico può mangiare il pandoro?
- Pandoro e dieta: calorie, carboidrati e valori nutrizionali
- Diabete e dolci di Natale: il diabetico può mangiare il panettone?
- Panettone e dieta: calorie, carboidrati e valori nutrizionali
- Diabete e dolci di Natale: il diabetico può mangiare il torrone?
- Torrone e dieta: calorie, carboidrati e valori nutrizionali
- Diabete e dolci di Pasqua: il diabetico può mangiare la colomba?
- Colomba e dieta: calorie, carboidrati e valori nutrizionali
- Ecco perché il kiwi è un’ottima scelta per chi soffre di diabete
- I 5 sintomi poco conosciuti del diabete
- Calore sul duodeno: una possibile cura per sconfiggere il diabete
- Diabete: impiantato in Italia nuovo sensore che monitora glicemia
- Pancreas artificiale: monitora e fornisce insulina per il paziente diabetico
- Diabete a Natale: le 10 regole da seguire per tenere sotto controllo la glicemia
- Nuova insulina rapida ‘”2×1″, iniezione più soft e più facile da trasportare
- Il cioccolato fondente protegge il cuore e previene il diabete
- Diabete: 5 regole per gestire la glicemia durante le vacanze estive
- 422 milioni di adulti con diabete nel mondo: quadruplicati dal 1980
- Punture sul dito addio, per i bimbi diabetici arriva la tecnica ‘flash’
- Chili di troppo per 27 milioni di italiani, 100 mila nuovi obesi l’anno
- Attenti agli energy drink: “Potrebbero portare al diabete”
- Troppo macho per la dieta, sempre più uomini muoiono di diabete
- I bambini italiani sono i più grassi d’Europa
- Attenti al pisolino: oltre i 40 minuti aumenta rischio diabete
- In Italia 4 milioni di diabetici, cura precoce abbatte le complicanze
- Farmaci al posto di corsa e palestra, arriva lo sport in pillole contro il diabete
- Diabete: un nuovo cerotto analizza sudore e misura glicemia
Articoli sul prediabete:
- Differenza tra prediabete, intolleranza glucidica e diabete
- Come faccio a sapere se sono in prediabete senza saperlo?
- Il prediabete porta sempre al diabete di tipo 2?
- Ho scoperto di avere il prediabete: cosa posso fare per evitare il diabete conclamato?
- Prediabete (intolleranza glucidica): sintomi, dieta e valori ematici
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Asse ipotalamo-ipofisi-testicolo: funzionamento ed ormoni rilasciati
 L’ipotalamo rilascia il GnRh, ormone rilasciante le gonadotropine Lh ed FSH rilasciate dall’ipofisi. Le due gonadotropine a livello del testicolo si indirizzano verso (LH) le cellule del Leydig e (FSH) tubulo seminifero, quindi l’LH controlla la steroidogenesi che avviene nelle cellule del Leydig mentre l’FSH controlla la spermatogenesi nel tubulo seminifero con il mantenimento dell’ABP che lega il testosterone.
L’ipotalamo rilascia il GnRh, ormone rilasciante le gonadotropine Lh ed FSH rilasciate dall’ipofisi. Le due gonadotropine a livello del testicolo si indirizzano verso (LH) le cellule del Leydig e (FSH) tubulo seminifero, quindi l’LH controlla la steroidogenesi che avviene nelle cellule del Leydig mentre l’FSH controlla la spermatogenesi nel tubulo seminifero con il mantenimento dell’ABP che lega il testosterone.
All’interno del testicolo vediamo che le due cellule sono in contatto fisico e funzionale in quanto il testosterone prodotto dal Leydig giunge nel tubulo seminifero, viene legato dalla proteine ABP e qui serve a controllare la produzione degli spermatozoi.
Questi sono effetti positivi. La spermatogenesi e sia LH che FSH dipendente perché l’LH guida la steroidogenesi e il testosterone assicura una corretta spermatogenesi.
La dopamina e la serotonina (neurotrasmettitori) hanno un effetto inibitorio sull’ipotalamo e sul rilascio di GnRH mentre la norepinefrina ha effetto positivo sul rilascio di GnRH.
Leggi anche:
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
Abbiamo feedback negativi che mantengono l’omeostasi della funzione gonadale, quindi un elevata concentrazione e sintesi di testosterone ed estradiolo innesca un feed – quindi viene rilasciato meno LH ma anche un feed – a livello ipotalamico quindi viene rilasciato meno GnRH. L’FSH inibito dall’inibina prodotta a livello della cellula del Sertoli che serve in modo specifico ad inibire l’FSH e mantenere livelli fisiologici.
Anche gli androgeni testosterone e DHT e anche la minima parte di estradiolo sono in grado di inibire l’FSH ipofisario, è ovvio che se ci sono elevate concentrazioni di androgeni la prima gonadotropina inibita è l’LH, anche se il controllo specifico sull’FSH è dato dall’inibina. Non si sa però ancora se l’inibina è in grado di indurre un freno inibitorio sul GnRH.
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!
Asse ipotalamo-ipofisi-tiroide: funzionamento ed ormoni rilasciati
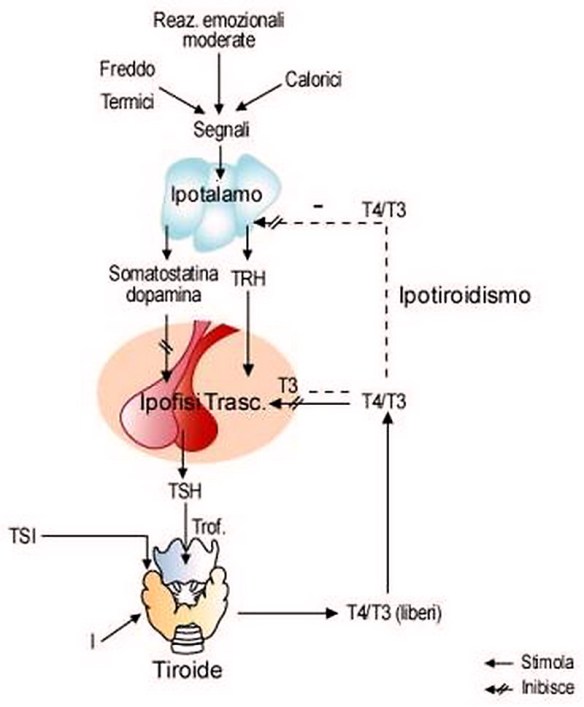 Quando l’ipotalamo rileva bassi livelli circolanti di ormoni tiroidei triiodotironina (T3) e tiroxina (T4), accade che:
Quando l’ipotalamo rileva bassi livelli circolanti di ormoni tiroidei triiodotironina (T3) e tiroxina (T4), accade che:
- l’ipotalamo rilascia l’ormone di rilascio della tireotropina (TRH);
- il TRH stimola l’ipofisi a produrre l’ormone tireostimolante (TSH o tireotropina);
- il TSH rilasciato dall’ipofisi stimola la tiroide;
- la tiroide, stimolata dal TSH ipofisario, produce e rilascia maggior quantità di triiodotironina (T3) e tiroxina (T4).
Gli ormoni tiroidei esercitano un controllo di tipo feedback negativo sull’ipotalamo e l’ipofisi anteriore, controllando così il rilascio sia di TRH che di TSH: quanto triiodotironina (T3) e tiroxina (T4) sono in quantità elevate, il rilascio di TRH e di TSH diminuiscono raggiungendo l’omeostasi, cioè l’equilibrio.
Leggi anche:
- Tiroide: dove si trova, com’è fatta e quali funzioni svolge?
- Differenza tra ipotiroidismo primario, secondario e terziario
- Ormoni tiroidei: differenza T3 e T4, valori normali e patologici
- TSH alto, basso e valori normali: qual è il significato clinico?
- Tireoglobulina alta, bassa, valori normali ed interpretazione
- Metabolismo basale: cos’è, definizione, calcolo, alto, basso, totale
- Asse ipotalamo-ipofisi-tiroide: funzionamento ed ormoni rilasciati
- Ipertiroidismo: cause, cura, valori diagnosi, sintomi iniziali, conseguenze
- Ipertiroidismo nell’uomo: sintomi, conseguenze sulla libido, cure
- Ipotiroidismo: sintomi, diagnosi, cura farmacologica e consigli dietetici
- Esame obiettivo del collo: palpazione della tiroide, video e spiegazione
- Ecografia della tiroide: a cosa serve, come si svolge e come ci si prepara all’esame
- Scintigrafia tiroidea: risultati, captazione, noduli, costo
- Agoaspirato tiroideo: esito, complicanze, dolore, referto, prezzo
- Tiroidite di Hashimoto: esami, cura, conseguenze, dieta, guarire
- Tiroidite di De Quervain (subacuta): sintomi, dieta, si guarisce, è contagiosa?
- Tireotossicosi autoimmune, iatrogena, factitia, valori, cura
- Differenza tra ipertiroidismo e tireotossicosi
- Morbo di Basedow: alimentazione, cura, occhi, si guarisce, rimedi
- Gozzo tiroideo: semplice, tossico, endemico, rimedi, intervento, immagini
- Gozzo tossico nodulare e multinodulare: sintomi, diagnosi e cura
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Feedback negativo ed omeostasi: spiegazione ed esempi
- Patologie di ipotalamo e ipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su Mastodon, su YouTube, su LinkedIn, su Tumblr e su Pinterest, grazie!
Asse ipotalamo-ipofisi-surrene: funzionamento ed ormoni rilasciati
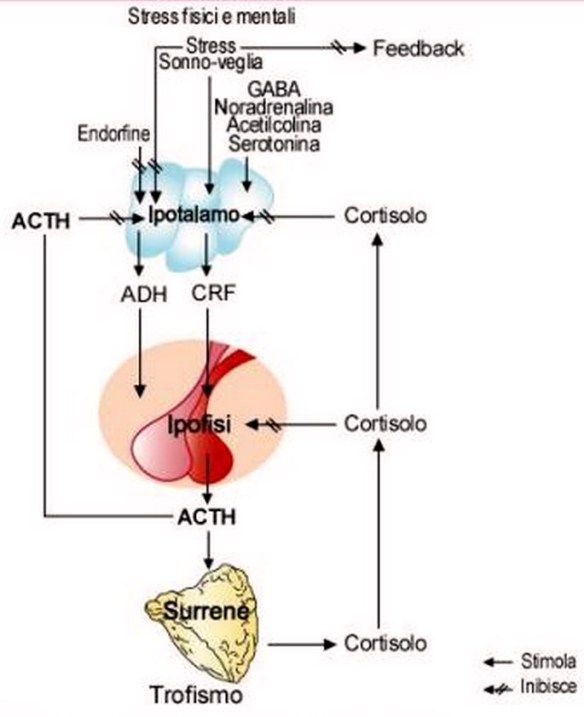 L’ipotalamo rilascia il fattore CRF che sta per fattore rilasciante la corticotropina o CRH che stimola l’adenoipofisi a rilasciare l’ormone ACTH, ormone adrenocorticotropo. Quest’ormone è importantissimo perché stimola poi la sintesi degli steroidi.
L’ipotalamo rilascia il fattore CRF che sta per fattore rilasciante la corticotropina o CRH che stimola l’adenoipofisi a rilasciare l’ormone ACTH, ormone adrenocorticotropo. Quest’ormone è importantissimo perché stimola poi la sintesi degli steroidi.
Il CRH o CRF nasce sottoforma di pre – pro CRH di 196 aa. e al carbossi term.troviamo la sequenza vera e propria dell’ormone ad attività biologica. Il crf agisce tramite recettori di membrana sull’adenoipofisi e quando viene rilasciato si lega e innesca l’attivazione della proteina G che attivando l’adenilato ciclasi innesca la produzione di cAMP che facilità il rilascio e la sintesi di ACTH da parte dell’adenoipofisi. Questo ACTH a sua volta nasce anch’esso come molecola precursore che è molto grossa e prende il nome di propio-melanocortina (POMC) dal gene che codifica per questa grossa proteina, siamo a livello dell’adenoipofisi.
Leggi anche:
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
Tramite peptidasi viene rilasciato l’ACTH ma vengono rilasciati anche frammenti carbossi-terminale che prende il nome di Beta-Lph che sta per Beta-lipotrofina. abbiamo diversi tagli molecolari che questa molecola subisce a livello adenoipofisario e questo prodotto lo troviamo anche a livello di tessuti extraipofisario, e livello gastroenterico, a livello del surrene e dell’ipofisi intermedia. In questi tessuti la molecola viene ulteriormente clivato dando origine ad altri prodotti di minore taglia come la beta – endorfina e la gamma – endorfina che si originano dalla beta – lipotrofina; dal peptide corrispondente all’ACTH si originano l’alfa MSH (melanocita stimolante) e il clip e infine si origina anche a partire dalla beta lipotropina il beta MSH soprattutto a livello dell’ipofisi intermedia.
A noi interessa soprattutto l’ACTH. L’ACTH rilasciato dall’adenoipofisi agisce con il suo recettore di membrana localizzato sulle cellule della corticale del surrene e anche in qst caso il recettore è accoppiato con l’cAMP che va ad attivare la PKA che va a fosforilare delle proteine importanti per la sintesi degli steroidi, fosforila delle proteine che rendono libera la molecola precursore che è il colesterolo presente immagazzinato nelle cellule come estere del colesterolo quindi la PKA agisce attivando le esterasi in modo tale che i legami di tipo estereo vengano rotti in modo tale che il colesterolo venga reso disponibile.
La sintesi del cortisolo e dell’ACTH è una sintesi non sempre uguale nelle 24h ma è elevata nelle prime ore del mattino, c’è una perfetta sincronia tra picchi dell’ACTH e picchi del cortisolo. Intorno alle 24 siccome gli ormoni glucocorticoidi sono ormoni che mantengono desta l’attenzione sono molto importanti per mantenere sveglia la memoria e l’attenzione, è quindi ovvio che naturalmente intorno alle 24 raggiungono dei livelli molto basali, si ha un livello basale del cortisolo che mantiene un livello molto basso del cortisolo.
È importante che le concentrazioni ormonali di questi ormoni aumentino al momento del risveglio, infatti intorno alle primissime ore del mattino, intorno alle 6, si ha un incremento delle concentrazioni di ACTH e di cortisolo. Infatti intorno alle 2 – 3 di notte c’è un sonno molto pesante che viene dato anche dalla mancanza di ormoni glucocorticoidi perché siamo ad un livello basale; man mano che inizia ad aumentare la sintesi di glucocorticoidi diventiamo più desti. Abbiamo quindi una ciclicità di secrezione impartita dal nostro orologio biologico impartito dal nucleo sovra-chiasmatico a livello celebrale da cui provengono anche i nostri ritmi sonno-veglia.
Da alcuni esperimenti su animali si è visto che un ritmo biologico di secrezione viene proprio mantentuo dalle cellule della corticale del surrene, cioè cellule della corticale del surrene messe in coltura hanno attività secretoria ciclica.
L’ ASSE IPOTALAMO IPOFISI SURRENE è un asse neuroendocrino controllato molto dallo stress, dall’ansia che influiscono sulla secrezione di glucocorticoidi e sui ritmi circadiani. Di tutti i neurotrasmettitori la serotonina e l’acetilcolina hanno un effetto positivo che potenzia a livello ipotalamico il rilascio di CRH, mentre il GABA è solitamente inibitorio unitamente alla noradrenalina hanno effetto inibitorio sul CRH.
Il CRH rilasciato dall’ipotalamo a livello dell’adenoipofisi controlla il rilascio dell’ACTH che subisce anche l’influenza positiva dell’adrenalina. L’ACTH a livello del surrene mantiene attiva la secrezione ormonale del cortisolo. Quando le concentrazioni di cortisolo tendono ad aumentare il cortisolo agisce con un controllo negativo sull’ACTH ipofisario o sul CRH ipotalamico. Anche l’ACTH se presente in eccesso è in grado di inibire il rilascio di CRH. La vasopressina è un potente stimolatore.
Questo asse neuroendocrino ricordiamo che ha una certa ciclicità, anche se ci sono situazioni che possono alterarlo, ad esempio lo stress impone un’ ipersecrezione di CRH e ACTH quindi lo stress governa quest’asse e anche quando la sera tardi i livelli di questi ormoni dovrebbero essere basali se siamo nervosi, aumenta la secrezione di catecolamine e lo stress impone un maggiore rilascio di ACTH e CRH.
L’ACTH soprattutto controlla il ritmo di sonno ma la ghiandola corticosurrenale libera cortisolo e mineralcorticoidi come l’aldosterone e questo ormone è sotto il controllo di ipotalamo e ipofisi ma l’ACTH controlla questo ormone solo quando raggiunge delle concentrazioni molto elevate e ne può ridurre il rilascio anche se il mineralcorticoide è sottoposto ad un altro tipo di controllo che vedremo che non è questo ipotalamico.
Leggi anche:
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
- Asse ipotalamo-ipofisi-gonade: funzionamento ed ormoni rilasciati
- Ormone della crescita (GH) a che serve e da cosa è prodotto?
- Ormone della crescita (GH): body building e doping in palestra
- Ormone della crescita (GH): effetti avversi nel body building e nello sport
- Quando essere troppo alti è una malattia: il gigantismo
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso simpatico: funzioni
- Sistema nervoso parasimpatico: funzioni
- Cos’è una ghiandola endocrina? A che servono gli ormoni ed il sistema endocrino?
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Cervello maschile e femminile: quali sono le differenze?
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Cos’è l’adrenalina ed a cosa serve?
- L’altezza media italiana nel 2017 di maschi e femmine
- L’altezza media italiana 2017 da 1 a 19 anni di maschi e femmine
- L’altezza media mondiale nel 2017 di maschi e femmine [TABELLA]
- Altezza: quando si può parlare di nanismo o gigantismo
- Differenza tra midollo osseo e spinale
- Differenza tra sistema nervoso centrale e periferico: anatomia e funzioni in sintesi
- A cosa serve il midollo osseo?
- Differenza tra midollo osseo e cellule staminali
- Differenza tra midollo spinale e allungato
- Differenza tra epifisi, diafisi, metafisi ed ipofisi
- Quanto è alto l’uomo più alto del mondo?
- Quanto è alto l’uomo più basso del mondo?
- Nanismo: sintomi, cura, cause, terapia, diagnosi e prevenzione
- Charlotte, la bambina più piccola del mondo
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, segui la nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su Mastodon, su YouTube, su LinkedIn, su Tumblr e su Pinterest, grazie!
Asse ipotalamo-ipofisi-gonade: funzionamento ed ormoni rilasciati
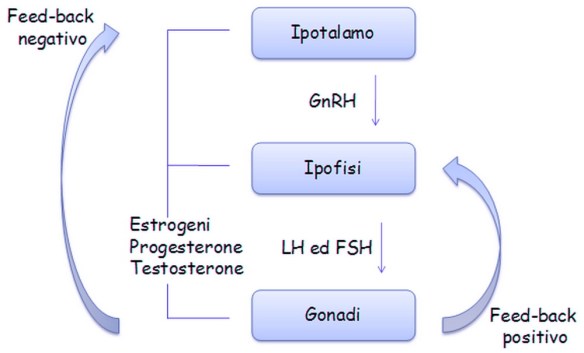 L’ipotalamo secerne il GnRH che va a stimolare l’adenoipofisi per la secrezione di due gonadotropine, LH ed FSH. Quest’asse neuroendocrino è silente fino al periodo della pubertà e viene sollecitato durante il periodo puberale e grazie all’inizio dell’attività secretoria da parte dell’ipotalamo inizia ad essere sollecitata l’ipofisi che sollecita così l’attività delle gonadi che iniziano la sintesi degli steroidi e la maturazione dei gameti. Ancora non si sa qual è il primo evento che scatena l’attivazione di quest’asse durante la pubertà, le gonadotropine LH ed FSH prima della nascita, dopo la nascita e nell’età matura.
L’ipotalamo secerne il GnRH che va a stimolare l’adenoipofisi per la secrezione di due gonadotropine, LH ed FSH. Quest’asse neuroendocrino è silente fino al periodo della pubertà e viene sollecitato durante il periodo puberale e grazie all’inizio dell’attività secretoria da parte dell’ipotalamo inizia ad essere sollecitata l’ipofisi che sollecita così l’attività delle gonadi che iniziano la sintesi degli steroidi e la maturazione dei gameti. Ancora non si sa qual è il primo evento che scatena l’attivazione di quest’asse durante la pubertà, le gonadotropine LH ed FSH prima della nascita, dopo la nascita e nell’età matura.
La secrezione di GnRH da parte dell’ipotalamo inizia nella 4° settimana di gestazione; questo rilascio pian piano sollecita l’ipofisi a rilasciare LH ed FSH e la loro sintesi inizia verso la 10 – 12 settimana di gestazione; poco prima della nascita questi valori decadono per mantenersi basse durante la prima infanzia e la secrezione si mantiene bassa anche durante la seconda infanzia e anche nell’età peri-puberale, momento in cui l’asse inizia a svegliarsi. Durante l’infanzia la quantità di FSH circolante supera quella dell’LH, in effetti l’FSH ha effetti sull’attività maturativa dei gameti. Durante la pubertà vediamo che l’attività secretoria del GnRH diventa più consistente probabilmente perché ci sono fattori di tipo inibitorio che vengono rimossi anche se ci sono ancora molti studi in corso.
L’LH a livello gonadale inizia la sintesi degli steroidi gonadici, testosterone nel testicolo, estrogeni e progesterone nelle ovaie. Nella donna la secrezione di LH ed FSH è ciclica mentre nell’uomo questa ciclicità non c’è. Nella tarda età nella donna l’attività riproduttiva cessa, nella menopausa infatti la quantità di gameti femminili è stata consumata o comunque è andata incontro ad un processo degenerativo per cui la donna non è più in grado di concepire; l’uomo invece mantiene la sua attività maturativa anche al di là dei 60 anni.
Il GnRH è un decapeptide, una proteina di 10 aa. che tramite la circolazione portale ipofisaria raggiunge l’ipofisi dove induce sintesi e rilascio di LH ed FSH che sono due glicoproteine costituite da una sub unità alfa e una beta quindi sono etero dimeri e includono nella molecola anche residui carboidratici; la subunità alfa è costituita da uno stesso numero di aa. che sono sempre gli stessi e quindi questa subunità alfa è comune alla subunità alfa del TSH e della gonadotropina corionica CG, quella che cambia è la subunità beta che si differenzia sia per lunghezza in aa. che per sequenza.
Il GnRH induce a recettori specifici di membrana sulle cellule ipofisarie e la risposta che dà quando si lega è che va ad attivare il metabolismo dei fosfolipidi, in generale tutti i fattori di rilascio ipotalamici vanno ad attivare recettori di membrana connessi con l’attivazione dei fosfolipidi di membrana quindi formazione di DAG, attivazione proteina chinasi C e di IP3 ma anche attivazione dell’cAMP mentre LH ed FSH hanno recettori di membrana è il meccanismo di traduzione che attivano è quello dell’adenilato ciclasi con incremento di cAMP.
Leggi anche:
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
- Asse ipotalamo-ipofisi-surrene: funzionamento ed ormoni rilasciati
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Virilizzazione (mascolinizzazione): tipi, cause, sintomi, diagnosi e terapie
- Irsutismo: cause, sintomi, diagnosi e trattamenti
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Ormone della crescita (GH) a che serve e da cosa è prodotto?
- Ormone della crescita (GH): body building e doping in palestra
- Ormone della crescita (GH): effetti avversi nel body building e nello sport
- Quando essere troppo alti è una malattia: il gigantismo
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso simpatico: funzioni
- Sistema nervoso parasimpatico: funzioni
- Cos’è una ghiandola endocrina? A che servono gli ormoni ed il sistema endocrino?
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Cervello maschile e femminile: quali sono le differenze?
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Cos’è l’adrenalina ed a cosa serve?
- L’altezza media italiana nel 2017 di maschi e femmine
- L’altezza media italiana 2017 da 1 a 19 anni di maschi e femmine
- L’altezza media mondiale nel 2017 di maschi e femmine [TABELLA]
- Altezza: quando si può parlare di nanismo o gigantismo
- Differenza tra midollo osseo e spinale
- Differenza tra sistema nervoso centrale e periferico: anatomia e funzioni in sintesi
- A cosa serve il midollo osseo?
- Differenza tra midollo osseo e cellule staminali
- Differenza tra midollo spinale e allungato
- Differenza tra epifisi, diafisi, metafisi ed ipofisi
- Quanto è alto l’uomo più alto del mondo?
- Quanto è alto l’uomo più basso del mondo?
- Nanismo: sintomi, cura, cause, terapia, diagnosi e prevenzione
- Charlotte, la bambina più piccola del mondo
Lo Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram o su Pinterest, grazie!
Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
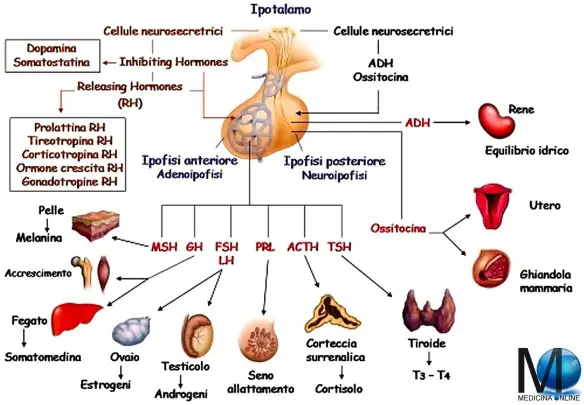
Fonte dell’immagine: dr. Mauro Amato – Centro Analisi Cliniche AMATO sas – Via Tattoli 6/o Molfetta (Bari)
Il SNC (sistema nervoso centrale), in funzione degli stimoli che riceve dall’esterno e dall’interno del nostro corpo, trasmette dei messaggi – tramite neurotrasmettitori – all’ipotalamo, che esercita a sua volta un influenza sulla ghiandola sottostante l’ipotalamo stesso, che si chiama ipofisi, attraverso altri neurotrasmettitori da esso liberati, in un complesso sistema che lega le due strutture, chiamato asse ipotalamo-ipofisario o asse ipotalamo-ipofisi (hypothalamic–pituitary axis in inglese).
L’ipotalamo appartiene al sistema nervoso centrale ma, da un punto di vista funzionale, i suoi neuroni sono capaci di ricevere segnali che arrivano sia dalle strutture nervose superiori, sia dalle ghiandole del sistema endocrino (ipofisi e gonadi per esempio), che non sono strutture nervose. Esso è quindi la sede in cui si verificano le connessioni tra sistema nervoso centrale e sistema endocrino (ormonale).
Gli ormoni prodotti dall’ipotalamo sono di natura proteica (mentre quelli prodotti dalle gonadi sono dei derivati del colesterolo, e quindi di natura lipidica) ed agiscono sull’ipofisi. Essa è suddivisa in due porzioni, una anteriore, o adenoipofisi, ed una posteriore, o neuroipofisi.
L’adenoipofisi è collegata all’ipotalamo da un sistema di vasi sanguigni nel quale vengono immessi gli ormoni ipotalamici che arrivano così all’ipofisi. Allo stesso modo, sempre attraverso questo sistema, gli ormoni prodotti dall’ipofisi possono giungere all’ipotalamo ed influenzarne la funzione.
Gli ormoni ipotalamici determinano, a livello dell’adenoipofisi, la sintesi, l’accumulo, quindi la immissione nel sangue di una serie di prodotti che vengono chiamate tropine in quanto agiscono su altre ghiandole del sistema endocrino che sono dipendenti dall’ipofisi (ovaio, testicolo, tiroide, mammella, corticale del surrene, funzione dell’ accrescimento ecc…).
Gli ormoni ipotalamici sono indicati come Relasing Hormones (RH) e cioè sostanze che stimolano la dismissione e l’ingresso nel sangue degli ormoni ipofisari.
Gli RH sono:
- Il GnRH o relasing hormone per le due gonadotropine ipofisarie LH ed FSH, agenti sulle ovaie per l’induzione dell’ovulazione;
- Un relasing hormone per la tireostimolina ipofisaria o TRH agente sulla tiroide;
- Un relasing hormone per l’ormone ipofisario della crescita o GHRH;
- Un relasing hormone per la tropina che stimola la corticale del surrene o CRH, inducendola a sua volta a produrre l’ormone cortisolo;
Allo stesso modo, esistono anche ormoni che inibiscono la secrezione dell’ipofisi qualora ciò risulti necessario.
Sotto lo stimolo o l’inibizione dell’ipotalamo, l’adenoipofisi produce una serie di ormoni o tropine di natura proteica ed altre sostanze, come per esempio le endorfine, che si trovano anche nel cervello ed hanno una struttura chimica che assomiglia a quella degli oppioidi.
Gli ormoni ipofisari sono rappresentati da:
- Gonadotropina FSH (ormone stimolante il follicolo);
- Gonadotropina LH (ormone luteinizzante);
- ICSH (ormone stimolante le cellule interstiziali del testicolo) nell’uomo;
- Prolattina, importante nella preparazione della ghiandola mammaria durante la gravidanza e nella sua funzione durante l’allattamento. Al di fuori dello stato gravidico, i livelli di prolattina non fisiologici possono influenzare negativamente i meccanismi della fertilità, quindi della riproduzione;
- Il TSH (tropina stimolante la tiroide);
- L’ACTH (tropina stimolante la corticale del surrene);
- Il GH (tropina stimolante l’accrescimento corporeo);
Inoltre, l’ipofisi produce peptidi oppioidi (endorfine) e fattori che influenzano il fegato ed il pancreas.
Le gonadotropine agiscono sulle gonadi (ovaio e testicolo). L’ovaio, sotto lo stimolo delle gonadotropine, secerne tre ormoni che derivano dal colesterolo: estrogeni, androgeni, progesterone e suoi derivati.
Esiste nell’ipofisi anche un lobo posteriore a struttura nervosa, chiamata neuroipofisi, a cui arrivano direttamente dall’ipotalamo, stavolta non attraverso il sangue ma tramite dei prolungamenti di neuroni, una serie di sostanze prodotte dai neuroni dell’ipotalamo stesso. Queste, vengono poi immesse nel circolo sanguigno ed hanno azioni su tutto l’organismo. Fra esse, le più importanti sono l’ADH o ormone antidiuretico o vasopressina, responsabile della ritenzione di sodio, e l’ossitocina, che stimola la contrazione della muscolatura dell’utero durante il parto e delle cellule muscolari (mioepiteliali) della mammella durante l’allattamento per favorire l’uscita del latte.
Per approfondire, continua la lettura con:
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Asse ipotalamo-ipofisi-gonade: funzionamento ed ormoni rilasciati
- Asse ipotalamo-ipofisi-surrene: funzionamento ed ormoni rilasciati
- Asse ipotalamo-ipofisi-testicolo: funzionamento ed ormoni rilasciati
- Asse ipotalamo-ipofisi-tiroide: funzionamento ed ormoni rilasciati
- Vasopressina (ormone antidiuretico o ADH): funzioni e patologie
- Ormone adrenocorticotropo o corticotropina (ACTH) cos’è e quali sono le sue funzioni
- Ormone della crescita (GH) a che serve e da cosa è prodotto?
- Ormone della crescita (GH): body building e doping in palestra
- Ormone della crescita (GH): effetti avversi nel body building e nello sport
- TSH alto, basso e valori normali: qual è il significato clinico?
- Differenza tra ipotiroidismo primario, secondario e terziario
Leggi anche:
- Surrene: anatomia, funzioni e patologie in sintesi
- Cos’è l’adrenalina ed a cosa serve?
- Adrenalina e “combatti o fuggi”: ecco cosa accade nel nostro corpo quando siamo terrorizzati
- Differenza tra beta bloccanti, ace inibitori, calcio antagonisti, sartani e diuretici
- Testosterone basso, alto, valori normali ed interpretazione
- Ormoni estrogeni: cosa sono e quali funzioni svolgono?
- Progesterone: cos’è, a cosa serve, valori e quali funzioni ha in gravidanza?
- Quando la donna ha troppi peli dove non dovrebbero essere: irsutismo, cause, trattamenti e differenze con ipertricosi
- Cos’è una ghiandola endocrina? A che servono gli ormoni ed il sistema endocrino?
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Differenze tra adrenalina e noradrenalina
- Apparato urinario: anatomia e fisiologia [SCHEMA]
- Rene: anatomia, funzioni e patologie in sintesi
- Differenza tra surrene e rene
- Dopammina: cos’è ed a che serve?
- Neurotrasmettitori: cosa sono ed a che servono
- Si può vivere senza reni? Conseguenze della nefrectomia
- Dopammina: biosintesi, rilascio nello spazio sinaptico e degradazione
- Sistema dopamminergico: i circuti nervosi della dopammina
- Quando essere troppo alti è una malattia: il gigantismo
- Sistema nervoso: com’è fatto, a che serve e come funziona
- Sistema nervoso simpatico: funzioni
- Sistema nervoso parasimpatico: funzioni
- Cos’è una ghiandola endocrina? A che servono gli ormoni ed il sistema endocrino?
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Cervello maschile e femminile: quali sono le differenze?
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Differenza tra sistema nervoso centrale e periferico: anatomia e funzioni in sintesi
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su YouTube, su LinkedIn, su Reddit, su Tumblr e su Pinterest, grazie!
