 La malattia di Parkinson (in passato denominata “morbo di Parkinson“; anche chiamata Parkinson, parkinsonismo idiopatico o parkinsonismo primario; in inglese denominata “Parkinson disease” o “primary parkinsonism” o “hypokinetic rigid syndrome” o “paralysis agitans” o “shaking palsy”) è una malattia neurodegenerativa extrapiramidale caratterizzata da rigidità muscolare che si manifesta con resistenza ai movimenti passivi; tremore che insorge durante lo stato di riposo e che può aumentare in caso di stato di ansia; bradicinesia che provoca difficoltà a iniziare e terminare i movimenti.
La malattia di Parkinson (in passato denominata “morbo di Parkinson“; anche chiamata Parkinson, parkinsonismo idiopatico o parkinsonismo primario; in inglese denominata “Parkinson disease” o “primary parkinsonism” o “hypokinetic rigid syndrome” o “paralysis agitans” o “shaking palsy”) è una malattia neurodegenerativa extrapiramidale caratterizzata da rigidità muscolare che si manifesta con resistenza ai movimenti passivi; tremore che insorge durante lo stato di riposo e che può aumentare in caso di stato di ansia; bradicinesia che provoca difficoltà a iniziare e terminare i movimenti.
I sintomi e segni motori tipici della condizione sono il risultato della necrosi (morte) delle cellule che sintetizzano e rilasciano la dopamina. Tali cellule si trovano nella substantia nigra, una regione del mesencefalo. La causa che porta alla loro morte è sconosciuta. All’esordio della malattia, i sintomi più evidenti sono legati al movimento, ed includono tremori, rigidità, lentezza nei movimenti e difficoltà a camminare. In seguito, possono insorgere problemi cognitivi e comportamentali, con la demenza che si verifica nelle fasi avanzate. La malattia di Parkinson è più comune negli anziani; la maggior parte dei casi si verifica dopo i 50 anni.
Leggi anche: Morbo di Alzheimer: cause, sintomi, decorso, terapie
I segni motori principali sono comunemente chiamati parkinsonismo. La condizione è spesso definita come una sindrome idiopatica anche se alcuni casi atipici hanno un’origine genetica. Molti fattori di rischio e fattori protettivi sono stati indagati: ad esempio, l’aumento del rischio di contrarre la malattia nelle persone esposte ad idrocarburi solventi e pesticidi. La patologia è caratterizzata dall’accumulo di una proteina, chiamata alfa-sinucleina, in inclusioni denominate corpi di Lewy nei neuroni e dall’insufficiente formazione di dopamina. La distribuzione anatomica dei corpi di Lewy è spesso direttamente correlata all’espressione e al grado dei sintomi clinici di ciascun individuo.
Leggi anche: Sistema nervoso: com’è fatto, a che serve e come funziona
La diagnosi nei casi tipici si basa principalmente sui sintomi, con indagini di neuroimaging come conferma. I moderni trattamenti sono efficaci per gestire i sintomi motori precoci della malattia, grazie all’uso di agonisti della dopamina e del levodopa. Col progredire della malattia, i neuroni dopaminergici continuano a diminuire di numero, e questi farmaci diventano inefficaci nel trattamento della sintomatologia e, allo stesso tempo, producono una complicanza, la discinesia, caratterizzata da movimenti involontari. Una corretta alimentazione e alcune forme di riabilitazione hanno dimostrato una certa efficacia nell’alleviare i sintomi. La chirurgia e la stimolazione cerebrale profonda vengono utilizzate per ridurre i sintomi motori come ultima risorsa, nei casi più gravi in cui i farmaci risultano inefficaci. Diverse importanti organizzazioni promuovono la ricerca e il miglioramento della qualità della vita delle persone affette dalla malattia.
Persone famose con malattia di Parkinson
Alcune persone famose con malattia di Parkinson, come il pugile Muhammad Ali e papa Giovanni Paolo II, il cantautore Bruno Lauzi, hanno fatto crescere negli ultimi anni la consapevolezza della malattia a livello mondiale e contribuito ad abbatterne i tabù ed i pregiudizi. Una delle persone più famose che soffre di malattia di Parkinson è l’attore Michael J. Fox, famoso soprattutto per l’interpretazione di Marty McFly, protagonista della trilogia cinematografica di Ritorno al Futuro. Nel 1991, all’età di appena 30 anni, gli fu diagnosticata una grave forma di malattia di Parkinson: l’aggravarsi dei sintomi lo obbligò a ritirarsi quasi del tutto dalle scene cinematografiche dal 2000, ma gli consentì anche di lottare in prima fila per la ricerca sperimentale sulle cellule staminali. L’impegno dello sfortunato attore lo ha condotto ad istituire la Fondazione Michael J. Fox, che si dedica dal 31 ottobre del 2000 alla ricerca di una cura per la malattia di Parkinson, con un patrimonio di 450 milioni di dollari. Per tale impegno il 5 marzo 2010 l’Istituto Karolinska ha conferito a Michael J. Fox una laurea honoris causa. Leggi anche: Il commovente abbraccio tra Michael J. Fox e Christopher Lloyd
Eponimo
La malattia prende il nome dal medico inglese James Parkinson, che pubblicò la prima descrizione dettagliata nel suo trattato An Essay on the Shaking Palsy nel 1817. Un tempo chiamata “morbo”, il Parkinson viene attualmente chiamata “malattia”. L’espressione “morbo di Parkinson” è comunque ancora molto usata, anche dai medici, ed è a tutti gli effetti sinonimo di “malattia di Parkinson”. A tal proprosito leggi: Differenza tra malattia, patologia, sindrome, disturbo, disordine, morbo
Epidemiologia
La malattia di Parkinson è la seconda malattia neurodegenerativa più comune dopo la malattia di Alzheimer. La prevalenza della condizione nei paesi industrializzati è di circa lo 0,3%. La malattia di Parkinson è più comune negli anziani e la prevalenza aumenta dall’1% in quelli oltre i 60 anni di età, fino al 4% della popolazione sopra gli 80 anni. L’età media di insorgenza è circa 60 anni, anche se il 5-10% dei casi, classificati come ad esordio giovane, iniziano tra i 20 e i 50 anni. La malattia risulterebbe essere meno diffusa nelle popolazioni di origine africana e asiatica, sebbene questo dato sia contestato. Alcuni studi hanno proposto che sia più comune negli uomini rispetto alle donne, ma altri non hanno rilevato particolari differenze tra i due sessi. L’incidenza della malattia di Parkinson è tra 8 e 18 per 100 000 persone-anno.
Fattori di rischio e protettivi
Molti fattori di rischio e molti fattori protettivi sono stati proposti, a volte in relazione alle teorie riguardanti i possibili meccanismi della malattia, ma nessuno è stato definitivamente individuato da prove certe; per approfondire leggi: Morbo di Parkinson: fattori di rischio e fattori di protezione
Patogenesi e anatomia patologica
I gangli basali, un gruppo di strutture cerebrali innervate dal sistema dopaminergico, sono le aree cerebrali più colpite nella malattia di Parkinson. La principale caratteristica patologica della condizione è la morte delle cellule nella substantia nigra e, più specificamente, nella parte ventrale (anteriore) della pars compacta, causando nel tempo la morte delle cellule fino al 70% del loro totale. Al taglio del tronco cerebrale, si possono notare alterazioni macroscopiche in cui la perdita neuronale si può dedurre da una riduzione della pigmentazione della melanina nella substantia nigra e nel locus coeruleus. L’istopatologia (anatomia microscopica) della substantia nigra e delle diverse regioni cerebrali, mostra una perdita neuronale e corpi di Lewy in molte delle cellule nervose rimanenti. La perdita neuronale è accompagnata da morte degli astrociti (cellule gliali a forma di stella) e l’attivazione delle microglia (un altro tipo di cellule gliali). I corpi di Lewy sono un elemento patologico chiave nella malattia di Parkinson.
Fisiopatologia
I sintomi principali della malattia di Parkinson sono il risultato di una attività molto ridotta delle cellule secernenti dopamina, causata dalla morte cellulare nella regione pars compacta della substantia nigra. Nel cervello vi sono cinque circuiti principali che collegano le aree cerebrali ai gangli basali. Questi circuiti sono noti come: circuito motorio, circuito oculomotore, circuito associativo, circuito limbico e circuito orbitofrontale, con nomi che indicano le principali aree che vengono servite da ogni circuito. Nella malattia di Parkinson, tutti i circuiti elencati possono venire influenzati e ciò spiega molti dei sintomi. Infatti, una varietà di funzioni sono controllate da questi circuiti, tra le quali quelle del movimento, dell’attenzione e dell’apprendimento. Dal punto di vista scientifico, il circuito motorio è quello che è stato studiato con maggiore attenzione.
Un particolare modello concettuale del circuito motorio e del suo coinvolgimento nella malattia è stato, a partire dal 1980, di grande influenza, anche se nel tempo sono stati sollevati alcuni dubbi che hanno portato a modificarlo. In questo modello, i gangli della base normalmente esercitano una costante influenza inibitoria su una vasta gamma di sistemi motori, impedendo loro di attivarsi nei momenti inopportuni. Quando si decide di effettuare una determinata azione, l’inibizione viene ridotta. La dopamina agisce per facilitare questo cambiamento nell’inibizione: livelli elevati di dopamina tendono a promuovere l’attività motoria, mentre bassi livelli, come avviene nella malattia, richiedono maggiori sforzi per compiere un dato movimento. Così l’effetto reale della deplezione di dopamina è il verificarsi dell’ipocinesia, una riduzione complessiva dell’uscita dei segnali motori. I farmaci che vengono usati per trattare la malattia di Parkinson, viceversa, tendono a produrre una quantità troppo elevata di dopamina, portando i sistemi motori ad attivarsi nel momento non appropriato e causando pertanto discinesia.
Morte delle cellule cerebrali
Vi sono diversi meccanismi proposti per cui le cellule cerebrali, nella malattia, vanno incontro alla morte. Uno di questi prevede che un accumulo anomalo della proteina alfa-sinucleina, legata alla ubiquitina, danneggi le cellule. Questa proteina insolubile si accumula all’interno dei neuroni formando delle inclusioni, chiamate corpi di Lewy. Secondo la stadiazione di Braak, una classificazione della malattia sulla base del quadro patologico, i corpi di Lewy prima appaiono nel bulbo olfattivo, nel midollo allungato e nel tegmento pontino, con i pazienti che risultano asintomatici. Col progredire della malattia, i corpi di Lewy si sviluppano nella substantia nigra, nelle aree del mesencefalo e prosencefalo basale e, nell’ultima fase, nella neocorteccia. Queste zone del cervello sono le aree principali della degenerazione neuronale nella malattia di Parkinson. Tuttavia, i corpi di Lewy non possono essere la causa diretta della morte delle cellule. Nei pazienti con demenza una presenza generalizzata dei corpi di Lewy è comune nelle aree corticali. Ammassi neurofibrillari e placche senili, riscontrabili caratteristicamente nella malattia di Alzheimer, non sono comuni a meno che il paziente non presenti una forma di demenza.
Altri meccanismi che portano alla morte cellulare includono la disfunzione dei sistemi lisosomiali e proteosomiali e una ridotta attività mitocondriale. L’accumulo di ferro nella substantia nigra si osserva tipicamente in combinazione con le inclusioni proteiche. Ciò può essere correlato allo stress ossidativo, all’aggregazione proteica e alla morte neuronale, ma i meccanismi che regolano questo fenomeno non sono pienamente compresi.
Cause
La maggior parte delle persone con malattia di Parkinson presenta una condizione idiopatica (che non ha una causa specifica nota). Una piccola percentuale di casi, tuttavia, può essere attribuita a fattori genetici conosciuti. Altri fattori sono stati associati con il rischio di sviluppare la malattia, ma non sono state dimostrate relazioni causali.
La malattia di Parkinson è stata tradizionalmente considerata una malattia non genetica. Tuttavia, circa il 15% degli individui con malattia di Parkinson ha un parente di primo grado con la stessa condizione. Almeno il 5% delle persone è ormai noto per avere forme della malattia che si verifica a causa di una mutazione di uno dei numerosi geni specifici.
È stato dimostrato in modo definitivo che le mutazioni in geni specifici possono essere causa della malattia. Questi geni codificano per alfa-sinucleina (SNCA), parkina (PRKN), dardarina (LRRK2), PTEN chinasi indotta putativo 1 (PINK1), DJ-1 e ATP13A2. Nella maggior parte dei casi, le persone con queste mutazioni svilupperanno la malattia di Parkinson. Con l’eccezione di LRRK2, tuttavia, rappresentano solo una piccola minoranza dei casi della malattia. I geni correlati alla condizione e maggiormente studiati sono SNCA e LRRK2. Le mutazioni nei geni tra cui SNCA, LRRK2 e glucocerebrosidasi (GBA) sono stati individuati come fattori di rischio nello sviluppo della malattia di Parkinson. Le mutazioni in GBA sono note per causare la malattia di Gaucher.
Il ruolo del gene SNCA è importante in quanto l’alfa-sinucleina alfa è il componente principale dei corpi di Lewy. Mutazioni missenso del gene (in cui un singolo nucleotide viene cambiato) e duplicazioni e triplicazioni del locus che lo contiene, sono state trovate in diversi gruppi aventi familiari affetti dalla malattia di Parkinson. Le mutazioni missenso sono rare, tuttavia, moltiplicazioni del locus SNCA rappresentano circa il 2% dei casi familiari.
Il gene LRRK2 (PARK8) codifica per una proteina chiamata dardarina. Il nome dardarina è stato coniato da una parola basca che sta per tremore, poiché questo gene è stato identificato in famiglie provenienti dall’Inghilterra e dal nord della Spagna. Le mutazioni nel LRRK2 sono la causa più comune conosciuta di malattia di Parkinson famigliare e sporadica, esse rappresentano circa il 5% degli individui con una storia familiare della malattia e il 3% dei casi sporadici. Vi sono molte differenti mutazioni descritte in LRRK2, la prova inequivocabile di causalità esiste, tuttavia, solo per un piccolo numero.
Segni e sintomi
La malattia di Parkinson colpisce prevalentemente ma non esclusivamente il movimento, producendo sintomi (più propriamente “segni”) motori e non motori, a tal proposito leggi: Morbo di Parkinson: sintomi motori e non motori, iniziali e tardivi
Diagnosi e diagnosi differenziale
La malattia di Parkinson può essere diagnosticata partendo dalla storia clinica e da un esame neurologico. Non esiste attualmente un test che identifichi chiaramente la malattia, ma scansioni tomografiche cerebrali sono a volte utilizzate per escludere patologie che potrebbero dare luogo a sintomi simili; per approfondire leggi: Diagnosi e diagnosi differenziale del morbo di Parkinson
Terapia farmacologica
Attualmente non esiste una terapia definitiva per la malattia di Parkinson. I farmaci principalmente utilizzati nel trattamento di sintomi motori sono la levodopa, gli agonisti della dopamina e gli inibitori MAO-B (Inibitore della monoamino ossidasi). Per approfondire leggi: Levodopa ed altri farmaci usati nella terapia del morbo di Parkinson
Terapia chirurgica
Attualmente la tecnica più utilizzata è la chirurgia stereotassica che permette di trattare punti in profondità nel parenchima cerebrale con precisione millimetrica, grazie all’ausilio di dispositivi radiologici. Per approfondire leggi: Terapie chirurgiche nel paziente con morbo di Parkinson
Riabilitazione
I problemi di linguaggio e di mobilità, pur se irreversibili, sono in grado di migliorare parzialmente grazie alla riabilitazione, a tal proposito leggi: Riabilitazione e fisioterapia nel paziente con morbo di Parkinson
Alimentazione e disfagia
I muscoli e i nervi che controllano la digestione possono essere influenzati dalla malattia, con conseguente costipazione e gastroparesi, una alimentazione equilibrata è consigliata e deve essere finalizzata ad evitare la perdita o il guadagno di peso; a tal proposito leggi: Alimentazione e disfagia nel paziente con morbo di Parkinson
Le cure palliative
Il ricorso alle cure palliative è spesso richiesto nelle fasi finali della malattia, quando tutte le altre strategie di trattamento sono diventate inefficaci. Lo scopo delle cure palliative è quello di ottimizzare la qualità della vita, sia per il paziente che per tutti quelli che lo circondano. Alcuni obiettivi centrali delle cure palliative sono: cure adeguate nella propria comunità, riduzione o sospensione dell’assunzione dei farmaci per ridurre gli effetti collaterali, prevenzione delle piaghe da decubito nei pazienti allettati, supporto per il paziente e per le persone a lui vicine.
Altri trattamenti
È stato dimostrato che la stimolazione magnetica transcranica migliora temporaneamente la discinesia indotta dalla levodopa. La sua utilità nel trattamento della malattia di Parkinson è un argomento di ricerca ancora aperto, anche se studi recenti non hanno dimostrato alcun effetto. Diversi principi nutritivi sono stati proposti come possibili trattamenti, ma non vi sono prove che le vitamine o gli additivi alimentari siano in grado di migliorare i sintomi. Non vi sono prove a sostegno che l’agopuntura e la pratica del Qigong o del Tai chi abbiano alcun effetto sul decorso della malattia o sulla presentazione dei sintomi. Tuttavia, sono necessarie ulteriori ricerche sul Tai chi quando viene utilizzato al fine di migliorare la capacità di equilibrio. La mucuna pruriens e la vicia faba sono fonti naturali di levodopa e sono assunte da molte persone con la malattia. Sebbene in alcuni studi clinici si sia dimostrata una certa efficacia, la loro ingestione non è esente da rischi. Sono state, infatti, riportate delle reazioni avverse letali, come la sindrome neurolettica maligna.
Prognosi
La malattia di Parkinson progredisce sempre con il tempo. La scala di Hoehn e Yahr, che definisce cinque stadi di progressione, è comunemente usata per stimare l’avanzamento della malattia (vedi prossimo paragrafo).
I sintomi motori, se non trattati, progrediscono in modo aggressivo nelle fasi iniziali della malattia e più lentamente in seguito. Se non trattati, si può prevedere che i pazienti vadano incontro ad una perdita della deambulazione indipendente in media dopo otto anni e siano costretti a letto dopo dieci anni. Tuttavia, è raro, al giorno d’oggi, trovare persone che non ricevano un trattamento. I farmaci hanno migliorato la prognosi dei sintomi motori, mentre allo stesso tempo vi è una nuova fonte di disabilità a causa degli effetti indesiderati della levodopa, che si verificano dopo anni di utilizzo. Per le persone che assumono levodopa, il tempo di progressione dei sintomi – dall’esordio ad una fase di completa non autosufficienza – può essere di oltre i 15 anni. Tuttavia, è difficile prevedere il decorso della malattia per un dato paziente. L’età è il miglior predittivo della progressione della malattia. Il deficit cognitivo è più frequente in coloro che hanno più di 70 anni di età all’insorgenza dei sintomi.
Dal momento che le attuali terapie sono in grado di migliorare i sintomi motori, la disabilità è principalmente collegata alle caratteristiche non-motorie della malattia. Tuttavia, il rapporto tra la progressione della malattia e la disabilità non è lineare. Inizialmente la disabilità è legata ai sintomi motori, con l’avanzare della malattia essa risulterà più correlata con i sintomi che non rispondono adeguatamente al trattamento farmacologico, come ad esempio la deglutizione, la difficoltà di parola e di equilibrio. Inoltre vi è da tener conto delle complicanze relative al movimento, che appaiono nel 50% degli individui dopo 5 anni di utilizzo di levodopa. Infine, dopo dieci anni, la maggior parte dei pazienti sperimenta dei disturbi autonomici (ovvero del sistema nervoso autonomo), disturbi del sonno, alterazioni dell’umore e declino cognitivo. Tutti questi sintomi, in particolare il declino cognitivo, aumentano notevolmente la disabilità.
Scala di Hoehn e Yahr ed aspettativa di vita
La scala di Hoehn e Yahr è comunemente usata per descrivere i sintomi della progressione della malattia di Parkinson. L’aspettativa di vita del paziente con Parkinson è ridotta rispetto alla popolazione sana, a tale proposito leggi anche: Scala di Hoehn e Yahr e aspettativa di vita nel morbo di Parkinson
Conseguenze psicologiche
Nonostante gli enormi progressi fatti nel campo della ricerca e nelle terapie che sono in grado di rallentare la progressione della malattia, la diagnosi di Parkinson rimane attualmente una notizia estremamente shockante per i pazienti, che cambia completamente la visione sul resto della loro vita. Soprattutto quando i segni motori diventano invalidanti, il soggetto non si sente più autosufficiente, in alcuni casi deve abbandonare il lavoro e può succedere che venga lasciato dal partner. Il sentirsi un “peso” per la società e per i famigliari, unita alla vergogna per la malattia, può determinare una situazione di progressivo isolamento sociale. Non di rado il paziente può soffrire di depressione e di ideazioni suicidarie. La terapia della malattia di Parkinson deve quindi tener conto di questo fattore ed includere un eventuale intervento farmacologico psichiatrico con supporto di psicoterapia.
Costi per la società
La malattia di Parkinson costituisce un costo sanitario e sociale molto elevato a livello globale, ma è difficile determinare dati precisi sia per problemi metodologici nella stima che per le differenze esistenti tra i vari paesi. Il costo annuale nel Regno Unito è stimato tra i 449 milioni e i 3,3 miliardi di sterline, mentre il costo annuale per paziente negli Stati Uniti si aggira intorno ai $ 10 000, per un totale di circa 23 miliardi di dollari. Nonostante non esista alcuna analisi dell’impatto economico diretto ed indiretto della malattia in Italia, si può stimare una spesa annuale totale che oscilla tra i 2 ed i 3 miliardi di euro. La quota maggiore del costo diretto viene dai ricoveri e dai soggiorni nelle case di cura, mentre la parte proveniente dai farmaci è sostanzialmente inferiore. Oltre ai costi diretti, hanno un peso importante i costi indiretti, che sono elevati per via della riduzione della produttività (il malato ad un certo punto della progressione della malattia potrebbe essere costretto ad abbandora il lavoro a causa dei suoi sintomi e segni) e degli oneri che ricadono su chi assiste i pazienti. Oltre ai costi economici, la malattia riduce enormemente la qualità della vita di coloro che ne soffrono e di chi li assiste, non solo a livello di salute del corpo, ma anche a livello psicologico.
Leggi anche:
- Differenza tra morbo di Alzheimer, demenza senile, vascolare e reversibile
- Differenza tra morbo di Alzheimer e morbo di Parkinson: sintomi comuni e diversi
- Demenza senile: cause, sintomi, decorso e cure
- Sclerosi laterale amiotrofica (SLA): cause, sintomi, diagnosi e prognosi
- Sclerosi multipla: cause, sintomi, diagnosi e prognosi
- Differenze tra sclerosi laterale amiotrofica e sclerosi multipla
- Cervelletto: anatomia esterna ed interna
- Cervelletto: le lesioni cerebellari più comuni
- Le funzioni del cervelletto: apprendimento e correzione dei movimenti del corpo
- Atrofia muscolare progressiva: cause, sintomi, cura, aspettativa di vita
- Differenze tra atrofia muscolare progressiva e sclerosi laterale amiotrofica
- Epilessia infantile ed in adulti: cause, sintomi, diagnosi, cosa fare
- Epilessia: come riconoscere un attacco e soccorrere un ammalato
- Differenza tra epilessia e convulsioni
- Differenza tra epilessia e sincope
- Differenza tra epilessia parziale e generalizzata
- Epilessia: riconoscere in tempo l’arrivo di una crisi e come comportarsi
- Epilessia infantile: come comportarsi col proprio figlio?
- Si può morire di epilessia?
- Tumore al cervello: operato mentre suona la chitarra e canta Yesterday
- Sistema nervoso simpatico: funzioni
- Sistema nervoso parasimpatico: funzioni
- Com’è fatto il cervello, a che serve e come funziona la memoria?
- Cervello maschile e femminile: quali sono le differenze?
- Sistema nervoso autonomo simpatico e parasimpatico: anatomia e funzioni
- Ipotalamo: anatomia, struttura e funzioni
- Differenze tra ipotalamo, ipofisi, neuroipofisi e adenoipofisi
- Patologie di ipotalamo e ipofisi
- Ipofisi (ghiandola pituitaria): anatomia, funzioni e ormoni secreti
- Asse ipotalamo-ipofisario: fisiologia e ormoni rilasciati
- Disturbi cognitivi congeniti e acquisiti: ritardo mentale e demenza
- Riabilitazione cognitiva: Token Economy e tecniche per incrementare comportamenti adeguati
- Riabilitazione cognitiva: tecniche per incrementare comportamenti adeguati non presenti
- Terapia occupazionale: caratteristiche, attività, obiettivi, dispositivi
- Riabilitazione cognitiva: tecniche per incrementare attenzione, memoria, linguaggio
Dott. Emilio Alessio Loiacono
Medico Chirurgo
Direttore dello Staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o unisciti al nostro gruppo Facebook o ancora seguici su Twitter, su Instagram, su LinkedIn, su Tumblr e su Pinterest, grazie!
Condividi questo articolo:
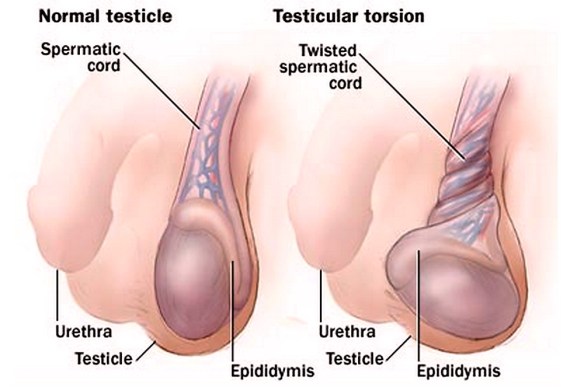 Con “rotazione” si indica il movimento che compie un corpo che segue una traiettoria circolare. Una figura posta su un Continua a leggere →
Con “rotazione” si indica il movimento che compie un corpo che segue una traiettoria circolare. Una figura posta su un Continua a leggere →
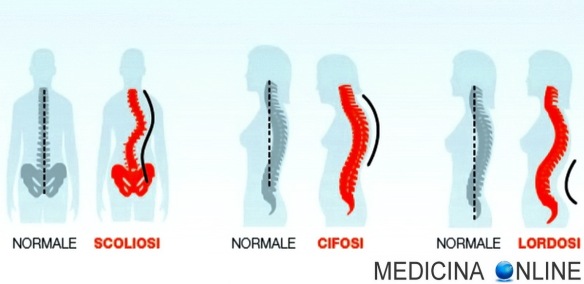 La scoliosi è una forma di dismorfismo che – alterando le normali curvature della schiena – implica una complessa curvatura laterale e di rotazione della colonna vertebrale, la quale porta a deformazione della schiena ed alterazioni della componente muscolare dal momento che la colonna scoliotica contiene muscoli atrofici ad un lato e muscoli ipertrofici dall’altro. L’altezza dei dischi intervertebrali e delle vertebre diminuisce dal lato concavo della flessione: il corpo vertebrale diventa cuneiforme.
La scoliosi è una forma di dismorfismo che – alterando le normali curvature della schiena – implica una complessa curvatura laterale e di rotazione della colonna vertebrale, la quale porta a deformazione della schiena ed alterazioni della componente muscolare dal momento che la colonna scoliotica contiene muscoli atrofici ad un lato e muscoli ipertrofici dall’altro. L’altezza dei dischi intervertebrali e delle vertebre diminuisce dal lato concavo della flessione: il corpo vertebrale diventa cuneiforme. Lo strabismo rotuleo, conosciuto anche come disallineamento dell’apparato estensore o dolore rotuleo, è una patologia del ginocchio che dipende da un disallineamento della rotula rispetto all’asse femorale che tende a deviare verso l’interno o verso l’esterno. Questo malfunzionamento della rotula provoca una pressione della rotula sul femore e uno stiramento dei legamenti che provocano dolore soprattutto quando si salgono o si scendono le scale oppure quando si resta a lungo fermi in una stessa posizione (seduti, accovacciati, inginocchiati).
Lo strabismo rotuleo, conosciuto anche come disallineamento dell’apparato estensore o dolore rotuleo, è una patologia del ginocchio che dipende da un disallineamento della rotula rispetto all’asse femorale che tende a deviare verso l’interno o verso l’esterno. Questo malfunzionamento della rotula provoca una pressione della rotula sul femore e uno stiramento dei legamenti che provocano dolore soprattutto quando si salgono o si scendono le scale oppure quando si resta a lungo fermi in una stessa posizione (seduti, accovacciati, inginocchiati).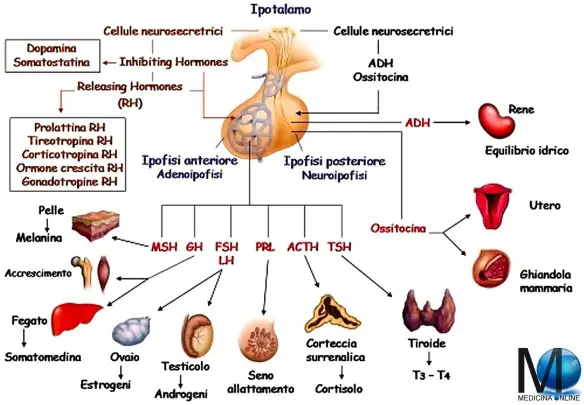 L’ipotalamo è una struttura del sistema nervoso centrale situata nella zona centrale interna ai due emisferi cerebrali. Costituisce la parte ventrale del diencefalo e comprende numerosi nuclei che attivano, controllano e integrano i meccanismi autonomici periferici, l’attività endocrina e molte funzioni somatiche quali la termoregolazione, il sonno, il bilancio idro-salino e l’assunzione del cibo. L’ipotalamo controlla molte attività connesse all’omeostasi e controlla anche l’ipofisi.
L’ipotalamo è una struttura del sistema nervoso centrale situata nella zona centrale interna ai due emisferi cerebrali. Costituisce la parte ventrale del diencefalo e comprende numerosi nuclei che attivano, controllano e integrano i meccanismi autonomici periferici, l’attività endocrina e molte funzioni somatiche quali la termoregolazione, il sonno, il bilancio idro-salino e l’assunzione del cibo. L’ipotalamo controlla molte attività connesse all’omeostasi e controlla anche l’ipofisi. Il diabete insipido (DIN) è una malattia rara che – a causa del nome – viene spesso confusa con il diabete “più famoso”, cioè il diabete mellito. Il diabete mellito (di tipo 1 e 2) ed il diabete insipido, hanno effettivamente dei tratti in comune; entrambi sono caratterizzati da:
Il diabete insipido (DIN) è una malattia rara che – a causa del nome – viene spesso confusa con il diabete “più famoso”, cioè il diabete mellito. Il diabete mellito (di tipo 1 e 2) ed il diabete insipido, hanno effettivamente dei tratti in comune; entrambi sono caratterizzati da: La malattia di Parkinson (in passato denominata “morbo di Parkinson“; anche chiamata Parkinson, parkinsonismo idiopatico o parkinsonismo primario; in inglese denominata “Parkinson disease” o “primary parkinsonism” o “hypokinetic rigid syndrome” o “paralysis agitans” o “shaking palsy”) è una malattia neurodegenerativa extrapiramidale caratterizzata da rigidità muscolare che si manifesta con resistenza ai movimenti passivi; tremore che insorge durante lo stato di riposo e che può aumentare in caso di stato di ansia; bradicinesia che provoca difficoltà a iniziare e terminare i movimenti.
La malattia di Parkinson (in passato denominata “morbo di Parkinson“; anche chiamata Parkinson, parkinsonismo idiopatico o parkinsonismo primario; in inglese denominata “Parkinson disease” o “primary parkinsonism” o “hypokinetic rigid syndrome” o “paralysis agitans” o “shaking palsy”) è una malattia neurodegenerativa extrapiramidale caratterizzata da rigidità muscolare che si manifesta con resistenza ai movimenti passivi; tremore che insorge durante lo stato di riposo e che può aumentare in caso di stato di ansia; bradicinesia che provoca difficoltà a iniziare e terminare i movimenti.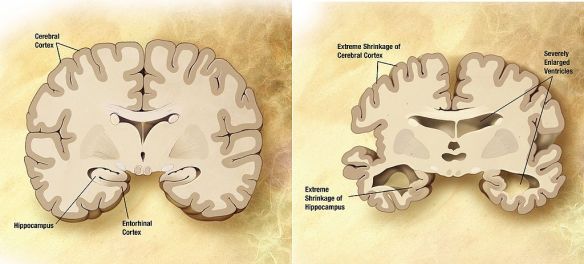 Il morbo di Alzheimer, detta anche malattia di Alzheimer o semplicemente Alzheimer, è la forma più comune di demenza degenerativa progressivamente invalidante con esordio prevalentemente in età presenile (oltre i 65 anni, ma può manifestarsi anche in epoca precedente). Si stima che circa il 60-70% dei casi di demenza sia dovuta a tale condizione. Il sintomo precoce più frequente è la difficoltà nel ricordare eventi recenti. Con l’avanzare dell’età possiamo avere sintomi come: afasia, disorientamento, cambiamenti repentini di umore, depressione, incapacità di prendersi cura di sé, problemi nel comportamento. Ciò porta il soggetto inevitabilmente a isolarsi nei confronti della società e della famiglia. A poco a poco, le capacità mentali basilari vengono perse. Anche se la velocità di progressione può variare, l’aspettativa media di vita dopo la diagnosi è dai tre ai nove anni. La patologia è stata descritta per la prima volta nel 1906, dallo psichiatra e neuropatologo tedesco Alois Alzheimer. Nel 2006 vi erano 26,6 milioni di malati in tutto il mondo e si stima che ne sarà affetta 1 persona su 85 a livello mondiale entro il 2050.
Il morbo di Alzheimer, detta anche malattia di Alzheimer o semplicemente Alzheimer, è la forma più comune di demenza degenerativa progressivamente invalidante con esordio prevalentemente in età presenile (oltre i 65 anni, ma può manifestarsi anche in epoca precedente). Si stima che circa il 60-70% dei casi di demenza sia dovuta a tale condizione. Il sintomo precoce più frequente è la difficoltà nel ricordare eventi recenti. Con l’avanzare dell’età possiamo avere sintomi come: afasia, disorientamento, cambiamenti repentini di umore, depressione, incapacità di prendersi cura di sé, problemi nel comportamento. Ciò porta il soggetto inevitabilmente a isolarsi nei confronti della società e della famiglia. A poco a poco, le capacità mentali basilari vengono perse. Anche se la velocità di progressione può variare, l’aspettativa media di vita dopo la diagnosi è dai tre ai nove anni. La patologia è stata descritta per la prima volta nel 1906, dallo psichiatra e neuropatologo tedesco Alois Alzheimer. Nel 2006 vi erano 26,6 milioni di malati in tutto il mondo e si stima che ne sarà affetta 1 persona su 85 a livello mondiale entro il 2050.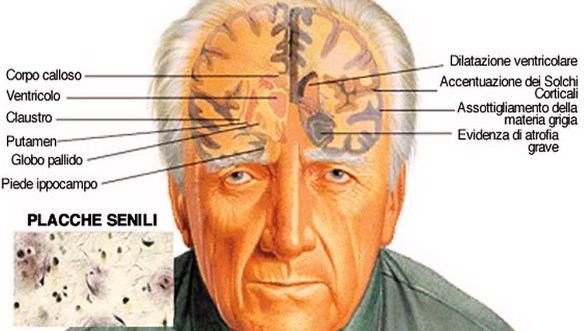 Con “demenza senile” si indica una patologia neurodegenerativa dell’encefalo, tipica dell’età avanzata e caratterizzata da una riduzione graduale ed irreversibile delle facoltà cognitive di una persona. La demenza senile rientra nella più ampia categoria delle demenze le quali sono patologie neurodegenerative dell’encefalo che possono colpire persone anziane ma non solo, e che determinano un progressivo declino delle facoltà cognitive di un individuo. E’ importante ricordare che non tutte le demenze sono irreversibili, sono reversibili ad esempio alcune forme di demenza da idrocefalo normoteso o da cause metaboliche. Un tempo “demenza senile” era sinonimo di malattia di Alzheimer. Successivamente, con la scoperta di altre forme di demenza tipiche dell’età avanzata, e con l’individuazione di una forma di Alzheimer giovanile, la dicitura demenza senile ha assunto un significato leggermente diverso, riportato nella definizione iniziale. Pur non essendo la demenza una causa diretta di morte, nella maggior parte dei casi sono i disturbi della deglutizione ad essa associata ad essere fatali per l’anziano. Tali disturbi, infatti, concorrono allo sviluppo di polmoniti da inalazione (o da aspirazione).
Con “demenza senile” si indica una patologia neurodegenerativa dell’encefalo, tipica dell’età avanzata e caratterizzata da una riduzione graduale ed irreversibile delle facoltà cognitive di una persona. La demenza senile rientra nella più ampia categoria delle demenze le quali sono patologie neurodegenerative dell’encefalo che possono colpire persone anziane ma non solo, e che determinano un progressivo declino delle facoltà cognitive di un individuo. E’ importante ricordare che non tutte le demenze sono irreversibili, sono reversibili ad esempio alcune forme di demenza da idrocefalo normoteso o da cause metaboliche. Un tempo “demenza senile” era sinonimo di malattia di Alzheimer. Successivamente, con la scoperta di altre forme di demenza tipiche dell’età avanzata, e con l’individuazione di una forma di Alzheimer giovanile, la dicitura demenza senile ha assunto un significato leggermente diverso, riportato nella definizione iniziale. Pur non essendo la demenza una causa diretta di morte, nella maggior parte dei casi sono i disturbi della deglutizione ad essa associata ad essere fatali per l’anziano. Tali disturbi, infatti, concorrono allo sviluppo di polmoniti da inalazione (o da aspirazione).