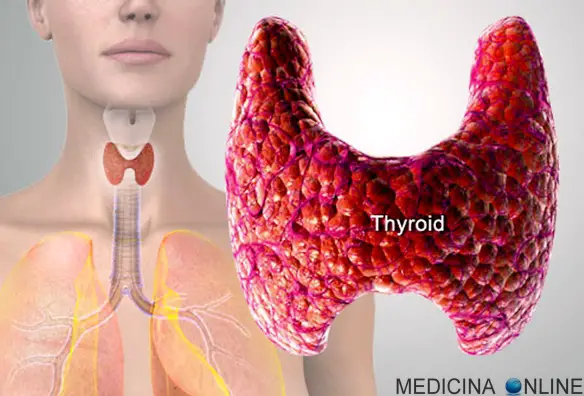
 Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
Il carcinoma della tiroide viene considerato una neoplasia rara in quanto costituisce il 2% di tutti i tumori. Si può manifestare a tutte le età, con massima incidenza tra i 25 e i 60 anni e con una maggiore prevalenza nel sesso femminile. Tali neoplasie sono invece molto rare nei bambini. La sopravvivenza è molto elevata, superando il 90% a 5 anni nelle forme differenziate.
Leggi anche:
- Tiroide: anatomia, funzioni e patologie in sintesi
- Paratiroidi: anatomia e funzioni in sintesi
- Differenza tra tiroide e paratiroide
- Nodulo Tiroideo: sintomi e cure
- Paratiroidectomia: intervento, convalescenza e conseguenze
I tumori della tiroide originano nella maggior parte dei casi dalle cellule follicolari (che compongono il tessuto tiroideo insieme alle cellule parafollicolari o C) e si distinguono in:
- carcinoma papillare (PTC): è la forma più frequente di carcinoma differenziato della tiroide (circa il 75%). Presenta una crescita lenta e può dare luogo a metastasi che interessano i linfonodi del collo. In alcuni pazienti il tumore è multifocale e può interessare entrambi i lobi della tiroide. Secondo il Centro medico dell’Università del Maryland, il carcinoma papillare della tiroide ha una prognosi molto favorevole, con un tasso di sopravvivenza di oltre il 95% dei pazienti ad almeno 10 anni dalla diagnosi (UMM).;
- carcinoma follicolare (FTC): rappresenta circa il 15% dei carcinomi differenziati della tiroide e può dare luogo a metastasi a distanza. Colpisce per lo più persone di età superiore ai 50 anni. – carcinoma anaplastico: è un tipo di tumore raro (<1% dei tumori della tiroide) ma particolarmente aggressivo e di difficile gestione, in quanto dà metastasi a distanza molto precocemente;
- carcinoma midollare (MTC): origina dalle cellule parafollicolari (o cellule C) e si caratterizza per la presenza di elevati livelli circolanti di calcitonina. Tale tumore può avere un andamento familiare e può essere la manifestazione di sindromi genetiche quali la sindrome neoplastica multiple tipo 2 (MEN2).
Quali sono i fattori di rischio per il carcinoma della tiroide?
Un fattore di rischio accertato per il carcinoma differenziato della tiroide è l’esposizione a radiazioni. Il tumore della tiroide è infatti più comune in persone sottoposte a radioterapia sul collo per altre neoplasie o esposte a ricadute di materiale radioattivo come accaduto dopo l’esplosione della centrale nucleare di Cernobyl.
Come si effettua la diagnosi di carcinoma della tiroide?
Il sintomo più comune del tumore della tiroide è il riscontro alla palpazione o all’osservazione di un nodulo tiroideo. Solo il 3-5% di tutti i noduli della tiroide sono però forme tumorali maligne.
In alcuni casi, in presenza di un carcinoma tiroideo possono essere riscontrati in sede laterocervicale masse linfonodali anche di dimensioni e consistenza importanti. Una volta accertata la presenza di noduli tiroidei, generalmente si effettuano ulteriori approfondimenti diagnostici, in particolare:
- valutazione della funzione della ghiandola: si effettua misurando i livelli circolanti di TSH, FT4 ed FT3 come pure gli anticorpi anti Tireoglobulina e anti Tireoperossidasi. Di nessuna utilità è invece il dosaggio della tireoglobulina.
- ecografia tiroidea: è l’esame radiologico di prima scelta. Di semplice esecuzione, consente di valutare sia le dimensioni sia le caratteristiche ecostrutturali dei noduli. Costituiscono segni di sospetto ecografico la presenza di microcalcificazioni, di vascolarizzazione intra-nodulare e l’irregolarità dei margini del nodulo.
- agoaspirato con ago sottile: è indicato in presenza di un nodulo singolo o di un nodulo sospetto nell’ambito di un gozzo multinodulare. Il campione di cellule così raccolto viene sottoposto ad esame citologico consentendo di distinguere, in un buon numero di casi, un nodulo benigno da un nodulo maligno.
- scintigrafia tiroidea: fornisce importanti informazioni sul comportamento funzionale della tiroide e dei noduli tiroidei, in particolare nei casi in cui il nodulo all’esame citologico venga considerato dubbio. E’ un esame molto semplice, basato sulla somministrazione per via endovenosa di un tracciante radioattivo (99mTc-pertecnetato) che viene elettivamente captato dalle cellule tiroidee
- misurazione dei livelli di calcitonina, sostanza che rappresenta il marker specifico del carcinoma midollare della tiroide. In caso di livelli dubbi di calcitonina, può essere indicato un test di stimolo con calcio o con penta gastrina, in regime di Day Hospital.
- test genetici: l’esecuzione può essere indicata nel caso di un carcinoma midollare della tiroide, dal momento che questo tipo di tumore può avere un andamento familiare ed essere parte di sindromi genetiche quali la sindrome neoplastica endocrina tipo 2 (MEN2).
- TAC, RMN e PET/CT: consentono la stadiazione del tumore identificando le possibili sedi di diffusione della malattia.
Quali sono i trattamenti per il carcinoma della tiroide?
Esistono vari tipi di trattamenti, che si possono dividere in chirurgici e non chirurgici.
- Trattamenti chirurgici. In tutti i casi di carcinoma della tiroide, la chirurgia rappresenta la prima opzione terapeutica. Generalmente, in presenza di un tumore della tiroide viene eseguita di routine la tiroidectomia totale. La linfadenectomia del compartimento centrale è sempre eseguita in presenza di una carcinoma midollare, mentre in presenza di un carcinoma differenziato (follicolare o papillare) è eseguita solo se intraoperatoriamente si evidenziano linfonodi sospetti per metastasi o di dimensioni aumentate. Particolare attenzione viene dedicata anche al risultato estetico, grazie all’utilizzo di suture intradermiche con materiale riassorbibile e alla raccomandazione di massaggi postoperatori della ferita con creme dedicate per ridurre l’incidenza di cicatrici ipertrofiche.
- Trattamenti non chirurgici. Dopo l’intervento di tiroidectomia è generalmente indicata l’ablazione del residuo tiroideo mediante iodio-131. Lo scopo della Terapia Radiometabolica con iodio 131 è distruggere il tessuto tiroideo normale che quasi sempre residua anche dopo una tiroidectomia totale ed eliminare eventuali microfocolai neoplastici presenti all’interno dei residui tiroidei o in altre sedi. Un secondo obiettivo di questa terapia è rendere più efficace il follow-up mediante il dosaggio della tireoglobulina sierica e l’eventuale esecuzione della scintigrafia total-body con iodio 131. La terapia radiometabolica può essere eseguita solamente in strutture autorizzate all’impiego terapeutico dello iodio 131 e deve essere eseguita in regime di “ricovero protetto”, in particolari stanze dedicate alla Medicina Nucleare.
- La terapia radiante e la chemioterapia sono infine indicate nel caso di tumori altamente aggressivi e inoperabili o in quelli caratterizzati da de-differenziazione.
Leggi anche:
- Tiroide: dove si trova, com’è fatta e quali funzioni svolge?
- Tiroidectomia: cosa mi succederà prima, durante e dopo l’intervento chirurgico
- Ipoparatiroidismo e ipocalcemia post chirurgici ed autoimmuni: sintomi e cure
- Tiroidectomia: cosa cambierà nella mia vita dopo l’intervento?
- Tiroide e obesità: qual è il vero legame?
Cosa succede dopo la fine delle terapie?
Il follow up è differenziato a seconda del tipo di carcinoma della tirodie che è stato trattato.
Carcinoma differenziato della tiroide: i pazienti, trattati con ormone tiroideo (L-Tiroxina) ad un dosaggio tale da mantenere ridotti livelli di TSH, vengono periodicamente sottoposti ad ecografia del collo e alla determinazione dei livelli circolanti di TSH, FT4, FT3, anticorpi anti tireoglobulina e tireoglobulina (che costituisce un buon marker di malattia nel paziente tiroidectomizzato). In casi selezionati anche può essere indicato valutare la risposta della tireoglobulina dopo stimolo con TSH ricombinante umano o procedere ad una Scintigrafia totale corporea con I131.
Carcinoma midollare della tiroide: dopo l’intervento i pazienti effettuano una terapia con ormone tiroideo (L-Tiroxina) al fine di ovviare all’ipotiroidismo conseguente alla rimozione della tiroide, e vengono periodicamente rivalutati previo dosaggio di TSH, FT4, FT3 e calcitonina.
Prognosi dei carcinomi della tiroide
Circa l’80% dei pazienti con carcinoma della tiroide ben differenziato (DTC) può essere curato definitivamente con un trattamento iniziale ed il 95-97% di questi sono ancora vivi dopo 30 anni di follow-up (De Groot 1990). Nonostante questa buona prognosi, alcuni pazienti presentano un alto rischio di recidiva e di morte; questi pazienti potrebbero essere identificati al momento della diagnosi usando fattori prognostici ben stabiliti che possono essere suddivisi in personali, istopatologici, biologici, molecolari e fattori relativi al trattamento.
- L’età alla diagnosi è uno dei fattori prognostici indipendenti sia per PTC, sia per FTC. L’età avanzata alla diagnosi rappresenta un fattore prognostico negativo sia per recidiva, che per mortalità. Il significato prognostico dell’età persiste quando la percentuale delle morti totali è corretta per la mortalità su una popolazione controllo di uguale sesso, età ed anno di nascita quando sono considerate solo le morti tumore-correlate. Il rischio di recidiva e morte aumenta proporzionalmente con l’età, particolarmente dopo i 40 anni, i 45, i 50 anni o 60 anni; a secondo delle diverse caratteristiche. Sebbene non sia ancora chiaro perché hanno una prognosi peggiore, i più anziani hanno più spesso tumori localmente invasivi alla presentazione, una più alta incidenza di metastasi a distanza alla diagnosi e più frequentemente varianti istologiche aggressive. I tumori della tiroide tendono ad essere presenti meno nei pazienti anziani e allo stesso tempo sono meno differenziati, con una captazione di I-131 sensibilmente inferiore nei pazienti più giovani e, quindi, una minore efficacia della terapia con I-131. Di contro, bambini e adolescenti nonostante frequentemente presentino una patologia estesa localmente alla diagnosi, hanno un’eccellente prognosi a lungo termine.
- Il sesso maschile è un fattore di rischio secondo alcuni autori, ma non per altri. Mentre è di solito un fattore prognostico negativo nelle analisi univariate, perde il suo valore prognostico nelle analisi multivariate. Se il sesso maschile sia veramente un fattore prognostico negativo non è stato ancora risolto.
- Tipi e varianti istologiche. La prognosi del PTC è migliore rispetto al FTC. La prognosi meno favorevole del FTC è strettamente correlata all’età avanzata dei pazienti e all’estensione del tumore al momento della diagnosi, piuttosto che all’istologia. La percentuale di sopravvivenza dei pazienti con PTC ed FTC è simile tra pazienti coetanei e stesso stadio di malattia. Inoltre, nell’ambito di queste due entità istologiche, la prognosi può differire per le loro differenti varianti (Rosai 1992). Nel PTC la variante a cellule alte, la variante a cellule colonnari e la variante ossifila hanno una prognosi peggiore. Viceversa, una buona prognosi si è osservata quando il tumore è ben capsulato e in caso di variante follicolare, sebbene alcune di queste siano più aggressive. Una prognosi intermedia è stata dimostrata con la variante sclerotica diffusa. Mentre il FTC minimamente invasivo mostra una buona prognosi, il FTC largamente invasivo ha una prognosi meno favorevole (Rosai 1992). Un’invasione vascolare avanzata rappresenta un fattore prognostico negativo (Lang 1986), mentre il grado di invasione della capsula ha un limitato valore prognostico (Brennan 1991). Alcune varianti FTC, come il carcinoma a cellule di Huerthle, gli istotipi scarsamenti differenziati e insulare, sono stati frequentemente associati con una prognosi sfavorevole (Akslen 1991; DeGroot 1995; Sakamoto 1983; Tubiana 1985). È interessante notare che il grado di invasione e il grado di differenziazione non sono correlati tra loro, cossichè entrambi i parametri devono essere presi in considerazione da un punto di vista prognostico. Quando accumuli microscopici di cellule indifferenziate sono ritrovate all’interno di un carcinoma tiroideo differenziato, il tumore deve essere considerato e trattato come carcinoma anaplastico.
- Il grado di differenziazione cellulare è di considerevole significato prognostico sia nel carcinoma papillifero, sia nel carcinoma follicolare. Comunque, non esiste un consenso generale nella definizione di ben moderato e scarsamente differenziato, all’interno del gruppo dei carcinomi tiroidei differenziati. Il grado del tumore, in accordo con la classificazione di Broder, che si basa sulle caratteristiche del nucleo del citoplasma e sul numero di figure mitotiche, era un fattore prognostico significativo sia nell’analisi uni variata, sia in quella multivariata per il carcinoma tiroideo papillifero. Il contenuto nucleare di DNA è considerato uno dei migliori indicatori prognostici di malignità in una grande varietà di tumori umani. Nel DTC uno studio riportava che l’aneuploidia del DNA era un fattore avverso nell’analisi uni variata, ma non era un fattore prognostico indipendente nell’analisi multivariata (Joensuu 1986). Nei casi della Mayo Clinic un contenuto anomalo di DNA era associato con una più alta mortalità per tumore, almeno nei tumori papilliferi ad alto rischio (Hay 1990). L’importanza di questo parametro non è ben stabilita per il carcinoma follicolare.
- La dimensione del tumore primitivo può variare da meno di 1 cm di diametro (molto frequente oggi giorno) a notevoli dimensioni. Quando sono unifocali e con linfonodi negativi, i tumori inferiori a 1 cm, i cosiddetti “microcarcinomi” hanno una prognosi eccellente sia in termine di sopravvivenza, sia di sopravvivenza libera da recidiva (Baudin,1998; Hay,1992). C’è un graduale aumento nel rischio di recidiva e mortalità tumore specifica con l’aumento delle dimensioni del tumore primitivo (Akslen,1991; Cady1988 ; DeGroot 1995; Hay 1990; Hay 1987; Mazzaferri 1994; Mazzaferri,1998). La dimensione del tumore è un significativo fattore di rischio nelle analisi multivariate. Sembra essere più predittivo nei tumori papilliferi che nei tumori follicolari, nei quali il grado di differenziazione e la diffusione dell’invasione prevalgono sulla dimensione del tumore (Brennan 1991; Emerick 1993; Lang 1986; Rosai 1992; Sakamoto 1983; Shaha 1995; Tubiana 1985).
- Il carcinoma tiroideo papillifero è multifocale in circa il 50% dei casi (dal 20 all’80%) relativamente al numero di sezioni patologiche analizzate (DeGroot 1990; Hay 1990; Mazzaferri 1994; Mortensen 1955). Anche se esistono divergenze di opinioni in merito, il FTC è di solito unifocale. I PTC multifocali sono più frequentemente accompagnati da metastasi linfonodali (Baudin 1998; Katoh 1992) e presentano più frequentemente un’evidenza di malattia locale persistente, recidive regionali e metastasi a distanza. Dati controversi sono stati riportati relativamente alla relazione tra multifocalità e mortalità. A questo riguardo è utile notare che la mutifocalità in un lobo è associata con una più alta probabilità di interessamento dell’altro lobo. Ciò almeno in parte spiega perchè le recidive e le morti tumore-correlate sono meno frequenti con la tiroidectomia totale che con le procedure chirurgiche meno radicali (Baudin 1998) .
- L’estensione del tumore oltre la capsula tiroidea è un fattore predittore indipendente di una prognosi peggiore sia in PTC che in FTC. È stato osservato nel 5-10% di PTC e nel 3-5% di FTC, ed è associato con una più alta percentuale di recidive locali, metastasi a distanza e morte tumore correlata (deGroot 1990; Hay 1990; Hay 1993; Mazzaferri 1994; Simpson 1987; Yamashita 1997). Comunque, dovrebbe essere fatta una distinzione tra invasione microscopica della capsula tiroidea e invasione macroscopica con coinvolgimento di altri organi del collo. In quest’ultimo caso la prognosi è peggiore, specialmente a causa della difficoltà di arginare la malattia locale (Hu A et al,2007).
- Le metastasi linfonodali sono frequenti nei PTC (30%-60%), ma non così frequenti negli FTC (15%-20%) (Grebe 1996). Sono molto più comuni nei bambini, verificandosi in oltre l’80% con PTC. I linfonodi locali possono essere coinvolti anche nel caso di microcarcinoma papillifero (Baudin 1998). Molti autori hanno dimostrato che le metastasi ai linfonodi regionali sono associate ad una più alta percentuale di recidiva di tumore e mortalità tumore specifica (Akslen 1991; DeGroot 1990; Mazzaferri 1994; Tubiana 1985), mentre altri non hanno trovato significative differenze nella sopravvivenza (Hay 1990; Hay 1993). Il coinvolgimento linfonodale è associato ad un outcome significativamente peggiore anche in assenza di invasione extra tiroidea. Nella casistica dell’Ohio State University, le metastasi ai linfonodi cervicali bilaterali e mediastinici erano un fattore prognostico indipendente predittivo di recidiva tumorale e mortalità cancro correlata (Mazzaferri 1994). All’istituto Gustave-Roussy le metastasi linfonodali palpabili rappresentavano un fattore di rischio indipendente per morte tumore correlata (Tubiana 1985). E’ stata dimostrata una mortalità del 3.6% nei pazienti con metastasi linfonodali, tale indice è estremamente alto per una patologia che è ritenuta avere una prognosi eccellente (Pacini 1994). Oltre che la presenza o assenza di metastasi linfonodali, il sito, la dimensione, il numero e l’estensione del tumore oltre la capsula tiroidea (Yamashita 1997) hanno probabilmente un impatto sulla prognosi, sebbene non siano stati presi in considerazione ampie casistiche.
- Le metastasi a distanza al momento della diagnosi rappresentano il fattore prognostico peggiore nei pazienti sia con carcinoma tiroideo papillifero sia follicolare. La mortalità tumore specifica nei pazienti con metastasi a distanza varia dal 36% al 47% a cinque anni; dipende dalla durata del follow-up e aumenta fino al 70% a 15 anni (Hoie 1988; Pacini 1994; Schlumberger 1996). L’analisi univariata ha dimostrato che nel caso di metastasi a distanza, l’età più giovane, il tipo istologico ben differenziato, la localizzazione nel polmone piuttosto che nell’osso, la presenza di piccole lesioni e la captazione di I-131 sono fattori associati ad una prognosi migliore. L’ analisi multivariata ha, comunque, dimostrato che la malattia metastatica estesa ha un impatto prognostico peggiore della localizzazione anatomica (polmone o osso). Il migliore outcome è presente nei pazienti più giovani con metastasi micronodulari responsive alla radio-iodioterapia non visibili alla radiografia standard.
- Un peggiore outcome è associato alla perdita di differenziazione dei geni di espressione tiroide specifici, quali il recettore per il TSH, il trasportatore Na+/I-, la tireoglobulina (Tg) e i geni tireoperossidasi, come dimostrato dalla ridotta espressione di questi geni nei tumori scarsamente differenziati e dalla loro assenza nei tumori indifferenziati (Arturi 1998; Elisei 1994). Tra gli oncogeni coinvolti con la patogenesi del PTC, solamente BRAFV600E è stato dimostrato avere un impatto negativo sull’outcome (Xing 2007; Elisei 2008), mentre ciò non si è dimostrato per i riarrangiamenti RET/PTC (Basolo 2001; Adeniran 2006). Mutazioni somatiche dell’oncosoppressore p53 o la sovraespressione della sua proteina codificata portano a una prognosi peggiore nell’ambito del ATC che è di per sè un tumore ad elevata mortalità (Pollina 1996). Similmente, la sovraespressione della proteina p21, che è codificata dall’oncogene RAS è stata associata a forme di carcinoma tiroideo più aggressive (Romano 1993). I risultati sopra riportati sono solamente l’inizio di un nuovo approccio alla biologia del tumore ed indicano che i prodotti degli oncogeni e degli oncosoppressori possono rivelare la prognosi dei tumori della tiroide.
Leggi anche:
- Eutirox: quando si usa, dosaggio ed effetti collaterali (foglio illustrativo)
- Differenza tra Eutirox e Ibsa nella cura dell’ipotiroidismo
- Ecografia della tiroide: a cosa serve, come si svolge e come ci si prepara all’esame
- Tiroidectomia totale: complicanze, postoperatorio e aumento di peso
- Non mangio eppure ingrasso, e se fosse ipotiroidismo?
- Ipotiroidismo: sintomi, diagnosi, cura farmacologica e consigli dietetici
Lo staff di Medicina OnLine
Se ti è piaciuto questo articolo e vuoi essere aggiornato sui nostri nuovi post, metti like alla nostra pagina Facebook o seguici su Twitter, su Instagram o su Pinterest, grazie!

 Una terapia si definisce “palliativa” (in inglese “palliative care“) quando non va direttamente a curare la causa della patologia, bensì si occupa di alleviare i sintomi che essa procura al paziente, dando la possibilità a quest’ultimo di godere della migliore qualità di vita possibile, specie in caso di malattia terminale, cioè una malattia che non può essere curata e che condurrà il paziente a morte in un tempo variabile.
Una terapia si definisce “palliativa” (in inglese “palliative care“) quando non va direttamente a curare la causa della patologia, bensì si occupa di alleviare i sintomi che essa procura al paziente, dando la possibilità a quest’ultimo di godere della migliore qualità di vita possibile, specie in caso di malattia terminale, cioè una malattia che non può essere curata e che condurrà il paziente a morte in un tempo variabile. La schizofrenia è una psicosi cronica caratterizzata dalla persistenza di sintomi di alterazione del pensiero, del comportamento e dell’affettività, da un decorso superiore ai sei mesi, con forte disadattamento della persona ovvero una gravità tale da limitare le normali attività di vita della persona.
La schizofrenia è una psicosi cronica caratterizzata dalla persistenza di sintomi di alterazione del pensiero, del comportamento e dell’affettività, da un decorso superiore ai sei mesi, con forte disadattamento della persona ovvero una gravità tale da limitare le normali attività di vita della persona. Il diabete mellito abbreviato DM è una forma di diabete ovvero un gruppo di disturbi metabolici accomunati dal fatto di presentare una persistente instabilità del livello glicemico del sangue, passando da condizioni di iperglicemia, più frequente, a condizioni di ipoglicemia. Sebbene il termine diabete si riferisca nella pratica comune alla sola condizione di diabete mellito come se fossero sinonimi, in realtà esiste un’altra forma di diabete detta diabete insipido, diversa dal diabete mellito. Tali malattie sono accomunate dal solo fatto di presentare abbondanti quantità di urine, non presentando infatti cause, né altri sintomi, comuni. Esistono principalmente due tipi di diabete mellito, il tipo 1 (una volta chiamato insulino-dipendente) ed il tipo 2 (insulino-resistente o insulino-non dipendente).
Il diabete mellito abbreviato DM è una forma di diabete ovvero un gruppo di disturbi metabolici accomunati dal fatto di presentare una persistente instabilità del livello glicemico del sangue, passando da condizioni di iperglicemia, più frequente, a condizioni di ipoglicemia. Sebbene il termine diabete si riferisca nella pratica comune alla sola condizione di diabete mellito come se fossero sinonimi, in realtà esiste un’altra forma di diabete detta diabete insipido, diversa dal diabete mellito. Tali malattie sono accomunate dal solo fatto di presentare abbondanti quantità di urine, non presentando infatti cause, né altri sintomi, comuni. Esistono principalmente due tipi di diabete mellito, il tipo 1 (una volta chiamato insulino-dipendente) ed il tipo 2 (insulino-resistente o insulino-non dipendente). Con nanismo si intende una situazione patologica caratterizzata dal mancato raggiungimento del livello staturale della media della popolazione. Si distinguono nanismi armonici e nanismi disarmonici. Più precisamente, si parla di nanismo quando l’altezza di un individuo risulta inferiore di tre deviazioni standard sulla curva di accrescimento normale stabilita in funzione dell’età e del sesso. Esistono infatti tabelle di accrescimento, elaborate a partire da ampie popolazioni infantili, che forniscono, per ogni età e sesso, un’altezza media normale ed il valore di una deviazione standard.
Con nanismo si intende una situazione patologica caratterizzata dal mancato raggiungimento del livello staturale della media della popolazione. Si distinguono nanismi armonici e nanismi disarmonici. Più precisamente, si parla di nanismo quando l’altezza di un individuo risulta inferiore di tre deviazioni standard sulla curva di accrescimento normale stabilita in funzione dell’età e del sesso. Esistono infatti tabelle di accrescimento, elaborate a partire da ampie popolazioni infantili, che forniscono, per ogni età e sesso, un’altezza media normale ed il valore di una deviazione standard.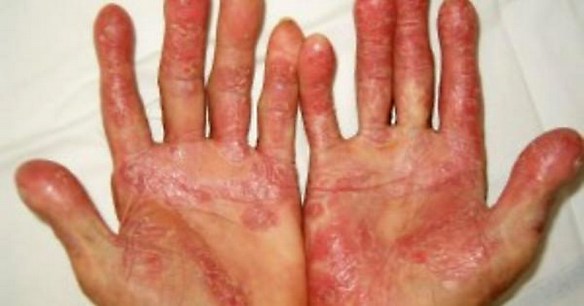 L’artrite psoriasica (AP) è una malattia infiammatoria articolare cronica che si associa una malattia cutanea chiamata psoriasi. Questa malattia è classificata tra le spondiloartriti sieronegative che sono un gruppo di malattie comprendenti anche la spondilite anchilosante, le artriti legate a malattie infiammatorie intestinali (Crohn e colite ulcerosa), le forme indifferenziate (che non rientrano cioè nelle precedenti ).
L’artrite psoriasica (AP) è una malattia infiammatoria articolare cronica che si associa una malattia cutanea chiamata psoriasi. Questa malattia è classificata tra le spondiloartriti sieronegative che sono un gruppo di malattie comprendenti anche la spondilite anchilosante, le artriti legate a malattie infiammatorie intestinali (Crohn e colite ulcerosa), le forme indifferenziate (che non rientrano cioè nelle precedenti ). L’artrite reumatoide (AR) è una poliartrite infiammatoria cronica, anchilosante e progressiva a patogenesi autoimmunitaria e di eziologia sconosciuta, principalmente a carico delle articolazioni sinoviali. Può provocare deformazione e dolore che possono portare fino alla perdita della funzionalità articolare.
L’artrite reumatoide (AR) è una poliartrite infiammatoria cronica, anchilosante e progressiva a patogenesi autoimmunitaria e di eziologia sconosciuta, principalmente a carico delle articolazioni sinoviali. Può provocare deformazione e dolore che possono portare fino alla perdita della funzionalità articolare.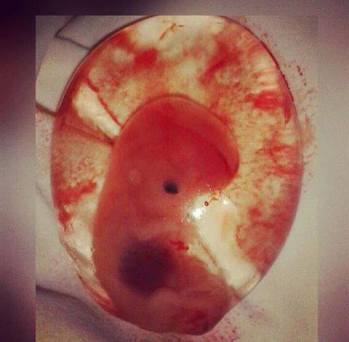 Con la terminologia “aborto spontaneo” si indica un’interruzione di gravidanza che avviene spontaneamente entro i primi 180 giorni di gravidanza. Nella maggioranza dei casi l’aborto spontaneo si verifica però nel corso del primo trimestre di gravidanza. È una condizione molto più diffusa di quanto si creda: si calcola infatti che possa interessare fino al 30% delle gravidanze. L’aborto spontaneo può essere “completo” (caratterizzato dall’espulsione spontanea totale dell’embrione o feto senza vita); oppure “incompleto” o “ritenuto” (quando la gravidanza è ancora parzialmente o completamente presente nella cavità uterina, ma non vi è attività cardiaca dell’embrione o feto).
Con la terminologia “aborto spontaneo” si indica un’interruzione di gravidanza che avviene spontaneamente entro i primi 180 giorni di gravidanza. Nella maggioranza dei casi l’aborto spontaneo si verifica però nel corso del primo trimestre di gravidanza. È una condizione molto più diffusa di quanto si creda: si calcola infatti che possa interessare fino al 30% delle gravidanze. L’aborto spontaneo può essere “completo” (caratterizzato dall’espulsione spontanea totale dell’embrione o feto senza vita); oppure “incompleto” o “ritenuto” (quando la gravidanza è ancora parzialmente o completamente presente nella cavità uterina, ma non vi è attività cardiaca dell’embrione o feto).